- Рефераты химии тему вода
- Общая характеристика.
- Нахождение в природе.
- Способы очистки.
- Физические свойства.
- Химические свойства.
- Применение воды
- Вода, ее свойства и значение
- Характеристика понятия, химических и физических свойств воды. Описание агрегатных состояний, изотопных модификаций воды. Анализ значения воды для существования жизни на Земле, изучение особенностей ее использования в различных сферах жизни человека.
- Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
- · «Твёрдое» — лёд
- · «Жидкое» — вода
- · «Газообразное» — водяной пар
- Биологическая роль и применение воды
- Факты
- · В среднем в организме растений и животных содержится более 50 % воды.
- · В составе мантии Земли воды содержится в 10-12 раз больше, чем количество воды в Мировом океане.
- · При средней глубине в 3,6 км Мировой океан покрывает около 71 % поверхности планеты и содержит 97,6 % известных мировых запасов свободной воды.
- · Если бы на Земле не было впадин и выпуклостей, вода покрыла бы всю Землю слоем толщиной 3 км.
- · Если бы все ледники растаяли, то уровень воды в земных океанах поднялся бы на 64 м и около 1/8 поверхности суши было бы затоплено водой.
- · Морская вода при обычной её солёности 35 ‰ замерзает при температуре ?1,91 °C.
- · Иногда вода замерзает при положительной температуре.
- · При определённых условиях (внутри нанотрубок) молекулы воды образуют новое состояние, при котором они сохраняют способность течь даже при температурах, близких к абсолютному нулю.
- · Вода отражает 5 % солнечных лучей, в то время как снег — около 85 %. Под лёд океана проникает только 2 % солнечного света.
- · Вода — это одно из немногих веществ в природе, которые расширяются при переходе из жидкой фазы в твёрдую (кроме воды, таким свойством обладают сурьма, висмут, галлий, германий и некоторые соединения и смеси).
- · Вода и водяной пар горят в атмосфере фтора фиолетовым пламенем. Смеси водяного пара со фтором в пределах взрывчатых концентраций взрывоопасны. В результате этой реакции образуются фтороводород и элементарный кислород.
- Подобные документы
Рефераты химии тему вода
l = 0,96 ангстрем
Ar(H) = 1 а.е.м.
Общая характеристика.
Формула — H2O (HOH);
Mr(H2O)=18 а.е.м.;
M(H2O)=18 г/моль
Нахождение в природе.
Вода — самое распространенное на земле вещество. Поверхность нашей планеты на 71 % покрыта водой. Но эти огромные ресурсы не пригодны для питья: 97 % всех вод Земли засолены; лишь 1 % — пресная вода; 2 % — это ледники.
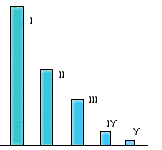 | I. Соленая вода океанов и морей — 1.370.000.000 км 3 II. Солоноватые подземные воды — 60.000.000 км 3 III.Весь запас пресной воды на Земле — 30.500.000 км 3 IV.Пресная вода в реках, озерах и почве — 826.000 км 3 V. Годовое потребление пресной воды населением Земли — 8.000 км 3 |
Вода — самый необходимый источник жизни для всего живого. Вода содержится в животных и растениях. Человек на 70 % состоит из воды ( а огурец аж на 97 % ).
Способы очистки.
1) Получение дистиллированной воды.
Чтобы очистить воду, от растворенных в ней веществ, применяют перегонку или дистилляцию .
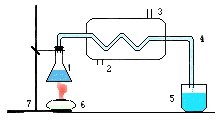 | 1. Колба с водой, содержащей соли. 2. Подача охладителя. 3. Отвод охладителя. 4. Стеклянная трубка. 5. Стакан с полученной дистиллированной водой. 6. Спиртовка. 7. Штатив. |
Сначала воду испаряют, при этом растворенные вещества оседают на стенках; затем пар конденсируют на холодном предмете. Дистиллированная вода не содержит растворенных веществ и потому широко применяется в науке и медицине. Большие количества дистиллированной воды получают в перегонных кубах.
2) Очистка воды от взвешенных в ней веществ и микроорганизмов.
Схема водоочистительной станции.
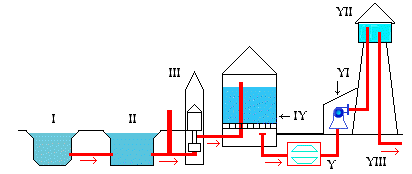 | I. Река. II.Отстойник. III.Колодец. IV.Фильтр. V.Устройство для хлорирования. VI.Насос. VII.Водонапорная башня. VIII.Подача очищенной воды в город. |
Природная вода всегда содержит примеси. В зависимости от целей ее использования применяют различные способы очистки. Если нужна чистая вода, без растворенных веществ и взвесей, применяют дистилляцию. Для питья можно использовать фильтрованную и хлорированную воду. Ее сначала отстаивают в специальных бассейнах ( для того, чтобы осели взвешенные вещества ), а затем фильтруют через слой песка. Очищенную от нерастворенных веществ, воду обрабатывают хлором или озоном, иногда ультрафиолетовыми лучами, чтобы убить вредные микробы.
Физические свойства.
Вода-самое распространенное на Земле вещество, но многие загадки воды до сих пор не разгаданы. Нам известно, что чистая ( дистиллированная ) вода-безцветная, безвкусная жидкость. Не пахнет, не проводит электроток. Имеет очень большую удельную теплоемкость (4200 Дж/кг o C), а потому используется в системах охлаждения и т.п. Плавится и кристаллизуется при 0 o C), кипит при 100 o C (кстати, Цельсий изобрел свою шкалу, основываясь на физических свойствах воды ! Он принял промежуток между температурами плавления и кипения воды = 100. Потом он разделил этот промежуток на 100 частей и принял каждую часть равной 1 o C).
Максимальная плотность воды равна 1000 кг/м 3 (1 г/см 3 ) (при 4 o C, а не при 0 o C — это одна из странностей поведения воды. Лед имеет меньшую плотность, чем незамерзшая вода, и поэтому он не опускается на дно реки, а лежит на поверхности.
Вот несколько свойств воды, которые были открыты в последнее время.
В жаркий летний день по озеру снуют водомерки. Они каким-то чудом удерживаются на поверхности, не проваливаясь вглубь. Здесь все дело в поверхности натяжения. Молекулы воды интенсивно притягиваются друг к другу и создают на поверхности воды как-бы пленку. Лапки водомерки имеют большую площадь и поэтому удерживаются на поверхности, т.е. на этой пленке.
Чай тоже можно налить выше краев стакана, благодаря тому же поверхностному натяжению. Чем чище вода ( т.е. чем меньше инородных молекул вклинено между молекулами воды ), тем прочнее эта пленка.
В лабораториях удалось получить столбик чистой воды диаметром 2,5 см. Для разрыва этого столбика потребовалось 900 кг. И это еще не предел очистки воды: ученые подсчитали, что если очистить воду полностью, то тогда столбик воды такого же диаметра выдержит 95 тонн. По поверхности абсолютно чистого озера можно было бы ходить, кататься на коньках !
Еще один феномен тщательно прорабатывался 40 лет назад. Речь идет о двигателях на . горячей воде. Если в прочном, герметически закрытом сосуде нагревать определенные количества воды до температуры 374 o C, то вода так и не превратится в пар. Почти в 3 раза уменьшится плотность; давление повысится до 225 атмосфер, но . Это теперь, по существу, не вода, а взрывчатое вещество, 1 кг которого по силе равен 50 гр тола. Вот если к такому сосуду присоединить сопло реактивного двигателя, то вода мгновенно вскипит, а из сопла вырвется струя пара со скоростью 1300-1500 м/с. Каждый килограмм пара в течение секунды создаст тягу в 130-150 кг. Двигатели на воде являются экологически чистыми, но подогревать ( теплоемкость 4200Дж/кг o C ) очень хлопотно.
Феноменом является наличие памяти у воды. Если воду подвергать воздействию малых магнитных полей, то в паровых котлах, чайниках снижается количество накипей, люди чувствуют себя гораздо лучше, растения развиваются быстрее . Эффект сохраняется около 6 часов. В лабораториях исследуют это свойство воды. При воздействии на воду магнитного поля начинают изменятся электропроводность, прозрачность, вязкость. Вода реагирует на магнитные бури и солнечные вспышки. Есть гипотезы о спиновой памяти воды (атомы в воде, как маленькие тумблеры, запоминают свое направление вращения, то есть атомы при изменениях внешнего поля меняют направление вращения ).
Вообще вода — очень таинственная жидкость.
Химические свойства.
Вода вступает в реакцию с очень многими веществами. Примеры некоторых реакций воды с различными веществами:
1. Вода вступает в реакцию с простыми веществами
а) с активными ( с щелочными ( I период таблицы Менделеева ) и щелочно-земельными ( II период таблицы Менделеева ). При этом образуется щелочь и водород.
Реакция замещения: 2 Li + 2 HOH = 2 LiOH + H2 ( литий + вода -> гидроксид лития + водород )
б) с некоторыми металлами. При этом продукты реакции различны.
Реакция замещения: С + H2O = H2 + CO ( углерод + вода -> водород + оксид углерода (II) )
2. Вода вступает в реакцию со сложными веществами.
а) с оксидами щелочных и щелочно-земельных металлов. При этом получаются щелочи.
Реакция соединения: CaO + HOH = Ca(OH)2 ( оксид кальция + вода -> гидроксид кальция )
б) с оксидами почти всех металлов, с образованием кислот.
Реакция соединения: SO3 + H2O = H2SO4 ( оксид серы (VI) + вода -> серная кислота )
3. Вода под действием тока разлагается на водород и кислород.
На этом основан анализ воды — метод определения состава вещества путем его разложения.
Реакция разложения: 2 H2O = 2 H2 + 2 O2 ( вода -> водород + кислород )
Применение воды
Роль воды в нынешней науке и технике очень велика. Вот только часть областей применения воды.
1. В сельском хозяйстве для полива растений и питания животных.
2. В химической промышленности для получения кислот, оснований, органических веществ.
3. В технике для охлаждения, в паровых двигателях.
4. В металлургии для выплавки металлов.
5. В медицине для приготовления лекарств.
В термоядерных реакторах для задержки нейтронов применяется тяжелая или сверхтяжелая вода (D2O, T2O соответственно; D — дейтерий, Т — тритий; это изотопы водорода).
Бурное развитие всех отраслей промышленности может повлечь за собой недостаток пресной воды. Чтобы изготовить 1 кг бумаги, требуется 100 л воды; чтобы вырастить корову требуется 100 л в сутки. Расход воды на одного городского жителя — около 40 литров в сутки. Экономисты посчитали, что все фабрики и заводы России » выпивают » за минуту целую реку Волгу. И это неудивительно. На производство одной тонны металла идет 500 тонн воды, на производство одной тонны капрона в 7-8 раз больше.
Источник
Вода, ее свойства и значение
Характеристика понятия, химических и физических свойств воды. Описание агрегатных состояний, изотопных модификаций воды. Анализ значения воды для существования жизни на Земле, изучение особенностей ее использования в различных сферах жизни человека.
| Рубрика | Химия |
| Вид | реферат |
| Язык | русский |
| Дата добавления | 02.03.2015 |
| Размер файла | 69,5 K |
Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru/
Вода (оксид водорода) — бинарное неорганическое соединение, химическая формула Н2O. Молекула воды состоит из двух атомов водорода и одного — кислорода, которые соединены между собой ковалентной связью. При нормальных условиях представляет собой прозрачную жидкость, не имеет цвета (в малом объёме), запаха и вкуса. В твёрдом состоянии называется льдом, снегом или инеем, а в газообразном — водяным паром. Вода также может существовать в виде жидких кристаллов (на гидрофильных поверхностях). Около 71 % поверхности Земли покрыто водой (океаны, моря, озёра, реки, льды) — 361,13 млн км2. На Земле примерно 96,5 % воды приходится на океаны, 1,7 % мировых запасов составляют грунтовые воды, ещё 1,7 % на ледники и ледяные шапки Антарктиды и Гренландии, небольшая часть в реках, озёрах и болотах, и 0,001 % в облаках (образуются из взвешенных в воздухе частиц льда и жидкой воды). Большая часть земной воды — солёная, и она непригодна для сельского хозяйства и питья. Доля пресной составляет около 2,5 %, причём 98,8 % этой воды находится в ледниках и грунтовых водах. Менее 0,3 % всей пресной воды содержится в реках, озёрах и атмосфере, и ещё меньшее количество (0,003 %) находится в живых организмах. Является хорошим сильнополярным растворителем. В природных условиях всегда содержит растворённые вещества (соли, газы). Вода имеет ключевое значение в создании и поддержании жизни на Земле, в химическом строении живых организмов, в формировании климата и погоды. Является важнейшим веществом для всех живых существ на планете Земля.
Вода на Земле может существовать в трёх основных состояниях — жидком, газообразном и твёрдом и приобретать различные формы, которые могут одновременно соседствовать друг с другом: водяной пар и облака в небе, морская вода и айсберги, ледники и реки на поверхности земли, водоносные слои в земле. Вода способна растворять в себе множество органических и неорганических веществ.
По особенностям происхождения, состава или применения, выделяют, в числе прочего:
· Мягкая вода и жёсткая вода — по содержанию катионов кальция и магния
· По изотопам водорода в молекуле:
o Лёгкая вода (по составу почти соответствует обычной)
o Тяжёлая вода (дейтериевая)
o Сверхтяжёлая вода (тритиевая)
· Солоноватая вода (en:Brackish water)
· Питьевая вода, Водопроводная вода
· Дистиллированная вода и деионизированная вода
· Ливневая вода или поверхностные воды
· Мёртвая вода и Живая вода — виды воды со сказочными свойствами
· Лёд-девять (вымышленный материал)
· Святая вода — особый вид воды с мистическими свойствами согласно религиозным учениям
· Структурированная вода — термин, применяемый в различных неакадемических теориях.
Химические названия воды
С формальной точки зрения вода имеет несколько различных корректных химических названий:
v Оксид водорода: бинарное соединение водорода с атомом кислорода в степени окисления ?2
v Монооксид дигидрогена
v Гидроксид водорода: соединение гидроксильной группы OH — и катиона (H + )
v Гидроксильная кислота: воду можно рассматривать как соединение катиона H + , который может быть замещён металлом, и «кислотного остатка» OH —
Атомы водорода и кислорода в молекуле воды расположены в углах равнобедренного треугольника с длиной связи О—Н 0,0957 нм; валентный угол Н—О—Н 104,5°; дипольный момент 6,17*10 -30 Кл*м; поляризуемость молекулы 1,45*10 -3 нм 3 ; средний квадрупольный момент — 1,87*10 -41 Кл*м 2 , энергия ионизации 12,6 эВ, сродство к протону 7,1 эВ. При взаимодействии молекулы воды с другими атомами, молекулами и ионами, в том числе с другими молекулами воды в конденсированных фазах, эти параметры изменяются.
Физические свойства воды аномальны. Плавление льда при атмосферном давлении сопровождается уменьшением объема на 9%. Температурный коэффициент объемного расширения льда и жидкой воды отрицателен при температурах ниже -210°С и 3,98 °С. Теплоемкость С° при плавлении возрастает почти вдвое и в интервале 0-100°С почти не зависит от температуры (имеется минимум при 35 °С). При низких давлениях и температурах до 30 °С вязкость воды с ростом давления падает. Высокие диэлектрическая проницаемость и дипольный момент воды определяют ее хорошую растворяющую способность по отношению к полярным и ионогенным веществам. Благодаря высоким значениям С°, и вода — важный регулятор климатических условий на земле, стабилизирующий температуру на ее поверхности. Кроме того, близость угла Н—О—Н к тетраэдрическому (109° 28′) обусловливает рыхлость структур льда и жидкой воды и, как следствие, аномальную зависимость плотности от температуры. Поэтому не промерзают до дна крупные водоемы, что делает возможным существование в них жизни. Вода обладает также высоким поверхностным натяжением среди жидкостей, уступая в этом только ртути. Относительно высокая вязкость воды обусловлена тем, что водородные связи мешают молекулам воды двигаться с разными скоростями. Вода является хорошим растворителем полярных веществ. Каждая молекула растворяемого вещества окружается молекулами воды, причём положительно заряженные участки молекулы растворяемого вещества притягивают атомы кислорода, а отрицательно заряженные — атомы водорода. Поскольку молекула воды мала по размерам, много молекул воды могут окружить каждую молекулу растворяемого вещества.
· «Твёрдое» — лёд
· «Жидкое» — вода
· «Газообразное» — водяной пар
При нормальном атмосферном давлении (760 мм рт. ст., 101 325 Па) вода переходит в твердое состояние при температуре в 0 °C и кипит (превращается в водяной пар). При температуре 100 °C (температура 0 °C и 100 °C были специально выбраны как температура таяния льда и кипения воды при создании температурной шкалы «по Цельсию»). При снижении давления температура таяния (плавления) льда медленно растёт, а температура кипения воды — падает. При давлении в 611,73 Па (около 0,006 атм) температура кипения и плавления совпадает и становится равной 0,01 °C. Такие давление и температура называются тройной точкой воды. При более низком давлении вода не может находиться в жидком состоянии, и лёд превращается непосредственно в пар. Температура возгонки (сублимации) льда падает со снижением давления. При высоком давлении существуют модификации льда с температурами плавления выше комнатной. С ростом давления температура кипения воды растёт. При росте давления плотность насыщенного водяного пара в точке кипения тоже растёт, а жидкой воды — падает. При температуре 374 °C (647 K) и давлении 22,064 МПа (218 атм) вода проходит критическую точку. В этой точке плотность и другие свойства жидкой и газообразной воды совпадают. При более высоком давлении и/или температуре исчезает разница между жидкой водой и водяным паром. Такое агрегатное состояние называют «сверхкритическая жидкость». Вода может находиться в метастабильных состояниях — пересыщенный пар, перегретая жидкость, переохлаждённая жидкость. Эти состояния могут существовать длительное время, однако они неустойчивы и при соприкосновении с более устойчивой фазой происходит переход. Например, можно получить переохлаждённую жидкость, охладив чистую воду в чистом сосуде ниже 0 °C, однако при появлении центра кристаллизации жидкая вода быстро превращается в лёд.
Изотопные модификации воды. Изотопный состав
вода модификация изотопный свойство
Существует 9 устойчивых изотопных разновидностей воды. Содержание их в пресной воде в среднем следующее (мол. %): 1 Н2 16 О — 99,13; 1 Н2 18 О — 0,2; 1 Н2 17 0-0,04; 1 Н 2 О 16 О-0,03; остальные пять изотопных разновидностей присутствуют в воде в ничтожных количествах. Кроме стабильных изотопных разновидностей, в воде содержится небольшое количество радиоактивного 3 Н2 (или Т2О). Изотопный состав природной воды разного происхождения несколько варьирует. Особенно непостоянно отношение 1 Н/ 2 Н: в пресных водах — в среднем 6900, в морской воде -5500, во льдах — 5500-9000. По физическим свойствам D2O заметно отличается от обычной воды. Вода, содержащая 18 О, по свойствамвам ближе к воде с 16 О. И кислород, и водород имеют природные и искусственные изотопы. В зависимости от типа изотопов водорода, входящих в молекулу, выделяют следующие виды воды:
· Лёгкая вода (основная составляющая привычной людям воды) .
· Тяжёлая вода (дейтериевая) .
· Сверхтяжёлая вода (тритиевая) .
Биологическая роль и применение воды
Вода играет уникальную роль как вещество, определяющее возможность существования и саму жизнь всех существ на Земле. Она выполняет роль универсального растворителя, в котором происходят основные биохимические процессы живых организмов. Она достаточно хорошо растворяет как органические, так и неорганические вещества, обеспечивая высокую скорость протекания химических реакций и в то же время — достаточную сложность образующихся комплексных соединений.
Благодаря водородной связи, вода остаётся жидкой в широком диапазоне температур, причём именно в том, который широко представлен на планете Земля в настоящее время.
Поскольку у льда плотность меньше, чем у жидкой воды, вода в водоемах замерзает сверху, а не снизу. Образовавшийся слой льда препятствует дальнейшему промерзанию водоема, это позволяет его обитателям выжить. Применение повсеместно. Воду используют в тяжелой и легкой промышленности, медицине, металлургии, сельском хозяйстве, косметологии, пищевой промышленности и т.д.
Факты
· В среднем в организме растений и животных содержится более 50 % воды.
· В составе мантии Земли воды содержится в 10-12 раз больше, чем количество воды в Мировом океане.
· При средней глубине в 3,6 км Мировой океан покрывает около 71 % поверхности планеты и содержит 97,6 % известных мировых запасов свободной воды.
· Если бы на Земле не было впадин и выпуклостей, вода покрыла бы всю Землю слоем толщиной 3 км.
· Если бы все ледники растаяли, то уровень воды в земных океанах поднялся бы на 64 м и около 1/8 поверхности суши было бы затоплено водой.
· Морская вода при обычной её солёности 35 ‰ замерзает при температуре ?1,91 °C.
· Иногда вода замерзает при положительной температуре.
· При определённых условиях (внутри нанотрубок) молекулы воды образуют новое состояние, при котором они сохраняют способность течь даже при температурах, близких к абсолютному нулю.
· Вода отражает 5 % солнечных лучей, в то время как снег — около 85 %. Под лёд океана проникает только 2 % солнечного света.
· Вода — это одно из немногих веществ в природе, которые расширяются при переходе из жидкой фазы в твёрдую (кроме воды, таким свойством обладают сурьма, висмут, галлий, германий и некоторые соединения и смеси).
· Вода и водяной пар горят в атмосфере фтора фиолетовым пламенем. Смеси водяного пара со фтором в пределах взрывчатых концентраций взрывоопасны. В результате этой реакции образуются фтороводород и элементарный кислород.
Размещено на Allbest.ru
Подобные документы
Вода (оксид водорода) — бинарное неорганическое соединение. Описание строения молекулы воды, ее физических и химических свойств. Общий запас воды на Земле, сферы ее применения. Рассмотрение аномалий данной жидкости, отличающих ее от других природных тел.
реферат [1,2 M], добавлен 27.04.2015
Строение молекулы воды. Водородные связи между молекулами воды. Физические свойства воды. Жесткость как одно из свойств воды. Процесс очистки воды. Использованием воды, способы ее восстановления. Значимость воды для человека на сегодняшний день.
презентация [672,3 K], добавлен 24.04.2012
Изучение физико-химических свойств воды. Химическая природа воды и ее память (структура, свойства, состав). Схема образования связей в молекуле воды. Состояние водных объектов города Рязани. Антропогенное и техногенное воздействие на воду. Лечение водой.
реферат [439,9 K], добавлен 27.10.2010
Анализ физико-химических и аномальных свойств воды — самого важного вещества на Земле, без которого не может существовать ни один живой организм, и не могут протекать ни какие биологические, химические реакции и технологические процессы. Кластерная вода.
реферат [33,6 K], добавлен 20.03.2011
Распределение воды в природе, ее биологическая роль и строение молекулы. Химические и физические свойства воды. Исследования способности воды к структурированию и влияния информации на форму ее кристаллов. Перспективы использования структурированной воды.
реферат [641,8 K], добавлен 29.10.2013
Источник




