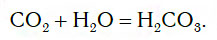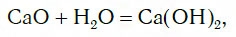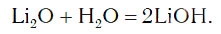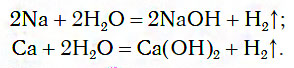- Вода: строение и свойства
- Физические свойства
- Химические свойства
- С чем реагирует вода без нагревания
- Урок 28. Химические свойства воды
- Взаимодействие с оксидами неметаллов
- Взаимодействие с оксидами металлов
- Взаимодействие с металлами
- Химические свойства воды
- Химические свойства воды
- Вода и ее химические свойства
- Библиографическое описание:
Вода: строение и свойства
Вода — строение молекулы, химические и физические свойства. Взаимодействие с простыми веществами (металлами и неметаллами), и со сложными веществами.
Физические свойства
Молекулы воды связаны водородными связями: nH2O = (Н2O)n, поэтому вода жидкая в отличие от ее газообразных аналогов H2S, H2Se и Н2Те.
Химические свойства
1. Вода реагирует с металлами и неметаллами .
1.1. С активными металлами вода реагирует при комнатной температуре с образованием щелочей и водорода :
2Na + 2H2O → 2NaOH + H2
- с магнием реагирует при кипячении:
- алюминий не реагирует с водой, так как покрыт оксидной плёнкой. Алюминий, очищенный от оксидной плёнки, взаимодействует с водой, образуя гидроксид:
- металлы, расположенные в ряду активности от Al до Н , реагируют с водяным паром при высокой температуре, образуя оксиды и водород:
- металлы, расположенные в ряду активности от после Н , не реагируют с водой:
Ag + Н2O ≠
2. Вода реагирует с оксидами щелочных и щелочноземельных металлов , образуя щелочи (с оксидом магния – при кипячении):
3. Вода взаимодействует с кислотными оксидами (кроме SiO2):
4. Некоторые соли реагируют с с водой. Как правило, в таблице растворимости такие соли отмечены прочерком :
Например , сульфид алюминия разлагается водой:
5. Бинарные соединения металлов и неметаллов , которые не являются кислотами и основаниями, разлагаются водой.
Например , фосфид кальция разлагается водой:
6. Бинарные соединения неметаллов также гидролизуются водой.
Например , фосфид хлора (V) разлагается водой:
6. Некоторые органические вещества гидролизуются водой или вступают в реакции присоединения с водой (алкены, алкины, алкадиены, сложные эфиры и др.).
Источник
С чем реагирует вода без нагревания
1.2. Химические свойтсва воды
Вода активное в химическом отношении вещество.
1. Вода реагирует со многими металлами с выделением водорода .
Железо реагирует с водой при нагревании по реакции:
Не все, а только достаточно активные металлы могут участвовать в окислительно-восстановительных реакциях такого типа. Наиболее легко реагируют щелочные и щелочноземельные металлы I и II групп.
Из неметаллов с водой реагируют, например, углерод и его водородное соединение (метан). Эти вещества гораздо менее активны, чем металлы, но все же способны реагировать с водой при высокой температуре:
С + H2O = H2 + СО (при сильном нагревании)
2. Вода разлагается на водород и кислород при действии электрического тока. Это также окислительно-восстановительная реакция, где вода является одновременно и окислителем, и восстановителем.
3. Вода реагирует со многими оксидами неметаллов. В отличие от предыдущих, эти реакции не окислительно-восстановительные, а реакции соединения.
4. Некоторые оксиды металлов также могут вступать во взаимодействие с водой.
СаО + Н2О = Са(ОН)2 гидроксид кальция или гашеная известь)
Не все оксиды металлов способны реагировать с водой. Часть из них практически нерастворима в воде и поэтому с водой не реагирует. Это ZnO, TiO2, Cr2O3, из которых приготавливают стойкие к воде краски. Оксиды железа и алюминия также не растворимы в воде и не реагируют с ней.
5. Вода образует многочисленные соединения, в которых ее молекула полностью сохраняется. Это гидраты. Если гидрат кристаллический, то он называется кристаллогидратом. Например:
NaOH + H2O = NaOH H2O гидрат едкого натра
Соединения, связывающие воду в гидраты и кристаллогидраты, используют в качестве осушителей. С помощью их, например, удаляют водяные пары из влажного атмосферного воздуха.
6. Особая реакция воды – синтез растениями крахмала (С6Н10О5)n и других подобных соединений (углеводов), происходящая с выделением кислорода.
7. В комплексных соединениях вода является лигандом и координируется как катионами [Cr(H2O)6]Cl3, [Pt(H2O)2Cl4], так и анионами [A(H2O)m]n-.
8. При взаимодействии с солями происходит гидролиз последних с образованием кислых, основных и средних солей:
Процесс ступенчатого гидролиза солей используют при очистке воды с помощью коагулянтов. Например, при использовании в качестве коагулянта сернокислого алюминия, ступенчатый гидролиз соли протекает по схеме:
Источник
Урок 28. Химические свойства воды
В уроке 28 «Химические свойства воды» из курса «Химия для чайников» узнаем о взаимодействии воды с различными веществами.
При обычных условиях вода является достаточно активным веществом по отношению к другим веществам. Это означает, что со многими из них она вступает в химические реакции.
Взаимодействие с оксидами неметаллов
Если струю газообразного оксида углерода(IV) CO2 (углекислого газа) направить в воду, то часть его растворится в ней (рис. 109).
При этом в растворе протекает химическая реакция соединения, в результате которой образуется новое вещество — угольная кислота H2CO3:
На заметку: Собирая углекислый газ над водой, Дж. Пристли обнаружил, что часть газа растворяется в воде и придает ей приятный терпкий вкус. По сути дела, Пристли впервые получил напиток типа газированной, или содовой, воды.
Реакция соединения происходит также, если к воде прибавить твердый оксид фосфора(V) P2O5. При этом протекает химическая реакция с образованием фосфорной кислоты H3PO4 (рис. 110):
Испытаем растворы, полученные при взаимодействии CO2 и P2O5 с водой, индикатором метиловым оранжевым. Для этого прибавим по 1—2 капли раствора индикатора к полученным растворам. Цвет индикатора изменится с оранжевого на красный, что говорит о присутствии кислот в растворах. Значит, при взаимодействии CO2 и P2O5 с водой действительно образовались кислоты H2CO3 и H3PO4.
Оксиды, подобные CO2 и P2O5, которые при взаимодействии с водой образуют кислоты, относят к кислотным оксидам.
Кислотные оксиды — это оксиды, которым соответствуют кислоты.
Некоторые из кислотных оксидов и соответствующих им кислот приведены в таблице 11. Обратите внимание, что это оксиды элементов неметаллов. Как правило, оксиды неметаллов являются кислотными оксидами.
Взаимодействие с оксидами металлов
С оксидами металлов вода реагирует иначе, чем с оксидами неметаллов.
Исследуем взаимодействие оксида кальция CaO с водой. Для этого поместим в стакан с водой небольшое количество CaO и тщательно перемешаем. При этом протекает химическая реакция:
в результате которой образуется новое вещество Ca(OH)2, относящееся к классу оснований. Таким же образом реагируют с водой оксиды лития, натрия. При этом также образуются основания, например:
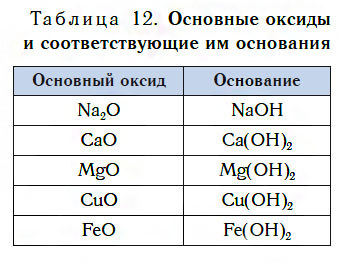
Подробнее с основаниями вы познакомитесь в следующем уроке. Оксиды металлов, которым соответствуют основания, называют основными оксидами.
Основные оксиды — это оксиды, которым соответствуют основания.
В таблице 12 приведены формулы некоторых основных оксидов и соответствующих им оснований. Заметьте, что, в отличие от кислотных оксидов, в состав основных оксидов входят атомы металлов. Большинство оксидов металлов — это основные оксиды.
Несмотря на то что каждому основному оксиду соответствует основание, не все основные оксиды взаимодействуют с водой, подобно CaO, образуя основания.
Взаимодействие с металлами
При обычных условиях активные металлы (K, Na, Ca, Ba и др.) бурно реагируют с водой:
В этих реакциях выделяется водород и образуются растворимые в воде основания.
Как химически активное вещество вода вступает в реакции со многими другими веществами, но об этом вы узнаете при дальнейшем изучении химии.
Краткие выводы урока:
- Вода — химически активное вещество. Она вступает в реакции с кислотными и основными оксидами, активными металлами.
- При взаимодействии воды с большинством кислотных оксидов образуются соответствующие кислоты.
- Некоторые основные оксиды при реакции с водой образуют растворимые основания.
- При обычных условиях вода реагирует с наиболее активными металлами. При этом образуются растворимые основания и водород.
Надеюсь урок 28 «Химические свойства воды» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Источник
Химические свойства воды
Вода окружает нас повсюду, без неё человек не может жить. Мы на каждом шагу встречаемся с собственно водой и с водными растворами (например, морской водой или даже водопроводной). А может ли вода вступать в химические реакции и в каких случаях это происходит? Сейчас мы это и узнаем.
Химические свойства воды
1. Вода при высокой температуре или пропускании тока разлагается на газообразные водород кислород:
2. Вода взаимодействует с активными металлами с образованием гидроксидов и газообразного водорода. К активным металлам относятся металлы первой и второй групп таблицы Менделеева. С щелочными металлами (металлы первой группы) реакции идут довольно активно, поскольку газообразный водород выделяется бурно, поэтому проводить их нужно очень аккуратно. Уравнение реакции между щелочным металлом калием и водой выглядит так:
2К + 2Н2О = 2КОН + Н2
Аналогично протекают и реакции между щелочно-земельными металлами (металлами второй группы) и водой.
3. Вода взаимодействует с менее активными металлами с образованием оксидов и газообразного водорода. Например, цинк при взаимодействии с водой даёт оксид цинка и водород:
Zn + O2 = ZnO + H2
С инертными металлами (в ряду напряжений они стоят после водорода) вода не взаимодействует.
4. Вода взаимодействует с основными оксидами с образованием гидроксидов :
МgO + H2O = Mg(OH)2
5. Вода взаимодействует с кислотными оксидами с образованием кислот:
SO3 + H2O = H2SO4
А ещё воды является чуть ли не главным растворителем. В ней растворяются и газы, и жидкости и твёрдые вещества, причём в зависимости от условий можно получать самые разные растворы. С образованием растворов связано понятие массовой доли растворённого вещества . Понимать, как рассчитывать массовую долю растворённого вещества, очень важно, поскольку в неорганической химии много задач связано именно с этим.
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
Источник
Вода и ее химические свойства
Дата публикации: 25.02.2019 2019-02-25
Статья просмотрена: 6385 раз
Библиографическое описание:
Калякин, С. Н. Вода и ее химические свойства / С. Н. Калякин, С. Л. Покутняя. — Текст : непосредственный // Юный ученый. — 2019. — № 3 (23). — С. 20-23. — URL: https://moluch.ru/young/archive/23/1404/ (дата обращения: 21.10.2021).
Понять воду, значит понять Вселенную.
Масару Эмото (1943–2014), японский исследователь
Вода — один из самых распространённых соединений на нашей планете. Именно она является главной составляющей всего живого на планете, но также вода входит в состав комет, большинства планет солнечной системы и их спутников. Без воды нет жизни: ведь жизнь на Земле появилась только тогда, когда на ней появилась вода. Вся жизнь зародилась в воде, поскольку она является естественным универсальным растворителем, а значит вода растворяет питательные вещества и обеспечивает ими клетки живых организмов. Если рассматривать показатель количества данного оксида во всех агрегатных состояниях, то его на планете около 75 % от общей массы. По примерным подсчетам ученых на планете 1.4087 млрд. км 3 воды (причем соленой воды от общего объема примерно 97 %, пресной всего 3 %).
Да и сам человек на 60–80 % (в зависимости от возраста) состоит из воды. Большая часть воды — это кровь, жидкость в выделительной системе, мускулах, мозге и других органах, а также в костях и коже.
В понятии химии вода — это H2O, то есть две молекулы водорода и одна молекула кислорода. Но это дистиллированная вода. В природе вода содержит различные примеси и очень редко встречается в чистом виде. При взаимодействии водорода с кислородом происходит выделение большого количества тепла. Это соединение очень устойчивое, молекулы которого распадаются только при температуре 1500°С.
Каждая молекула ориентирована вокруг другой, и все вместе они формируют общую кристаллическую решетку. Оксид построен в форме тетраэдра — атом кислорода в центре, а две пары электронов его и два атома водорода вокруг асимметрично. Если провести через центры ядер атомов линии и соединить их, то получится именно тетраэдрическая геометрическая форма. Угол между центром атома кислорода и ядрами водородов составляет 104,5 0 . Длина связи О-Н = 0,0957 нм. Наличие электронных пар кислорода, а также его большее в сравнении с водородами сродство к электрону обеспечивают формирование в молекуле отрицательно заряженного поля. В противовес ему ядра водородов образуют положительно заряженную часть соединения. Таким образом, выходит, что молекула воды — диполь. Это определяет то, какой может быть вода и ее свойства. Для живых существ эти особенности играют жизненно важную роль.
Рис. 1 Строение атома воды и оксид в виде тетраэдра
Вода — весьма активное в химическом отношении вещество. Большая часть химии, при её зарождении как науки, начиналась именно как химия водных растворов веществ, именно поэтому вода — это определяющий характер химии. Вода имеет различные физические и химические свойства, но посмотрим на воду с химической точки зрения.
- Биохимические свойства воды.
Вода является неотъемлемой частью всех биохимических процессов организма, являясь растворителем, катализатором и средой. Вода способна растворять некоторые кислоты, основания и соли, представляющие ионные соединения и некоторые полярные неионные образования (простые спирты, сахара и аминокислоты). Благодаря воде сохраняется упругость и объем живой клетки, многие химические процессы организма протекают именно в водных растворах. Эти свойства дают клеткам теплопроводимость и теплоемкость, обеспечивающие терморегуляцию и защищает от температурных перепадов.
Без воды невозможен гидролиз — химическая реакция, которая сопровождает усвоение белков, жиров, углеводов, а ведь именно они являются обязательным компонентом нашей пищи, так, например, белок распадается на аминокислоты, углевод на глюкозу, жиры на глицерин. В результате этого процесса сложные органические вещества распадаются до простых веществ, которые, легко усваиваются живым организмом.
- Вода-растворитель
Вода является наиболее распространённым растворителем на нашей планете. По растворимости в воде вещества делятся на три группы:
1) Хорошо растворимые: (сахар (С12Н22О11), гидроксид натрия (NaOH), спирт (C2H5OH), хлороводород (HCl).
2) Мало растворимые: (гипс, сульфат свинца (PbSO4), бензол (C6H6), метан (СH4), кислород).
3) Практически не растворимые: (стекло, серебро (Ag), золото (Au), керосин, растительное масло).
Из этого можно сделать вывод, что растворимость вещества прежде всего зависит от природы этого вещества, а также от температуры и давления окружающей среды. Сам процесс растворения обуславливается взаимодействием частиц растворителя и растворяемого вещества.
- Вода— активное химическое вещество.
Вода может взаимодействовать:
1) с металлами с выделением водорода:
− с активными 2Na + 2H2O → H2 + 2NaOH (бурно)
− со средней активностью до H 3Fe + 4H2O → 4H2 + Fe3O4 (только при нагревании)
− с малоактивными после H (не взаимодействуют) Cu+ H2O ≠
Достаточно активные металлы могут участвовать в окислительно-восстановительных реакциях этого типа. Наиболее легко реагируют щелочные и щелочноземельные металлы I и II групп.
2) с неметаллами:
Из неметаллов с водой реагируют углерод и его водородное соединение (метан). Эти вещества гораздо менее активны, чем металлы, но все же способны реагировать с водой при высокой температуре:
C + H2O → H2 + CO (при сильном нагревании)
3) с оксидами неметаллов:
Вода реагирует со многими оксидами неметаллов. В отличие от предыдущих, эти реакции не окислительно-восстановительные, а реакции соединения:
4) с оксидами металлов
Некоторые оксиды металлов также могут вступать в реакции соединения с водой.
CaO+ H2O → Ca(OH)2 гидроксид кальция (гашеная известь)
Не все оксиды металлов способны реагировать с водой. Часть из них практически не растворима в воде и поэтому с водой не реагирует: ZnO, TiO2, Cr2O3, из которых изготовляют, например, стойкие к воде краски. Оксиды железа также не растворимы в воде и не реагируют с ней.
5) с газами
Как говорилось в подпункте 4 вода взаимодействует с оксидами неметаллов. В данном случае CO2 — это газ. Если струю газообразного оксида углерода (IV) CO2 направить в воду, то часть его раствориться в ней. В этом растворе произойдет химическая реакция соединения и образуется вещество — угольная кислота H2CO3. Собирая углекислый газ над водой, ученый Джозеф Пристли обнаружил, что часть газа растворяется в воде и придает ей приятный терпкий вкус. По сути, Пристли впервые получил напиток газированный или содовой воды. Позже ученый Торберн Бергман создал аппарат, позволяющий насыщать жидкость углекислым газом под давлением и назвав его сатуратором.
Рис. 2 Джозеф Пристли и его прибор для исследования газов.
6) Гидраты.
Вода образует многочисленные соединения, в которых ее молекула полностью сохраняется. Это так называемые гидраты. Если гидрат кристаллический, то он называется кристаллогидратом.
NaOH + H2O → NaOH . H2O (гидрат едкого натра)
Соединения, связывающие воду в гидраты и кристаллогидраты, используют в качестве осушителей. С их помощью удаляют водяные пары из влажного атмосферного воздуха.
7) Фотосинтез растений.
Фотосинтез — процесс, протекающий в зеленных листьях растений с использованием энергии света, при котором из углекислого газа и воды образуются органические вещества и кислород. Синтез растениями крахмала (C6H10O5)n и других подобных соединений (углеводов), происходящая с выделением кислорода:
Рис. 3. Фотосинтез растений, как химическая реакция.
8) Электролиз воды.
Вода разлагается на водород и кислород при действии электрического тока. Это также окислительно-восстановительная реакция, где вода является одновременно и окислителем, и восстановителем.
Под действием электричества электрод, подключенный к отрицательному полюсу, становится катодом, а электрод, соединённый с положительным полюсом, превращается в анод. Катод и анод притягивают противоположные ионы: к катоду направляются положительно заряженные катионы, к аноду — отрицательно заряженные анионы.
Схема электролиза воды:
Вода — слабый электролит, поэтому электролиз чистой, дистиллированной воды протекает медленно или не идёт вовсе. Для ускорения процесса в воду добавляют сильный электролит, увеличивающий проводимость электрического тока, катионы которого будут иметь меньший электродный потенциал, чем H+ воды.
- Минерализация воды
Минерализация — это показатель количества содержащихся в воде растворенных веществ (неорганические соли неорганические вещества). Как правило, это бикарбонаты, хлориды, сульфаты кальция, магния, калия, натрия и других веществ. Минерализацию считают в грамм на литр (г/л) или грамм на дециметр в кубе (г/дм 3 ). С точки зрения бальнеологии по степени минерализации воду классифицируют на:
− Столовую — минерализация до 1 г/л
− Лечебно-столовую — минерализация от 1 г/л до 10 г/л
− Лечебная — минерализация более 10 г/л или высокое содержание биологически активных элементов: железо, брома, йода, сероводорода, фтора и т. д., при этом общая минерализация может быть невысокой.
Свойство минерализации основано на дипольном моменте оксида водорода. Благодаря его наличию молекулы способны присоединять к себе множество других веществ ионов и удерживать их. Так формируются ассоциаты, клатраты и прочие объединения.
- Жесткость воды.
Жесткость воды — совокупность свойств, обусловленных содержанием в воде катионов кальция Ca 2+ и магния Mg 2+ (так называемых солей жесткости).
Из-за разного объема различных примесей в воде, она делится на два типа-жесткую и мягкую. Соли попадают в воду из-за того, что часть дождевых вод превращаются в грунтовую воду. Они протекают в недрах Земли, соприкасаются с минералами кальция и магния, вымывая из них мелкие частички. В воде, насыщенной углекислотой, карбонаты калия и магния растворяются, так как превращаются в кислые соли. В таком растворимом виде гидрокарбонаты металлов остаются в воде и обуславливают временную жесткость. При кипячении такой воды гидрокарбонаты разлагаются и выпадают в осадок. Но также существует постоянная жесткость, обуславливая присутствием в природной воде растворимых хлоридов и сульфатом кальция и магния. Жесткость воды количественно выражают числом ммоль эквивалентов (ммоль/экв) ионов кальция Ca 2+ и магния Mg 2+ .
В жесткой воде плохо мылится мыло, которое представляет собой натриевые соли высших карбонатных кислот. Для устранения жесткости воды (ее умягчения) необходимы ионы Ca 2+ и Mg 2+ перевести в осадок. Временную карбонатную жесткость устраняют кипячение:
Ca(HCO3)2 
Постоянную жесткость кипячением устранить нельзя. Для этого добавляют в воду смесь гашенной извести Ca(OH)2 или соды Na2CO3
Са(НСО3)2 + Са(ОН)2 → 2СаСO3↓ + 2Н2O
- Теория Льюиса
В теории Льюиса (1923 г.) на основе электронных представлений было ещё более расширено понятие кислоты и основания. С точки зрения теории Льюиса — вода — это слабая кислота и слабое основание одновременно (амфолит). То есть можно сказать о некоторой амфотерности воды в химических свойствах.
Подводя итог вышесказанного можно сказать, что вода — это самое уникальное вещество на земле. Академик Владимир Иванович Вернадский писал: «Вода стоит особняком в истории нашей планеты. Нет природного тела, которое могло бы с ней сравниться по влиянию на ход основных, самых грандиозных, геологических процессов. Не только земная поверхность, но и глубокие — в масштабе биосферы — части планеты определяются, в самых существенных своих проявлениях, ее существованием и ее свойствами». Действительно, нет более важного для нас вещества на Земле, чем обыкновенная вода, и в то же время не существует другого такого же вещества, в свойствах которого было бы столько противоречий и аномалий, как в свойствах воды.
Источник