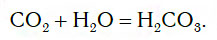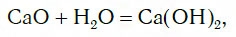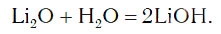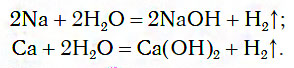- Урок 28. Химические свойства воды
- Взаимодействие с оксидами неметаллов
- Взаимодействие с оксидами металлов
- Взаимодействие с металлами
- Все химические реакции, которые необходимы для успешной сдачи ОГЭ
- Правило 1.1. Взаимодействие простых веществ (металлов и неметаллов) с водой
- Правило 1.2. Взаимодействие оксидов с водой
- С неметаллами могут образовать воду
Урок 28. Химические свойства воды
В уроке 28 «Химические свойства воды» из курса «Химия для чайников» узнаем о взаимодействии воды с различными веществами.
При обычных условиях вода является достаточно активным веществом по отношению к другим веществам. Это означает, что со многими из них она вступает в химические реакции.
Взаимодействие с оксидами неметаллов
Если струю газообразного оксида углерода(IV) CO2 (углекислого газа) направить в воду, то часть его растворится в ней (рис. 109).
При этом в растворе протекает химическая реакция соединения, в результате которой образуется новое вещество — угольная кислота H2CO3:
На заметку: Собирая углекислый газ над водой, Дж. Пристли обнаружил, что часть газа растворяется в воде и придает ей приятный терпкий вкус. По сути дела, Пристли впервые получил напиток типа газированной, или содовой, воды.
Реакция соединения происходит также, если к воде прибавить твердый оксид фосфора(V) P2O5. При этом протекает химическая реакция с образованием фосфорной кислоты H3PO4 (рис. 110):
Испытаем растворы, полученные при взаимодействии CO2 и P2O5 с водой, индикатором метиловым оранжевым. Для этого прибавим по 1—2 капли раствора индикатора к полученным растворам. Цвет индикатора изменится с оранжевого на красный, что говорит о присутствии кислот в растворах. Значит, при взаимодействии CO2 и P2O5 с водой действительно образовались кислоты H2CO3 и H3PO4.
Оксиды, подобные CO2 и P2O5, которые при взаимодействии с водой образуют кислоты, относят к кислотным оксидам.
Кислотные оксиды — это оксиды, которым соответствуют кислоты.
Некоторые из кислотных оксидов и соответствующих им кислот приведены в таблице 11. Обратите внимание, что это оксиды элементов неметаллов. Как правило, оксиды неметаллов являются кислотными оксидами.
Взаимодействие с оксидами металлов
С оксидами металлов вода реагирует иначе, чем с оксидами неметаллов.
Исследуем взаимодействие оксида кальция CaO с водой. Для этого поместим в стакан с водой небольшое количество CaO и тщательно перемешаем. При этом протекает химическая реакция:
в результате которой образуется новое вещество Ca(OH)2, относящееся к классу оснований. Таким же образом реагируют с водой оксиды лития, натрия. При этом также образуются основания, например:
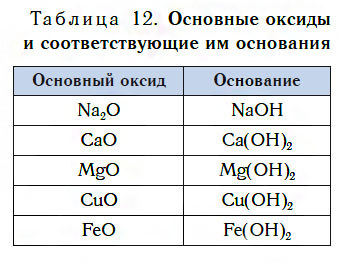
Подробнее с основаниями вы познакомитесь в следующем уроке. Оксиды металлов, которым соответствуют основания, называют основными оксидами.
Основные оксиды — это оксиды, которым соответствуют основания.
В таблице 12 приведены формулы некоторых основных оксидов и соответствующих им оснований. Заметьте, что, в отличие от кислотных оксидов, в состав основных оксидов входят атомы металлов. Большинство оксидов металлов — это основные оксиды.
Несмотря на то что каждому основному оксиду соответствует основание, не все основные оксиды взаимодействуют с водой, подобно CaO, образуя основания.
Взаимодействие с металлами
При обычных условиях активные металлы (K, Na, Ca, Ba и др.) бурно реагируют с водой:
В этих реакциях выделяется водород и образуются растворимые в воде основания.
Как химически активное вещество вода вступает в реакции со многими другими веществами, но об этом вы узнаете при дальнейшем изучении химии.
Краткие выводы урока:
- Вода — химически активное вещество. Она вступает в реакции с кислотными и основными оксидами, активными металлами.
- При взаимодействии воды с большинством кислотных оксидов образуются соответствующие кислоты.
- Некоторые основные оксиды при реакции с водой образуют растворимые основания.
- При обычных условиях вода реагирует с наиболее активными металлами. При этом образуются растворимые основания и водород.
Надеюсь урок 28 «Химические свойства воды» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Источник
Все химические реакции, которые необходимы для успешной сдачи ОГЭ
Правило 1.1. Взаимодействие простых веществ (металлов и неметаллов) с водой
1) Щелочные (Li-Fr) и щелочноземельные (Ca-Ra) металлы взаимодействуют с водой при комнатной температуре с образованием щелочи (растворимого основания) и выделением водорода. Например:
2) Магний также взаимодействует с водой, но при сильном нагревании и с образованием нерастворимого гидроксида:
3) Алюминий реагирует с водой, но только если убрать оксидную пленку:
4) Металлы, находящиеся в ряду активности от Zn (включительно) до Pb (включительно), взаимодействуют с парами воды (т.е. при температуре выше 100°С), при этом образуются оксиды соответствующих металлов и водород:
5) Металлы, стоящие в ряду активности правее водорода, с водой не взаимодействуют даже при нагревании.
Cu + H2O → реакция не идет.
6) Из неметаллов с водой реагируют галогены, C и Si при высоких температурах:
Правило 1.2. Взаимодействие оксидов с водой
1) Основные оксиды щелочных и щелочноземельных металлов реагируют с водой при комнатной температуре с образованием соответствующих щелочей:
2) Амфотерные оксиды не реагируют с водой и не растворяются в ней.
ZnO + H2O → реакция не идет.
3) Кислотные оксиды взаимодействуют с водой с образованием соответствующих кислот: P2O5 + 3H2O → 2H3PO4
Только в случае NO2 образуются две кислоты:
2NO2 + H2O → HNO2 + HNO3 и, как следствие, при взаимодействии с щелочами образуются две соли (нитраты и нитриты соответствующего металла):
SiO2 + H2O → реакция не идет.
Источник
С неметаллами могут образовать воду
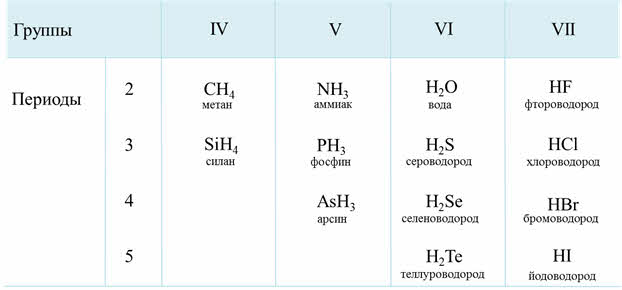
Водородные соединения неметаллов представляют собой газообразные соединения, кроме воды. Они летучие и легкоподвижные, быстроиспаряемые.
Электроотрицательность неметаллов больше электроотрицательности водорода, поэтому в водородных соединениях неметаллы проявляют минимальную отрицательную степень окисления: углерод — минус четыре, азот — минус три, фосфор — минус три и так далее.
Водородные соединения неметаллов проявляют основные, кислотные или амфотерные свойства. Водородные соединения неметаллов являются, как правило, сильными восстановителями.
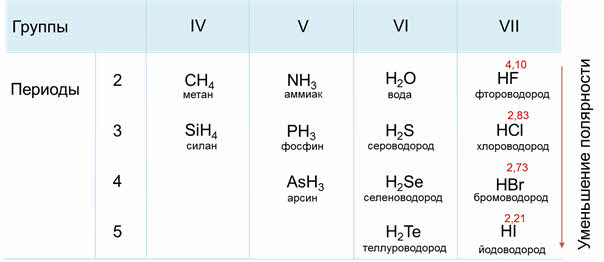
Так, углероду соответствует водородное соединение – метан, кремнию – силан, азоту – аммиак, фосфору – фосфин, мышьяку – арсин, кислороду – вода, сере – сероводород, селену – селеноводород, тэллуру – тэллуроводород, фтору – фтороводород, хлору – хлороводород, брому – бромоводород, йоду – йодоводород.
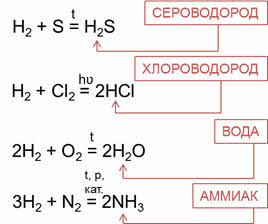
Водородные соединения неметаллов можно получить непосредственно взаимодействием неметалла с водородом. Сероводород можно получить реакцией водорода с серой, хлороводород – реакцией водорода с хлором, воду – реакцией водорода и кислорода, аммиак – реакцией водорода и азота.
В водородных соединениях присутствует ковалентная полярная связь, они имеют молекулярную кристаллическую решётку.
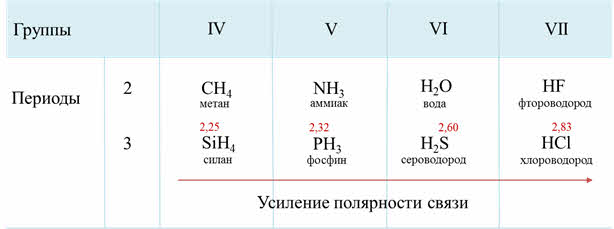
Как известно, электроотрицательность усиливается по периоду слева направо, поэтому полярность связи в водородных соединениях возрастает, а в группах сверху вниз электроотрицательность уменьшается, поэтому и полярность связи будет уменьшаться.
Если рассмотреть третий период, то от силена до хлороводорода будет наблюдаться усиление полярности связи из-за увеличения электроотрицательности неметаллов.
В седьмой A группе сверху вниз будет идти уменьшение полярности связи от фтороводорода к йодоводороду, потому что идёт уменьшение электрооотрицательности элемента-неметалла в водородном соединении.
Полярность связи влияет на растворимость водородного соединения в воде. Например, так как молекула воды сильно полярна, то возникает сильное межмолекулярное взаимодействие с образованием водородных связей.
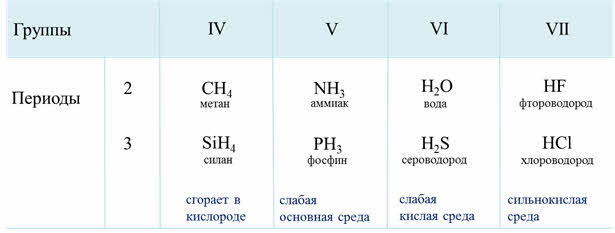
Если рассмотреть водородные соединения неметаллов третьего периода, то здесь можно проследить следующую закономерность: при растворении в воде силана не наблюдается проявление кислотно-основного характера соединения, он сразу сгорает в кислороде, фосфин в воде даёт слабую основную среду, сероводород – слабую кислую среду, а хлороводород – сильнокислую среду. Это объясняется тем, что от силана до хлороводорода радиус иона неметалла уменьшается, а заряд ядра увеличивается, полярность связи в молекулах возрастает, поэтому усиливаются кислотные свойства.
В группах сверху вниз кислотные свойства водородных соединений неметаллов усиливаются, так как прочность связи водород-элемент уменьшается, из-за увеличения длины связи.
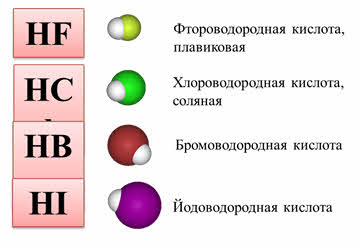
Например, водородные соединения седьмой A группы: хлороводород, бромоводород, йодоводород в воде – это сильные кислоты, которые полностью диссоциируют. Из этих кислот самой слабой является фтороводородная. Это объясняется тем, что у фтора самый маленький радиус, кроме этого, в этой молекуле присутствуют межмолекулярные водородные связи.
Таким образом, в периодах и группах главных подгруппах с увеличением заряда ядер элементов-неметаллов усиливаются кислотные свойства, а ослабевают основные свойства.
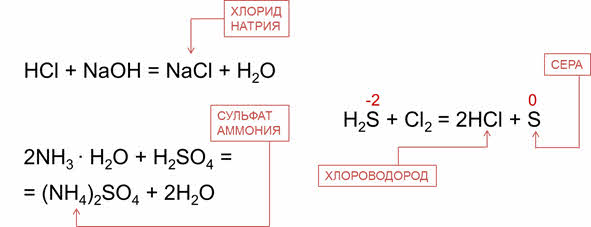
Например, водный раствор хлороводорода – проявляет кислотные свойства, поэтому реагирует со щелочами. Так, в реакции соляной кислоты с гидроксидом натрия образуется соль – хлорид натрия и вода. Водный раствор аммиака проявляет основные свойства, поэтому реагирует с кислотами. Так, в реакции аммиака с серной кислотой образуется сульфат аммония и вода.
Как было сказано, водородные соединения неметаллов проявляют восстановительные свойства, так как элемент-неметалл здесь в минимальной степени окисления. Например, в реакции сероводорода с хлором сероводород является восстановителем, потому что сера повышает свою степень окисления с минус двух до нуля.
Таким образом, все солеобразующие оксиды, образованные неметаллами, обладают кислотными свойствами, а сила кислотного оксида зависит от степени окисления неметалла и радиуса иона. В периодах слева направо кислотный характер гидроксидов, образованных оксидами неметаллов усиливается, а в группах сверху вниз кислотный характер гидроксидов ослабевает. В периодах слева направо кислотные свойства летучих водородных соединений элементов в водных растворах усиливаются. В группах сверху кислотные свойства водородных соединений увеличиваются. Водородные соединения неметаллов, обладающие в водных растворах кислотными свойствами, реагируют со щелочами. Водородные же соединения неметаллов, обладающие в водных растворах основными свойствами, реагируют с кислотами.
Домашнее задание: выполните в тетрадь один из предложенных вариантов.
Цель: Рассмотрите строение метана и силана, особенности их свойств.
1. Строение молекулы метана.
а) определите тип химической связи, изобразите механизм образования химической связи в молекуле метана;
б) составьте электронную и структурную формулы метана;
в) охарактеризуйте пространственное строение метана;
г) исчерпаны ли валентные возможности атома углерода в молекуле метана;
д) метан (н.у.) устойчив на воздухе, а силан воспламеняется. Почему?
2. Химические свойства метана.
а) отношение к воде;
б) взаимодействие с галогенами, азотной и серной кислотами. Составьте УХР этих взаимодействий.
в) отношение к нагреванию без доступа кислорода воздуха. Составьте УХР разложения метана.
г) взаимодействие СН4 и SiH4 с кислородом. Составьте УХР горения метана и силана. Чем отличаются реакции взаимодействия с кислородом метана и силена?
Аммиак и фосфин.
Цель: Изучить строение и свойства водородных соединений азота и фосфора.
1. Строение молекул аммиака и фосфина.
а) определите тип химической связи в молекулах NH3 и PH3. Какой тип кристаллической решетки имеют вещества?
б) опишите физические свойства этих соединений.
в) составьте электронную формулу аммиака, охарактеризуйте пространственное строение аммиака.
2. Химические свойства аммиака.
а) отношение аммиака к воде и кислотам. Составьте УХР этих взаимодействий.
б) окислительно – восстановительные свойства аммиака. Составьте УХР следующих взаимодействий:
— взаимодействие с кислородом при различных условиях;
— взаимодействие с оксидом меди ( II );
— хлор и бром энергично окисляют аммиак до азота.
Чем в этих ОВР выступает аммиак?
Демонстрация: Получение аммиака и растворение его в воде.
Цель: Изучить строение молекулы воды и ее свойства.
1. Строение воды
а) Составьте электронную и структурную формулы молекулы воды;
б) Каково пространственное строение молекулы воды?
в) Исчерпаны ли валентные возможности воды?
г) Физические свойства воды.
2. Химические свойства воды.
а) отношение воды к неорганическим веществам:
— кислотным и основным оксидам;
Составить возможные УХР.
б) отношение к органическим веществам:
— сложным эфирам (жирам);
Составьте возможные УХР.
в) окислительно-восстановительные свойства воды:
— взаимодействие воды с натрием, углем.
Цель: Изучить строение и свойства сероводорода.
1. Строение молекулы сероводорода:
а) Составьте электронную и структурную формулы молекулы H2S
б) Особенности пространственного строения молекулы сероводорода.
2. Физические и химические свойства сероводорода:
а) особенности физических свойств;
б) химические свойства:
— кислотно-основные (приведите примеры УХР, где сероводород проявляет кислотные свойства);
Составить УХР горения H 2 S в кислороде. Закончите УХР взаимодействия сероводорода с раствором перманганата калия в кислой среде (уравнять методом полуреакций).
Цель: Рассмотреть строение и свойства галогеноводородов.
1. На примере хлороводорода рассмотрите электронное строение молекулы. Изобразите электронную и структурную формулы молекулы хлороводорода.
2. Как изменяется сила кислот в ряду HF-HCl-HBr-HI? Почему?
3. Химические свойства галогеноводородов на примере HCl.
— Какими свойствами обладают водные растворы галогеноводородов? Приведите примеры кислотно-основных свойств . Составьте возможные УХР.
— охарактеризуйте отношение водородных соединений галогенов к органическим веществам:
Составьте возможные УХР взаимодействия HCl с органическими веществами.
Домашнюю работу высылать не нужно, просмотрю в школе
Источник