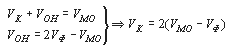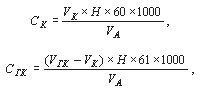Щелочная вода по фенолфталеину
Как отмечалось выше (в разделе «Щелочность и кислотность»), карбонаты и гидрокарбонаты представляют собой компоненты, определяющие природную щелочность воды. Их содержание в воде обусловлено процессами растворения атмосферной СО2, взаимодействия воды с находящимися в прилегающих грунтах известняками и, конечно, протекающими в воде жизненными процессами дыхания всех водных организмов.
Определение карбонат- и гидрокарбонат-анионов является титриметрическим и основано на их реакции с водородными ионами в присутствии фенолфталеина (при определении карбонат-анионов) или метилового оранжевого (при определении гидрокарбонат-анионов) в качестве индикаторов. Используя эти два индикатора, удается наблюдать две точки эквивалентности: в первой точке (рН 8,0–8,2) в присутствии фенолфталеина полностью завершается титрование карбонат-анионов, а во второй (рН 4,1–4,5) – гидрокарбонат-анионов. По результатам титрования можно определить концентрации в анализируемом растворе основных ионных форм, обуславливающих потребление кислоты (гидроксо-, карбонат- и гидрокарбонат-анионов), а также величины свободной и общей щелочности воды, т.к. они находятся в стехиометрической зависимости от содержания гидроксил-, карбонат- и гидрокарбонат-анионов. Для титрования обычно используют титрованные растворы соляной кислоты с точно известным значением концентрации – 0,05 моль/л либо 0,1 моль/л.
Определение карбонат-анионов основано на реакции:
Присутствие карбонат-аниона в концентрациях, определяемых аналитически, возможно лишь в водах, рН которых более 8,0–8,2. В случае присутствия в анализируемой воде гидроксо-анионов при определении карбонатов протекает также реакция нейтрализации:
Определение гидрокарбонат-анионов основано на реакции:
Таким образом, при титровании по фенолфталеину в реакции с кислотой участвуют анионы ОН– и СО32–, а при титровании по метиловому оранжевому – ОН – , СО3 2– и НСО3 – .
Величина карбонатной жесткости рассчитывается с учетом эквивалентных масс участвующих в реакциях карбонат- и гидрокарбонат-анионов.
При анализе карбонатных природных вод правильность получаемых результатов зависит от величины потребления кислоты на титрование по фенолфталеину и метилоранжу. Если титрование в присутствии фенолфталеина обычно не вызывает трудностей, т.к. происходит изменение окраски от розовой до бесцветной, то в присутствии метилового оранжевого, при изменении окраски от желтой до оранжевой, определить момент окончания титрования иногда довольно сложно. Это может привести к значительной ошибке при определении объема кислоты, израсходованной на титрование. В этих случаях, для более четкого выявления момента окончания титрования, определение полезно проводить в присутствии контрольной пробы, для чего рядом с титруемой пробой помещают такую же порцию анализируемой воды (во второй склянке), добавляя такое же количество индикатора.
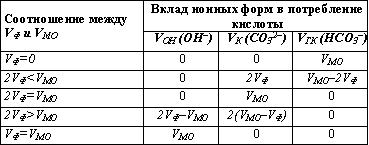
В результате титрования карбоната и гидрокарбоната, которое может выполняться как параллельно в разных пробах, так и последовательно в одной и той же пробе, для расчета значений концентраций необходимо определить общее количество кислоты в миллилитрах, израсходованной на титрование карбоната (VK) и гидрокарбоната (VГК). Следует иметь в виду, что при определении потребления кислоты на титрование по метилоранжу (VМО) происходит последовательное титрование и карбонатов, и гидрокарбонатов. По этой причине получаемый объем кислоты VМО содержит соответствующую долю, обусловленную присутствием в исходной пробе карбонатов, перешедших после реакции с катионом водорода в гидрокарбонаты, и не характеризует полностью концентрацию гидрокарбонатов в исходной пробе. Следовательно, при расчете концентраций основных ионных форм, обуславливающих потребление кислоты, необходимо учесть относительное потребление кислоты при титровании по фенолфталеину (VФ) и метилоранжу (VМО). Рассмотрим несколько возможных вариантов, сопоставляя величины VФ и VМО.
VФ = 0. Карбонаты, а также гидроксо-анионы в пробе отсутствуют, и потребление кислоты при титровании по метилоранжу может быть обусловлено только присутствием гидрокарбонатов.
VФ
VФ = VМО. В исходной пробе отсутствуют и карбонаты, и гидрокарбонаты, и потребление кислоты обусловлено присутствием сильных щелочей, содержащих гидроксо-анионы.
Присутствие свободных гидроксо-анионов в заметных количествах (случаи 4 и 5) возможно только в сточных или загрязненных водах.
Массовые концентрации анионов (не солей!) рассчитываются на основании уравнений реакций потребления кислоты карбонатами (СК) и гидрокарбонатами (СГК) в мг/л по формулам:
где:
VК и VГК – объем раствора соляной кислоты, израсходованный на титрование карбоната и гидрокарбоната соответственно, мл;
Н – точная концентрация титрованного раствора соляной кислоты (нормальность), моль/л экв.;
VА – объем пробы воды, взятой для анализа, мл;
60 и 61 – эквивалентная масса карбонат- и гидрокарбонат-аниона соответственно, в соответствующих реакциях;
1000 – коэффициент пересчета единиц измерений.
Результаты титрования по фенолфталеину и метилоранжу позволяют рассчитать показатель щелочности воды, который численно равен количеству эквивалентов кислоты, израсходованной на титрование пробы объемом 1 л. При этом потребление кислоты при титровании по фенолфталеину характеризует свободную щелочность, а по метилоранжу – общую щелочность, которая измеряется в ммоль/л. Показатель щелочности используется в России, как правило, при исследовании сточных вод. В некоторых других странах (США, Канаде, Швеции и др.) щелочность определяется при оценке качества природных вод и выражается массовой концентрацией в эквиваленте СаСО3.
Следует иметь в виду, что, при анализе сточных и загрязненных природных вод, получаемые результаты не всегда корректно отражают величины свободной и общей щелочности, т.к. в воде, кроме карбонатов и гидрокарбонатов, могут присутствовать соединения некоторых других групп (см. «Щелочность и кислотность»).
Оборудование и реактивы
Пипетка на 2 мл или на 5 мл, мерный шприц с наконечником и соединительной трубкой; пипетка-капельница; склянка с меткой «10 мл».
Раствор индикатора метилового оранжевого (0,1%) водный; раствор индикатора фенолфталеина; раствор соляной кислоты титрованный (0,05 моль/л).
Приготовление растворов см. приложение 3.
Выполнение анализа
А. Титрование карбонат-аниона
 | ||||||||||||||||||||
 | ||||||||||||||||||||
 |
 | |||||||||||||||||
 | |||||||||||||||||
 |
| Таблица 1 Интерпретация показателей щелочности для воды* | ||||||||||||
| ||||||||||||
| Таблица 2 Ряд электродных потенциалов металлов и сплавов в текущей аэрированной морской воде при температуре от 4 до 27 °С | |
|
Электрохимическая коррозия, или коррозия между разными металлами. Другим фактором, ускоряющим процесс коррозии, является разность потенциалов между разными металлами, соединенными вместе и погруженными в электролит. На интенсивность коррозии, происходящей на стыке разнородных металлов, оказывают влияние следующие факторы:
— Положение в ряду электродных потенциалов относительно положения стандартного электрода. Чем больше разность этих положений, тем больше сила реакции. Ряд электродных потенциалов для металлов, погруженных в текущую аэрированную морскую воду, показан в табл. 2.
— Соотношение площадей областей анода и катода. Величина тока и, следовательно, общие потери металла определяются разностью потенциалов и сопротивлением цепей, поэтому меньшая область анода корродирует быстрее, т. к. она пронизывается в большей степени, чем большая область.
— Поляризация областей катода или анода. Поляризация может уменьшить разность потенциалов и таким образом уменьшить скорость коррозии анода.
— Содержание минералов в воде. При увеличении содержания минералов повышается электропроводимость, в результате чего увеличивается интенсивность электрохимической коррозии.
Напряжение. Напряжения в металлических конструкциях редко оказывают заметное влияние на сопротивляемость металлов и сплавов равномерной коррозии. Напряжения в металлах и сплавах могут вызвать коррозийное растрескивание, если металл поместить в характерную корродирующую среду. Такое растрескивание может иметь катастрофические последствия для возможности дальнейшего использования изделия из металла.
Почти все металлы и сплавы демонстрируют восприимчивость к коррозийному растрескиванию, вызванному напряжением по крайней мере в одной агрессивной среде. В качестве типичных примеров можно указать сталь в горячих щелочных растворах, латунь с высоким содержанием цинка в аммиаке, нержавеющую сталь в горячих хлоридах. Производители металлов обладают информацией о специальных материалах и их сопротивляемости к коррозийному растрескиванию.
Температура. Согласно результатам исследований скорости химической реакции интенсивность коррозии удваивается при повышении температуры на каждые 10 К. Однако такие показатели не обязательно соблюдаются для реакций коррозии вне лабораторных условиях. Для конкретных систем трудно предсказать влияние температуры без знания конкретных характеристик рассматриваемого металла и условий среды.
Повышение температуры может увеличить интенсивность коррозии, но только в незначительной степени. При повышении температуры растворимость кислорода падает, и в открытых системах растворимость может упасть до нуля при кипении воды. При температуре, превышающей определенный критический предел, интенсивность коррозии может снижаться из-за снижения растворимости кислорода. Однако в закрытых системах, в которых кислород не может улетучиваться, интенсивность коррозии с увеличением температуры может продолжать расти.
Для таких сплавов, для которых сохранение защитной оксидной пленки зависит от содержания кислорода в окружающей среде, например, для нержавеющей стали, уменьшение содержания кислорода из-за увеличения температуры может ускорить интенсивность коррозии с ростом температуры.
Температура может оказывать влияние на потенциал коррозии благодаря тому, что растворенная в окружающей среде соль осаждается на поверхность металла в виде защитного осадочного слоя. Примером этому может служить осадок карбоната кальция в жесткой воде. Температура может также влиять на природу продукта коррозии, который в определенном температурном диапазоне может быть относительно стабильным и нести защитные функции, а при других температурах может быть нестабильным и не может служить защитой. Примером этому является цинк в дистиллированной воде: продукт коррозии в диапазоне температур от 60 до 80 °С не является защитным, но становится в определенной степени защитным при других значениях температуры.
Давление. В условиях, при которых растворенные газы, например кислород и углекислый газ, влияют на интенсивность коррозии, давление в системе может увеличить растворимость этих газов и, таким образом, увеличить коррозию. И наоборот, вакуум в системе снижает растворимость газов, снижая тем самым коррозию. В нагреваемых системах давление может вызвать повышение температуры. Контролировать коррозию в системе, только регулируя давление, трудно и неудобно с практической точки зрения.
Скорость потока. Влияние скорости потока воды на интенсивность коррозии в системах зависит от нескольких факторов, включая следующие: количество кислорода в воде; тип металла (наиболее восприимчивыми являются железо и сталь); расход воды.
В металлических системах, в которых продукты коррозии сдерживают коррозию, действуя в качестве физического барьера, поток, протекающий с большой скоростью, может уничтожить такой защитный барьер и повысить потенциал коррозии. Турбулентная среда может вызвать неравномерное разъедание как от эрозии, так и от коррозии. Такая коррозия называется эрозионной. Обычно она возникает в трубах с острыми изгибами, в которых наблюдается высокая скорость потока. Медь и мягкие металлы наиболее восприимчивы к такого сорта разъеданию.
Литература
2003 ASHRAE Handbook – HVAC Applications. SI Edition. Ch. 48. Atlanta, 2003.
Источник