Сера хорошо смачивается водой
В периодической системе химических элементов сера занимает место в главной подгруппе VI группы. Внешний электронный слой её атома содержит 6 электронов, т.е. близок к завершению. Отсюда следует ожидать, что сера должна быть ярко выраженным неметаллом.
Атомный вес – 32
Заряд ядра – 16
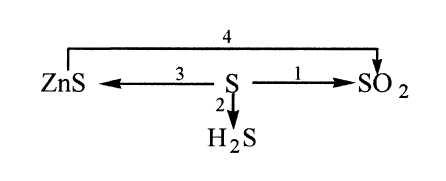
Формула оксида серы – SO2
Уравнение реакции серы с водородом – H2 + S = H2S
Физические свойства серы
В природе свободная сера встречается в виде прозрачных кристаллов золотисто–желтого цвета. В виде порошка она продается в аптеках и магазинах химических товаров.
Сера – твердое вещество желтого цвета. Она легко измельчается в порошок (в продаже такой порошок называется молотой серой). Свободная сера проявляет все признаки неметалла. Кристаллическая решетка серы молекулярная и слагается из восьмизвенных кольцеобразных молекул S8. Поэтому сера легкоплавка: она плавится при температуре, лишь немного превышающей точку кипения воды. При дальнейшем нагревании сера загустевает, превращаясь в другую аллотропную модификацию, называемую пластической серой.
Пластическая сера состоит из цепочкообразных молекул очень большой длины, беспорядочно перепутанных. Поэтому по свойствам она похожа на резину: при растяжении сильно растягивается, а при отпускании сокращается. Растягивание происходит за счет распрямления ее нитевидных молекул в направлении растягивающей силы, а сокращение – за счет обратного скручивания их, подобно спутанным в клубок пружинкам при растягивании и отпускании клубка.
При сильном нагревании сера переходит в пар бурого цвета.
Сера нерастворима в воде и даже не смачивается ею. Если бросить в воду щепотку молотой серы, частички серы не потонут, а останутся плавать на поверхности, образуя на ней желтую пленку. Такое всплывание мелких частиц вещества, не смачивающегося водой, называется флотацией (тот же корень имеет слово «флот»).
Подобно свободной сере, не смачиваются водой многие природные соединения серы с металлами. Примеси же, образующие в таких рудах «пустую породу», смачиваются водой. Поэтому флотация широко применяется в металлургии как метод обогащения руд, т. е. отделения нужного минерала от пустой породы.
Химические свойства серы
Поскольку сера – неметалл, изучим сначала реакции ее с металлами. Нам уже известно, что смесь порошков серы и железа после нагревания в одном месте сама собой раскаляется вследствие происходящей экзотермической реакции, и получается сернистое железо:
Fe + S = FeS
Смесь порошков серы и алюминия или цинка при поджигании реагирует мгновенно с ослепительной вспышкой. Образуются в виде белых порошков сернистый алюминий или сернистый цинк:
Zn + S = ZnS
При этом часть продукта реакции в виде мельчайших частичек выбрасывается в воздух, образуя белое облачко.
Пучок из медных проволок сгорает в парах серы, образуя черную сернистую медь:
2Cu + S = Cu2S
С некоторыми металлами сера взаимодействует даже при обычной температуре. Так, при растирании в ступке жидкой ртути с порошком серы получается сернистая ртуть:
Hg + S = HgS
Соединения серы с металлами называются сернистыми металлами или сульфидами.
Сера взаимодействует также с водородом. При пропускании водорода в пробирку с кипящей жидкой серой у отверстия газоотводной трубки ощущается запах тухлых яиц. Это запах газообразного соединения серы с водородом – сероводорода. Уравнение реакции:
Сера, как и кислород, в соединениях с водородом и металлами отрицательно двухвалентна. Поэтому по составу сероводород сходен с водой, а сульфиды – с окислами металлов:
H2 + S 2-
Na2 + S 2-
Zn2 + S 2-
H2 + O 2-
Na2 + O 2-
Zn2 + O 2-
Перейдем теперь к рассмотрению реакции соединения серы с кислородом. Сера находится втой же главной подгруппе VI группы, что и кислород. Известно, что в главных подгруппах неметаллические свойства химических элементов с возрастанием порядкового номера ослабляются. Следовательно, по отношению к кислороду сера выступает как электроположительный элемент, т.е. электроны должны смещаться от атомов серы к атомам кислорода. Ее связи с кислородом полярны, сера проявляет в них положительную, а кислород – отрицательную валентность. В образовании этих связей могут принимать участие 4 из 6 валентных электронов атома серы или все 6. В первом случае образуется окисел SO2 – двуокись серы, во втором – SO3 – трехокись серы.
Сера легко соединяется с кислородом, сгорая на воздухе голубым, а в кислороде ярко–синим пламенем. При этом возникает характерный резкий запах сернистого газа:
Как и все бесцветные газы, сернистый газ невидим. Но при сгорании серы он всегда получается слегка мутным от присутствия Й нем мельчайших частичек трехокиси серы, в которую превращается небольшая часть сгорающей серы.
Разрешено частичное копирование статей с обязательной ссылкой на источник
Источник
Сера хорошо смачивается водой
Сера, её физические и химические свойства. Биологическое значение серы, её применение (демеркуризация).
 |  |
FeS 2 – пирит, серный колчедан, кошачье золото
H 2 S – сероводород (в минеральных источниках и природном газе)
MgSO 4 * 7H 2 O – горькая соль (английская)
Na 2 SO 4 * 10 H 2 O – глауберова соль (мирабилит)
Твердое кристаллическое вещество желтого цвета, нерастворима в воде, водой не смачивается (плавает на поверхности), t °кип = 445°С.
Одно из особенных физических свойств серы — флотация , способность мелкого порошка серы всплывать, тогда, как ее крупные кристаллы тонут в воде. Дело в том, что сера не смачивается водой, и ее частички держатся на поверхности воды за счет прилипших к ним мелких пузырьков воздуха. Это свойство используют при отделении самородной серы от примесей. Руду размалывают, заливают водой, а снизу продувают воздухом, сера всплывает, а примеси остаются на дне.
Для серы характерны несколько аллотропных модификаций , но наиболее известные видоизменения: ромбическая (кристаллическая) , моноклинная (игольчатая) и пластическая .
Ромбическая ( a — сера) — S 8
t °пл. = 113° C ; ρ = 2,07 г/см 3 . Наиболее устойчивая модификация.
Моноклинная ( b — сера) — S 8
темно-желтые иглы, t °пл. = 119° C ; ρ = 1,96 г/см3. Устойчивая при температуре более 96°С; при обычных условиях превращается в ромбическую.
коричневая резиноподобная (аморфная) масса. Неустойчива, при затвердевании превращается в ромбическую.


Размещение электронов по уровням и подуровням
1 s 2 2s 2 2 p 6 3 s 2 3 p 4
Размещение электронов по
орбиталям (последний слой)
В основном состоянии
Первое возбуждённое состояние
Второе возбуждённое состояние
1. Промышленный метод — выплавление из руды с помощью водяного пара.
2. Неполное окисление сероводорода (при недостатке кислорода).
Сера — окислитель S 0 + 2ē → S -2
Сера — восстановитель: S — 4ē → S +4 ;
1. Взаимодействие серы со всеми щелочными и щелочноземельными металлами, медью, ртутью, серебром без нагревания:
Ртуть обладает высокой летучестью. Её пары ядовиты. Эта реакция лежит в основе удаления и обезвреживания ртути, например из разбитого медицинского термометра. Места, из которых нельзя извлечь капельки ртути, засыпают порошком серы. Сера и ртуть вступают в реакцию при соприкосновении. В результате образуется химически инертное и безвредное вещество.
Этот процесс называется демеркуризацией
2. Взаимодействие серы c остальными металлами (кроме Au , Pt ) при повышенной t ° :
3. Взаимодействие серы с некоторыми неметаллами с образованием бинарных соединений:
1. Взаимодействие серы c кислородом:
2 S + 3 O 2 t ° ; pt → 2 S +6 O 3
2. Взаимодействие серы c галогенами (кроме йода):
**Взаимодействие серы с кислотами — окислителями:
4. 3 S 0 + 6 KOH → K 2 S +4 O 3 + 2 K 2 S -2 + 3 H 2 O
Вулканизация каучука, получение эбонита, производство спичек, пороха, в борьбе с вредителями сельского хозяйства, для медицинских целей (серные мази для лечения кожных заболеваний), для получения серной кислоты и т.д.
Домашнее задание параграф 21; упражнения 1, 3, 4 стр. 99-100.
Закончите уравнения реакций, р асставьте коэффициенты методом электронного баланса, укажите окислитель, восстановитель.
- Содержание серы в организме человека массой 70 кг — 140 г.
- В сутки человеку необходимо 1 г серы.
- Серой богаты горох, фасоль, овсяные хлопья, пшеница, мясо, рыба, плоды и сок манго.
- Сера входит в состав гормонов, витаминов, белков, она есть в хрящевой ткани, в волосах, ногтях. При недостатке серы в организме наблюдается хрупкость ногтей и костей, выпадение волос.
- Соединения серы могут служить лекарственными препаратами;
- Сера – основа мази для лечения грибковых заболеваний кожи, для борьбы с чесоткой. Тиосульфат натрия Na 2 S 2 O 3 используется для борьбы с нею.
- Многие соли серной кислоты содержат кристаллизационную воду: ZnSO 4 ×7H 2 O и CuSO 4 ×5H 2 O. Их применяют как антисептические средства для опрыскивания растений и протравливания зерна в борьбе с вредителями сельского хозяйства.
- Железный купорос FeSO 4 ×7H 2 O используют при анемии.
- BaSO 4 применяют при рентгенографическом исследовании желудка и кишечника.
- Алюмокалиевые квасцы KAI(SO 4 ) 2 ×12H 2 O — кровоостанавливающее средство при порезах.
- Минерал Na 2 SO 4 ×10H 2 O носит название «глауберова соль» в честь открывшего его в VIII веке немецкого химика Глаубера И.Р.Глаубер во время своего путешествия внезапно заболел. Он ничего не мог есть, желудок отказывался принимать пищу. Один из местных жителей направил его к источнику. Как только он выпил горькую соленую воду, сразу стал есть. Глаубер исследовал эту воду, из нее выкристаллизовалась соль Na 2 SO 4 ×10H 2 O. Сейчас ее применяют как слабительное в медицине, при окраске хлопчато- бумажных тканей. Соль также находит применение в производстве стекла.
- Тысячелистник обладает повышенной способностью извлекать из почвы серу и стимулировать поглощение этого элемента с соседними растениями.
- Чеснок выделяет вещество – альбуцид, едкое соединение серы. Это вещество предотвращает раковые заболевания, замедляет старение, предупреждает сердечные заболевания.
Источник
Сера хорошо смачивается водой
В периодической системе химических элементов сера занимает место в главной подгруппе VI группы. Внешний электронный слой её атома содержит 6 электронов, т.е. близок к завершению. Отсюда следует ожидать, что сера должна быть ярко выраженным неметаллом.
Атомный вес – 32
Заряд ядра – 16
Формула оксида серы – SO2
Уравнение реакции серы с водородом – H2 + S = H2S
Физические свойства серы
В природе свободная сера встречается в виде прозрачных кристаллов золотисто–желтого цвета. В виде порошка она продается в аптеках и магазинах химических товаров.
Сера – твердое вещество желтого цвета. Она легко измельчается в порошок (в продаже такой порошок называется молотой серой). Свободная сера проявляет все признаки неметалла. Кристаллическая решетка серы молекулярная и слагается из восьмизвенных кольцеобразных молекул S8. Поэтому сера легкоплавка: она плавится при температуре, лишь немного превышающей точку кипения воды. При дальнейшем нагревании сера загустевает, превращаясь в другую аллотропную модификацию, называемую пластической серой.
Пластическая сера состоит из цепочкообразных молекул очень большой длины, беспорядочно перепутанных. Поэтому по свойствам она похожа на резину: при растяжении сильно растягивается, а при отпускании сокращается. Растягивание происходит за счет распрямления ее нитевидных молекул в направлении растягивающей силы, а сокращение – за счет обратного скручивания их, подобно спутанным в клубок пружинкам при растягивании и отпускании клубка.
При сильном нагревании сера переходит в пар бурого цвета.
Сера нерастворима в воде и даже не смачивается ею. Если бросить в воду щепотку молотой серы, частички серы не потонут, а останутся плавать на поверхности, образуя на ней желтую пленку. Такое всплывание мелких частиц вещества, не смачивающегося водой, называется флотацией (тот же корень имеет слово «флот»).
Подобно свободной сере, не смачиваются водой многие природные соединения серы с металлами. Примеси же, образующие в таких рудах «пустую породу», смачиваются водой. Поэтому флотация широко применяется в металлургии как метод обогащения руд, т. е. отделения нужного минерала от пустой породы.
Химические свойства серы
Поскольку сера – неметалл, изучим сначала реакции ее с металлами. Нам уже известно, что смесь порошков серы и железа после нагревания в одном месте сама собой раскаляется вследствие происходящей экзотермической реакции, и получается сернистое железо:
Fe + S = FeS
Смесь порошков серы и алюминия или цинка при поджигании реагирует мгновенно с ослепительной вспышкой. Образуются в виде белых порошков сернистый алюминий или сернистый цинк:
Zn + S = ZnS
При этом часть продукта реакции в виде мельчайших частичек выбрасывается в воздух, образуя белое облачко.
Пучок из медных проволок сгорает в парах серы, образуя черную сернистую медь:
2Cu + S = Cu2S
С некоторыми металлами сера взаимодействует даже при обычной температуре. Так, при растирании в ступке жидкой ртути с порошком серы получается сернистая ртуть:
Hg + S = HgS
Соединения серы с металлами называются сернистыми металлами или сульфидами.
Сера взаимодействует также с водородом. При пропускании водорода в пробирку с кипящей жидкой серой у отверстия газоотводной трубки ощущается запах тухлых яиц. Это запах газообразного соединения серы с водородом – сероводорода. Уравнение реакции:
Сера, как и кислород, в соединениях с водородом и металлами отрицательно двухвалентна. Поэтому по составу сероводород сходен с водой, а сульфиды – с окислами металлов:
H2 + S 2-
Na2 + S 2-
Zn2 + S 2-
H2 + O 2-
Na2 + O 2-
Zn2 + O 2-
Перейдем теперь к рассмотрению реакции соединения серы с кислородом. Сера находится втой же главной подгруппе VI группы, что и кислород. Известно, что в главных подгруппах неметаллические свойства химических элементов с возрастанием порядкового номера ослабляются. Следовательно, по отношению к кислороду сера выступает как электроположительный элемент, т.е. электроны должны смещаться от атомов серы к атомам кислорода. Ее связи с кислородом полярны, сера проявляет в них положительную, а кислород – отрицательную валентность. В образовании этих связей могут принимать участие 4 из 6 валентных электронов атома серы или все 6. В первом случае образуется окисел SO2 – двуокись серы, во втором – SO3 – трехокись серы.
Сера легко соединяется с кислородом, сгорая на воздухе голубым, а в кислороде ярко–синим пламенем. При этом возникает характерный резкий запах сернистого газа:
Как и все бесцветные газы, сернистый газ невидим. Но при сгорании серы он всегда получается слегка мутным от присутствия Й нем мельчайших частичек трехокиси серы, в которую превращается небольшая часть сгорающей серы.
Разрешено частичное копирование статей с обязательной ссылкой на источник
Источник