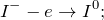Йодид калия: способы получения и химические свойства
Йодид калия KI — соль щелочного металла калия и йодоводородной кислоты. Белый, при хранении на свету желтеет из-за окисления. Хорошо растворяется в воде (гидролиза нет).
Относительная молекулярная масса Mr = 166; относительная плотность для тв. и ж. состояния d = 3,115; tпл = 681º C
Способ получения
1. При температуре 150–200º C, в результате взаимодействия калия и йода , образуется йодид калия:
2K + I2 = 2KI
2. Разбавленный раствор гидроксида калия реагирует с йодидом железа в атмосфере азота . При этом образуются йодид калия и осадок гидроксид железа:
2KOH + FeI2 = 2KI + Fe(OH)2↓
Качественная реакция
Качественная реакция на йодид калия — взаимодействие его с нитратом серебра, в результате реакции происходит образование осадка желтого цвета:
При взаимодействии с нитратом серебра , йодид калия образует нитрат калия и осадок йодид серебра:
KI + AgNO3 = KNO3 + AgI↓
Химические свойства
1. Йодид калия вступает в реакцию с простыми веществами :
1.1. Холодный йодид калия взаимодействует с хлором. В результате реакции происходит образование хлорида калия и осадка йода:
2KI + Cl2 = 2KCl + I2↓
1.2. Холодный йодид калия взаимодействует с бромом. В результате реакции происходит образование бромида калия и осадка йода:
2KI + Br2 = 2KBr + I2↓
2. Йодид калия способен вступать в реакцию со сложными веществами :
2.1. Йодид калия реагирует с кислотами:
2.1.1. Твердый йодид калия реагирует с концентрированной серной кислотой при 30 — 50º С. Взаимодействие данных веществ приводит к образованию осадка йода, газа сероводорода, воды и гидросульфата калия:
2.2. Йодид калия вступает в реакцию с солями :
2.2.1. Йодид калия реагирует с разбавленной серной кислотой и перманганатом калия. В результате данной реакции образуется осадок йод, сульфат марганца, вода и сульфат калия:
3.2.2. В результате взаимодействия йодида калия с разбавленной серной кислотой и дихроматом калия происходит образование сульфата хрома, осадка йода, воды и сульфата калия:
2.2.3. Йодид калия в разбавленной серной кислоте взаимодействует с сульфатом железа (III), образуя осадок йод, сульфат железа (II) и сульфат калия:
Источник
KI + H2SO4 (конц) = ? уравнение реакции
Составьте химическое уравнение по схеме KI + H2SO4 (конц) = ? Расставьте стехиометрические коэффициенты. Укажите тип взаимодействия. Укажите основные физические и химические свойства твердого продукта реакции, а также способы его получения. Заранее, большое спасибо!
В результате действия концентрированного раствора серной кислоты на твердый иодид калия (KI + H2SO4 (конц) = ?) происходит образование средней соли – сульфата калия, воды, а также выделение свободного йода и газообразного сероводорода. Реакцию проводят в кипящем растворе. Молекулярное уравнение реакции имеет вид:
Запишем ионные уравнения, учитывая, что простые вещества, газы и вода на ионы не распадаются, т.е. не диссоциируют.
Первое уравнение называют полным ионным, а второе – сокращенным ионным.
Йод представляет собой летучие кристаллы фиолетово-черного цвета с металлическим блеском. Он плохо растворяется в воде, в ничтожно малой степени (по сравнению с хлором и бромом), подвергается дисмутации. Хорошо растворяется в органических растворителях (с фиолетовым или коричневым окрашиванием), в водных растворах иодидов металлов, жидком диоксиде серы. Слабый восстановитель и окислитель; реагирует с концентрированными серной и азотной кислотами, «царской водкой», металлами, неметаллами, щелочами, сероводородной водой. Образует соединения с другими галогенами.
Источник
KI + KIO3 + H2SO4 = ? уравнение реакции
Срочно нужна помощь! Какие продукты образуются в результате взаимодействия иодида и иодата калия в кислой среде, создаваемой серной кислотой (KI + KIO3 + H2SO4 = ?)? Запишите молекулярное уравнение реакции. Укажите окислитель и восстановитель. Дайте определение окислительно-восстановительным реакциям. Заранее, большое спасибо!
В результате взаимодействия йодида и иодата калия в кислой среде, создаваемой серной кислотой (KI + KIO3 + H2SO4 = ?) происходит образование средней соли- сульфата калия, воды и выделение йода. Молекулярное уравнение реакции имеет вид:
Запишем ионные уравнения, учитывая, что простые вещества и вода на ионы не распадаются, т.е. не диссоциируют.
Первое уравнение называют полным ионным, а второе – сокращенным ионным.
Данная реакция относится к окислительно-восстановительным, поскольку химический элемент йод изменяет свою степень окисления – одновременно и повышает и понижает её (диспропорционирование). Схемы электронного баланса выглядят следующим образом:
Окисление – это отдача электронов веществом, т.е. повышение степени окисление элемента. Вещества, отдающие свои электроны в процессе реакции, называются восстановителями (в данном случае это йодид калия).
Восстановление – это смещение электронов к веществу или понижение степени окисления элемента. Вещества, принимающее электроны, называется окислителем (в данном случае это йодат калия).
Источник
KI + H2SO4 = ? уравнение реакции
Срочно нужна помощь! Какие продукты образуются в результате взаимодействия иодида калия с серной кислотой (KI + H2SO4 = ?)? Запишите молекулярное уравнение реакции. Охарактеризуйте полученное простое соединение: приведите основные физические и химические свойства. Заранее, большое спасибо!
В результате растворения навески иодида калия в растворе концентрированной серной кислоты при нагревании (KI + H2SO4 = ?) происходит образование средней соли – сульфата калия и воды, а также выделение свободного йода и газообразного сероводорода. Молекулярное уравнение реакции имеет вид:
Запишем ионные уравнения, учитывая, что йод, сероводород и вода на ионы не распадаются, т.е. не диссоциируют.
Первое уравнение называют полным ионным, а второе – сокращенным ионным.
Йод представляет собой летучие кристаллы фиолетово-черного цвета с металлическим блеском. Он плохо растворяется в воде, в ничтожно малой степени (по сравнению с хлором и бромом), подвергается дисмутации. Хорошо растворяется в органических растворителях (с фиолетовым или коричневым окрашиванием), в водных растворах иодидов металлов, жидком диоксиде серы. Слабый восстановитель и окислитель; реагирует с концентрированными серной и азотной кислотами, «царской водкой», металлами, неметаллами, щелочами, сероводородной водой. Образует соединения с другими галогенами.
Источник
KI + KIO3 + H2SO4 = ? уравнение реакции
Срочно нужна помощь! Какие продукты образуются в результате взаимодействия иодида и иодата калия в кислой среде, создаваемой серной кислотой (KI + KIO3 + H2SO4 = ?)? Запишите молекулярное уравнение реакции. Укажите окислитель и восстановитель. Дайте определение окислительно-восстановительным реакциям. Заранее, большое спасибо!
В результате взаимодействия йодида и иодата калия в кислой среде, создаваемой серной кислотой (KI + KIO3 + H2SO4 = ?) происходит образование средней соли- сульфата калия, воды и выделение йода. Молекулярное уравнение реакции имеет вид:
Запишем ионные уравнения, учитывая, что простые вещества и вода на ионы не распадаются, т.е. не диссоциируют.
Первое уравнение называют полным ионным, а второе – сокращенным ионным.
Данная реакция относится к окислительно-восстановительным, поскольку химический элемент йод изменяет свою степень окисления – одновременно и повышает и понижает её (диспропорционирование). Схемы электронного баланса выглядят следующим образом:
Окисление – это отдача электронов веществом, т.е. повышение степени окисление элемента. Вещества, отдающие свои электроны в процессе реакции, называются восстановителями (в данном случае это йодид калия).
Восстановление – это смещение электронов к веществу или понижение степени окисления элемента. Вещества, принимающее электроны, называется окислителем (в данном случае это йодат калия).
Источник