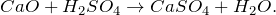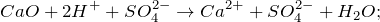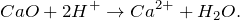CaO + H2SO4 = ? уравнение реакции
Здесь есть кто-нибудь, кто хорошо разбирается в химии? Мне нужна помощь: взаимодействует ли оксид кальция с серной кислотой (CaO + H2SO4 = ?) и, если да, то, что при этом получается. Укажите основные физические и химические свойства серной кислоты, а также способы её получения. Заранее, благодарю!
В результате взаимодействия оксида калия с серной кислотой (CaO + H2SO4 = ?) происходит образование средней соли сульфата кальция и воды (обмен). Молекулярное уравнение реакции имеет вид:
Запишем ионные уравнения, учитывая, что оксиды и вода на ионы не распадаются, т.е. не диссоциируют.
Первое уравнение называют полным ионным, а второе – сокращенным ионным.
Безводная серная кислота представляет собой тяжелую, вязкую жидкость, которая легко смешивается с водой в любой пропорции взаимодействие характеризуется исключительно большим экзотермическим эффектом (
880 кДж/моль при бесконечном разбавлении) и может привести к взрывному вскипанию и разбрызгиванию смеси, если воду добавлять к кислоте; поэтому так важно всегда использовать обратный порядок в приготовлении растворов и добавлять кислоту в воду, медленно и при перемешивании.
Серная кислота – сильная двухосновная кислота. Она образует два ряда солей: средние – сульфаты и кислые — гидросульфаты.
Концентрированная серная кислота, особенно горячая, — энергичный окислитель. Она окисляет HI и HBr (но не HCl) до свободных галогенов, уголь – до 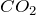
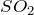
Источник
Сульфат кальция: способы получения и химические свойства
Сульфат кальция CaSO4 — соль металла кальция и серной кислоты. Белый. Весьма гигроскопичный. При плавлении разлагается. Мало растворяется в воде.
Относительная молекулярная масса Mr = 136,14; относительная плотность для тв. и ж. состояния d = 2,96; tпл = 1450º C (разлагается).
Способ получения
1. В результате взаимодействия хлорида кальция и сульфата калия при 800º С образуется сульфат кальция и хлорид калия:
2. Сульфат магния взаимодействует с перхлоратом кальция с образованием сульфата кальция и перхлората магния:
3. Гидроксид кальция вступает в реакцию с серной кислотой и образует сульфат кальция и воду:
Качественная реакция
Качественная реакция на сульфат кальция — взаимодействие его с хлоридом бария, в результате реакции происходит образование белого осадка , который не растворим в азотной кислоте:
1. При взаимодействии с хлоридом бария , сульфат кальция образует сульфат бария и хлорид кальция:
Химические свойства
1. Сульфат кальция реагирует с простыми веществами :
1.1. Сульфат кальция взаимодействует с углеродом (коксом) при 900º С и образует сульфид кальция, угарный газ или углекислый газ:
CaSO4 + 4C = CaS + 4CO
2. Сульфат кальция вступает в реакцию со многими сложными веществами :
2.1. Сульфат кальция взаимодействует с оксидами :
2.1.1. Сульфат в результате реакции с угарным газом при 600 — 800º С образует сульфид кальция и углекислый газ:
CaSO4 + 4CO = CaS + 4CO2
2.2. Сульфат кальция может реагировать с кислотами :
2.2.1. При взаимодействии с концентрированной серной кислотой сульфат кальция образует гидросульфат кальция:
2.3. Сульфат кальция реагирует с солями :
2.3.1. Сульфат кальция взаимодействует с концентрированным раствором карбоната натрия . При этом образуются карбонат кальция и сульфат натрия:
3. Сульфат кальция разлагается при температуре выше 1450º С, образуя оксид кальция, оксид серы и кислород:
Источник
Серная кислота оксид кальция сульфат кальция вода
Оксид кальция реагирует с
1)
2)
3)
4)
Основный оксид кальция может реагировать с кислотными оксидами, например, с .
Правильный ответ указан под номером 2.
N2O ведь тоже кислотный оксид, он может реагировать с основным оксидом CaO
И какая в таком случае кислота соответствует оксиду со степенью окисления азота +1?
Из предложенного перечня выберите две пары веществ, с каждым из которых реагирует оксид кальция:
1) и
2) и
3) и
4) и
5) и
Основный оксид кальция реагирует с кислотами и кислотными оксидами, а также с водой.
Источник
Acetyl
Это пилотный ролик из серии об органических реакциях.
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Источник |