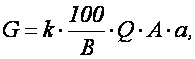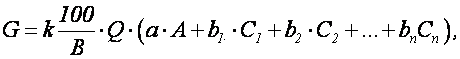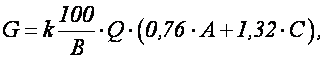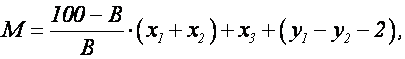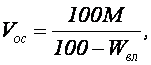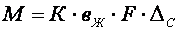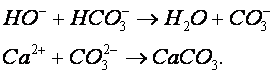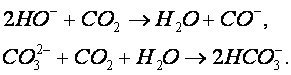Серная кислота сода вода
Разбирали гараж, обнаружили весомый запас электролита для АКБ.
Возник вопрос: как утилизировать электролит в гаражных условиях без вреда для здоровья и окружающей среды?
Обратится в спец.фирмы или вылить в безлюдном месте не предлагать.
Jobнулся?! Оно же просто взорвется! И вас обольет!
Отошел в сторонку, вырыл яму с пол-метра и лей. Потом засыпь обратно. В кислоте отравы — никакой. Почва ее сама нейтрализует.
В природе все разлагается. Даже водород. Если уж тебе так интересно — серная кислота свяжется с алюмосиликатами глины. Получится Алюмо-Сульфо-Силикат непонятного состава, но не вредный и не растворимый. И, вообще, даже если она нисчем не свяжется, а просто разбавится грунтовой водой, все равно настолько, что ее никто не заметит.
Серная кислота сама по себе абсолютно безвредна, нигде не накапливается, а наоборот всегда стремится «самонейтрализоваться»и «саморазбавиться», и ее опасность только в большой концентрации.
В природе все разлагается. Даже водород. Если уж тебе так интересно — серная кислота свяжется с алюмосиликатами глины. Получится Алюмо-Сульфо-Силикат непонятного состава, но не вредный и не растворимый. И, вообще, даже если она нисчем не свяжется, а просто разбавится грунтовой водой, все равно настолько, что ее никто не заметит.
Серная кислота сама по себе абсолютно безвредна, нигде не накапливается, а наоборот всегда стремится «самонейтрализоваться»и «саморазбавиться», и ее опасность только в большой концентрации.
Пропорции и условия взаимодействия — в студию — глины не насобираешь
чтобы разложить 20-30 литров концентрированной кислоты.
Намного быстрее она уйдёт в грунтовые воды, оттуда в водоёмы и в атмосферу, а мы потом искупаемся в кислотном дождике.
А гадить под себя — это плохая совковая привычка.
Не надо выливать кислоту: можно представить, что будет, если каждый владелец а/м выльет в землю по 20л серной кислоты)))
Про глину — реакция нейтрализации кислоты алюмосиликатами идёт очень МЕДЛЕННО — в итоге кислота запросто попадает в грунтовые воды.
Утилизация:
При нейтрализации содой выделается много углекислого газа — возможно вспенивание и выплёскивание смеси.
Если кислота уже разбавлена до «электролитной» концентрации (плотность 1,3 г/мл), то реакция нейтрализации остановится раньше, чем дойдёт до конца из-за кристаллизации твёрдого продукта — гидрата сульфата натрия. Безводная кислота с содой реагировать вообще не будет (или очень медленно). Концентрированную нужно разбавить в 2-5 раз (чем больше плотность, тем сильнее разбавление) водой. При разбавлении лить ТОЛЬКО кислоту в воду, но не наоборот (сильный разогрев, возможно закипание), затем нейтрализовать содой, как разбавленную.
После нейтрализации слить в канализацию.
Ps: А у вас ещё осталась «лишняя» концентрированная кислота?
Если в Москве, я бы забрал)))
Источник
Серная кислота сода вода
Регистрация
Вход
- В начало форума
- Правила форума
- Старый дизайн
- FAQ
- Поиск
- Пользователи
Когда я поливаю выкипевший\ пролитый электролит раствором соды что происходит на уровне формул.
Конкретно интересует образуется ли агрессивная среда для металлов\ покрытий или просто вода.
выкипевший\ пролитый электролит
Был опыт с электролитом, причём очень тупой 
Высохший электролит очень любит оставаться на пальцах, в итоге ещё новые джинсы порвались, на которые электролит попал только через руки
Ну и ещё пробовал капать электролит на землю, шыпит и пузырит едрённо
Забыл уже сколько % серной кислоты в электролите
Знаю что серная кислота в электролите кипит и испаряется только при 320 градусах! В отличие от 100 градусов у воды
получится соль сульфат натрия безопасный содежится в минеральной воде немного и морской воде в большом колве
углекислый газ и вода
Инструкция
по нейтрализации отработанной серной кислоты аккумуляторных батарей (2 класса опасности).
Нейтрализацию отработанного электролита проводят известковым молоком. Для приготовления одного литра известкового молока необходимо взять 100 граммов не гашенной извести (СаО). Процесс гашения извести сопровождается сильным разогревом и разбрызгиванием.
Для нейтрализации 1 литра электролита необходимо взять 7 литров известкового молока, при этом электролит порциями добавляют в известковое молоко. Окончание нейтрализации проверяют с помощью раствора индикатора (метилоранжа), цвет которого в нейтральном растворе -желтый, в кислом — красный.
Процесс нейтрализации электролита известковым молоком проходит с выделением теплоты и образованием нерастворимого в воде соединения сульфата кальция. Осветление воды после нейтрализации длится 2-3 часа. Осветленная вода сливается в ливневую канализацию. Шлам отработанного электролита и образовавшийся в процессе нейтрализации электролита и образовавшийся в процессе нейтрализации сульфат кальция, необходимо просушить, после чего сложить в место сбора отходов. По окончании работы необходимо провести уборку рабочего места, все приспособления, инструменты и материалы сложить в указанное место.
В случае проливов серной кислоты на пол ее следует немедленно нейтрализовать, посыпать известью, убрать лопатой, а затем тщательно промыть это место сильной струей воды. При попадании кислоты на одежду ее необходимо смыть обильной струей воды, нейтрализовать 2-3% раствором соды и снова промыть водой. При необходимости сдать спецодежду на санобработку и принять душ.
Источник
Глава 1. Основы очистки сточных вод
6. Химические методы очистки сточных вод
6.1. Нейтрализация
Сточные воды, содержащие минеральные кислоты или щелочи, перед сбросом их в водоемы или перед использованием в технологических процессах нейтрализуют. Практически нейтральными считаются воды, имеющие рН = 6,5-8,5. Следовательно, подвергать нейтрализации следует сточные воды с рН менее 6,5 и более 8,5, при этом необходимо учитывать нейтрализующую способность водоемов, а также щелочной резерв городских сточных вод. Из условий сброса производственных сточных вод в водоем или городскую канализацию, следует, что большую опасность представляют кислые стоки, которые встречаются к тому же значительно чаще, чем щелочные (количество сточных вод с рН > 8,5 невелико). В большинстве кислых сточных вод содержатся соли тяжелых металлов, которые необходимо выделить из этих вод.
Реакция нейтрализации – это химическая реакция между веществами, имеющими свойства кислоты и основания, которая приводит к потере характерных свойств обоих соединении. Наиболее типичная реакция нейтрализации в водных растворах происходит между гидратированными ионами водорода и ионами гидроксида, содержащимися соответственно в сильных кислотах и основаниях: Н + +ОН – = Н2О. В результате концентрация каждого из этих ионов становится равной той, которая свойственна самой воде (около 10 –7 ), т.е. активная реакция водной среды приближается к рН = 7.
Нейтрализацию можно проводить различным путем: смешением кислых и щелочных сточных вод, добавлением реагентов, фильтрованием кислых вод через нейтрализующие материалы, абсорбцией кислых газов щелочными водами или абсорбцией аммиака кислыми водами. Выбор метода нейтрализации зависит от объема и концентрации сточных вод от режима их поступления, наличия и стоимости реагентов. В процессе нейтрализации могут образовываться осадки, количество которых зависит от концентрации и состава сточных вод, а также от вида и расхода используемых реагентов. Применяют следующие способы нейтрализации: взаимная нейтрализация кислых и щелочных сточных вод (нейтрализация смешением); нейтрализация путем добавления реагентов, фильтрование через нейтрализующие материалы; нейтрализация кислыми дымовыми газами.
Выбор способа нейтрализации зависит от многих факторов, например, вида и концентрации кислот, загрязняющих производственные сточные воды; расхода и режима поступления отработанных вод на нейтрализацию; наличия реагентов; местных условий и др.
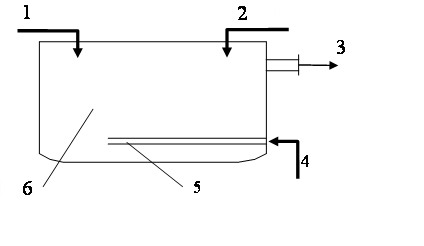
Нейтрализация смешением. Этот метод применяют, если на одном предприятии или на соседних предприятиях имеются кислые и щелочные воды, не загрязненные другими компонентами. Кислые и щелочные воды смешивают в емкости с мешалкой и без мешалки. В последнем случае перемешивание ведут воздухом (рис. 1.47) при его скорости в линии подачи 20-40 м/с.
Рис. 1.47. Нейтрализатор смешения:
1 – кислые сточные воды; 2 – щелочные сточные воды; 3 – нейтрализованная сточная вода; 4 – воздух;
5 – распределитель воздуха;
При переменной концентрации сточных вод в схеме предусматривают установку усреднителя или обеспечивают автоматическое регулирование подачи в камеру смешения. Расчет соотношения сточных вод, направляемых в камеру смешения, проводят по стехиометрическим уравнениям.
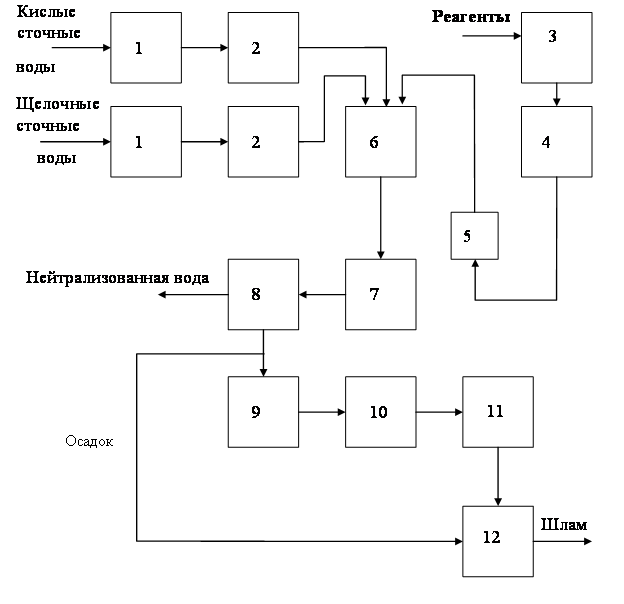
При избытке кислых или щелочных сточных вод добавляют соответствующие реагенты. Принципиальная схема водно-реагентной нейтрализации приведена на рис. 1.48. Нейтрализованную воду используют в производстве, а осадок обезвоживают на шламовых площадках или вакуум-фильтрах.
Рис. 1.48. Схема станции реагентной нейтрализации воды:
1 – песколовки; 2 – усреднители; 3 – емкость для реагентов; 4 – растворный бак; 5 – дозатор; 6 – смеситель; 7 – нейтрализатор; 8 – отстойник; 9 – осадкоуплотнитель; 10 – вакуум-фильтр; 11 – накопитель обезвоженных осадков; 12 – шламовая площадка
Нейтрализация путем добавления реагентов. Если на промышленном предприятии имеются только кислые или щелочные воды или невозможно обеспечить их взаимную нейтрализацию применяется реагентный метод нейтрализации. Этот метод наиболее широко используется для нейтрализации кислых сточных вод. Выбор реагента зависит от вида кислот, их концентрации, растворимости солей, образующихся в результате химической реакции.
Для нейтрализации минеральных кислот применяется любой щелочной реагент, чаще всего известь-пушонка, известковое молоко, карбонаты кальция и магния в виде суспензии. Эти реагенты сравнительно дешевы и общедоступны, но имеют ряд недостатков: обязательно устройство усреднителей перед нейтрализационной установкой; затруднительно регулирование дозы реагента по рН нейтрализованной водой; сложное реагентное хозяйство.
Скорость реакции между раствором кислоты и твердыми частицами суспензии относительно невелика и зависит от размеров частицы и растворимости образующегося в результате реакции нейтрализации соединения. Поэтому окончательная активная реакция устанавливается не сразу, а по истечении некоторого времени – 10-15 мин. Сказанное выше относится к сточным водам, содержащим сильные кислоты (H2SO4, H2SO4), кальциевые соли которых труднорастворимы в воде.
При нейтрализации сточных вод, содержащих серную кислоту (H2SO4), реакция в зависимости от применяемого реагента протекает по уравнениям:
Образующийся в результате нейтрализации сульфат кальция (гипс) кристаллизуется из разбавленных растворов в виде CaSO4·2H2O. Растворимость этой соли при температуре 0-40 0 С колеблется от 1,76 до 2,11 г/л.
При более высокой концентрации сульфат кальция выпадает в осадок, поэтому при нейтрализации сильных кислот, кальциевые соли которых труднорастворимы в воде, необходимо устраивать отстойники-шламонакопители. Существенным недостатком метода нейтрализации серной кислоты известью является образование пресыщенного раствора гипса (коэффициент пресыщения может достигать 4-6), выделение которого из сточной воды может продолжаться несколько суток, что приводит к зарастанию трубопроводов и аппаратуры. Присутствие в сточных водах многих химических производств высокомолекулярных органических соединений усиливает устойчивость пресыщенных растворов гипса, поскольку эти соединения сорбируются на гранях кристаллов сульфата кальция и препятствуют их дальнейшему росту.
Для уменьшения коэффициента пресыщения используется метод рециркуляции образующегося в результате нейтрализации осадка сульфата кальция. Концентрация ионов кальция в сточной воде уменьшается при увеличении дозы рециркулирующего осадка: продолжительность перемешивания этой воды должна быть не менее 20-30 мин. Для уменьшения зарастания трубопроводов, по которым транспортируются нейтрализованные известью сернокислотные стоки, применяют методы промывки, увеличивают скорость транспортирования, а также заменяют металлические трубопроводы на пластмассовые.
Поскольку в кислых и щелочных сточных водах практически всегда присутствуют ионы тяжелых металлов, то дозу реагентов следует определять с учетом выделений в осадок тяжелых металлов.
Количество реагента, необходимого для нейтрализации сточных вод определяется по формуле
где k – коэффициент запаса расхода реагента по сравнению с теоретическим k = 1,1 – для известкового молока, k = 1,5 – для известкового теста и сухой извести; В – количество активной части в товарном продукте, %; Q – количество сточных вод подлежащих нейтрализации, м 3 ; а – расход реагента для нейтрализации (табл. 1.7), г/кг
Расход реагентов для нейтрализации 100 % кислот и щелочей
При нейтрализации кислых и щелочных сточных вод содержащих соли тяжелых металлов, количество реагента будет определяться по формуле
где С1, С2,…,Сn – концентрации металлов в сточных водах, кг/м; b1, b2,…,bn, – концентрации реагентов, требуемых для перевода металла из растворенного состояния в осадок (табл. 1.8), кг/кг.
Расход реагентов, требуемых для удаления металлов
Например, при нейтрализации гашеной известью сточных вод, поступающих после травления черных металлов серной кислотой происходят следующие реакции:
На основании приведенных выше реакций или данных в табл. 1.7 и 1.8, а также по содержанию серной кислоты и железа в отработанных травильных растворах можно определить количество гашеной извести, необходимой для нейтрализации кислых сточных вод и осаждения железа
где А – содержание серной кислоты, кг/м 3 ; С – содержание железа, кг/м 3 .
Количество сухого вещества, которое образуется при нейтрализации 1м 3 сточной воды, содержащей свободную серную кислоту и соли тяжелых металлов, определяется по формуле
где М – масса сухого вещества, кг; В – содержание активного вещества в используемой извести, %; х1, х2 – количество активного вещества, необходимое соотвественно для осаждения металла и для нейтрализациии свободной серной кислоты, кг; х3 – количество образующихся гидроксидов металлов, кг; у1, у2 – количество сульфата кальция, образующиеся соответственно при осаждении металла и при нейтрализации свободной серной кислоты, кг.
Если значение третьего члена в приведенной формуле отрицательно, то он не учитывается.
Объем осадка, образующегося при нейтрализации сточной воды можно найти по уравнению
Для нейтрализации кислых вод могут быть использованы: NaOH, КОН, Na2CO3. NH4OH (аммиачная вода), СаСО3. доломит (СаСО3. MgСО3 ) цемент. Однако наиболее дешевым реагентом является гидроксид кальция (известковое молоко) с содержанием активной извести Са(ОН)2 5-10 %. Соду и гидроксид натрия следует использовать, если они являются отходами производства. Иногда для нейтрализации применяют различные отходы производства. Например, шлаки сталеплавильного, феррохромового и доменного производств используют для нейтрализации вод, содержащих серную кислоту.
Реагенты выбирают в зависимости от состава и концентрации кислой сточной воды. При этом учитывают, будет ли в процессе образовываться осадок или нет. Различают три вида кислотосодержащих сточных вод: 1) воды, содержащие слабые кислоты (Н2СО3, СН3СООН); 2) воды, содержащие сильные кислоты (НСl, HNO3). Для их нейтрализации может быть использован любой названный выше реагент. Соли этих кислот хорошо растворимы в воде; 3) воды, содержащие серную и сернистую кислоты. Кальциевые соли этих кислот плохо растворимы в воде и выпадают в осадок.
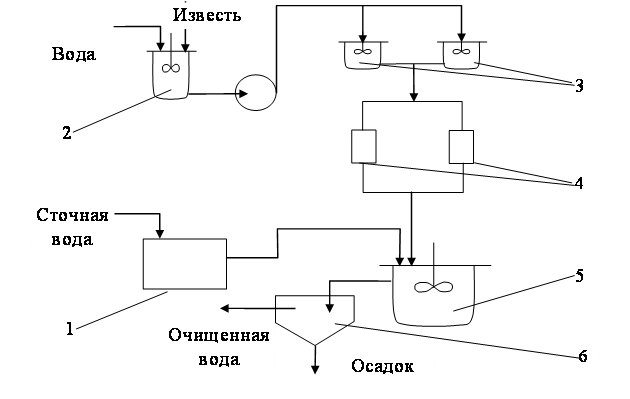
Известь для нейтрализации вводят в сточную воду в виде гидроксида кальция (известкового молока; «мокрое» дозирование) или в виде сухого порошка («сухое» дозирование). Схема установки для нейтрализации кислых вод известковым молоком показана на рис. 1.49.
Рис. 1.49. Схема установки нейтрализации кислых вод гидроксидом кальция:
1 – усреднитель; 2 – аппарат для гашения; 3 – растворные баки; 4 – дозаторы;
5 – нейтрализатор; 6 – отстойник
Для гашения извести используют шаровые мельницы мокрого помола, в которых одновременно происходят тонкое измельчение и гашение. Для смешения сточных вод с известковым молоком применяют гидравлические смесители различных типов: дырчатые, перегородчатые, вихревые, с механическими мешалками или барботажные с расходом воздуха 5-10 м 3 /ч на 1 м 2 свободной поверхности.
При нейтрализации сточных вод, содержащих серную кислоту, известковым молоком в осадок выпадает гипс CaSO4·2H:2O. Растворимость гипса мало меняется с температурой. При перемещении таких растворов происходит отложение гипса на стенках трубопроводов и их забивка. Для устранения забивки трубопровода необходимо промывать их чистой водой или добавлять в сточные воды специальные умягчители, например гексаметафосфат. Увеличение скорости движения нейтрализованных вод способствует уменьшению отложений гипса на стенках трубопровода.
Для нейтрализации щелочных сточных вод используют различные кислоты или кислые газы. Метод реагентной нейтрализации кислых и щелочных сточных вод широко используется на предприятиях химической промышленности.
Нейтрализация кислых вод фильтрованием через нейтрализующие материалы. В этом случае для нейтрализации кислых вод проводят фильтрование их через слой магнезита, доломита, известняка, мела, мрамора, твердых отходов (шлак, зола) и др. Процесс ведут в фильтрах-нейтрализаторах, которые могут быть горизонтальными или вертикальными крупность фракций материала загрузки 3-8 мм. Для вертикальных фильтров используют куски известняка или доломита размером 30-80 мм. При высоте слоя материала 0,85-1,2 м скорость должна быть не более 5 м/с и зависит от вида загрузочного материала, а продолжительность контакта не менее 10 мин. У горизонтальных фильтров скорость течения сточных вод 1-3 м/с. Нейтрализация соляно- и азотнокислых, а также сернокислых сточных вод при концентрации серной кислоты не более 1,5 г/л происходит на непрерывно действующих фильтрах.
Применение таких фильтров возможно при условии отсутствия в кислых сточных водах солей металлов, поскольку при рН > 7 они будут выпадать в осадок в виде труднорастворимых соединений, которые полностью забивают поры фильтра. Ограничивается применение нейтрализующих фильтров при подаче на них сернокислых сточных вод с концентрацией серной кислоты более 1,5 г/л. В этом случае количество образующегося сульфата кальция превышает его растворимость ( :2– ионов в воде меньше, чем ионов SO4 2 и С13 2– .
Процесс нейтрализации может быть проведен в реакторах с мешалкой, в распылительных, пленочных и тарельчатых колоннах.
Дымовые газы вентилятором подают в кольцевое пространство вокруг вала мешалки и распределяют мешалкой в виде пузырьков и струй в сточной воде, поступающей внутрь реактора. Благодаря большой поверхности контакта между водой и газами происходит быстрая нейтрализация сточной воды. Присутствие в газах SO2 способствует нейтрализации щелочных сточных вод.
При проведении процесса в тарельчатых колоннах степень нейтрализации увеличивается с ростом скорости газа и уменьшением плотности орошения.
Количество кислого газа, необходимого для нейтрализации, может быть определено по уравнению массоотдачи
где М – количество кислого газа, необходимого для нейтрализации; К – фактор ускорения; вЖ – коэффициент массоотдачи в жидкой фазе; F – поверхность контакта фаз; ∆С – движущая сила процесса.
Нейтрализация щелочных вод дымовыми газами использована в ряде производств, в том числе и в асбестоцементном производстве. Сточные воды этих производств имеют рН = 12-13. Щелочность воды обусловлена постоянным выщелачиванием в нее гидроксида кальция. Нейтрализацию проводили диоксидом углерода дымовых газов (5-6 % СО2) в тарельчатом абсорбере.
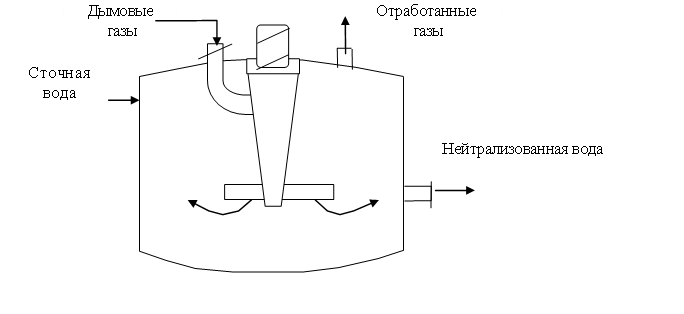
Особенностью нейтрализации дымовыми газами сточных вод асбестоцементного предприятия является образование карбоната кальция, который может находиться в состоянии пересыщения и отлагается на внутренней поверхности оборудования. Для предотвращения образования в абсорбере карбонатных отложений процесс нейтрализации следует проводить по циркуляционной схеме (рис. 1.50).
Сточная вода из усреднителя должна поступать в смеситель, где предварительно нейтрализуется частью воды, выходящей из абсорбера.
В смесителе протекают следующие реакции:
Рис. 1.50. Нейтрализатор дымовых вод щелочными газами
Образующийся осадок карбоната кальция осаждается в циркуляционной емкости. Предварительную нейтрализацию сточной воды проводят с целью получения на входе в абсорбер смеси с таким водородным показателем, при котором смесь при окончательной нейтрализации в абсорбере дымовыми газами не образует карбонатных отложений. При этом в абсорбере протекают следующие реакции:
Отношение объемных расходов циркулирующей и сточной воды, при котором образуется смесь, невыделяющая карбонатных отложений, зависит от состава сточной воды и составляет от 2,5 до 4.
Для нейтрализации применяют абсорберы с крупнодырчатыми провальными тарелками с большим свободным сечением. Например, тарелки со свободным сечением более 30 % и отверстиями размером 20 × 50 мм.
Нейтрализация щелочных вод дымовыми газами является примером ресурсосберегающей технологии, позволяющей исключить использование кислот, создать бессточную схему водопотребления (рис. 1.51) При этом ликвидируется сброс сточных вод, сокращается потребление свежей воды, экономится тепловая энергия на подогрев свежей воды, а также очищаются дымовые газы от кислых компонентов (СО2, SO2 и др.) и пыли.
Рис. 1.51. Бессточная схема водопотребления асбестоцементного завода:
1 – фильтр; 2, 5 – отстойники; 3 – усреднитель; 4 – смеситель; 6 – колонна;
Источник
 Регистрация
Регистрация Вход
Вход