Химия, Биология, подготовка к ГИА и ЕГЭ
Серная кислота химические свойства
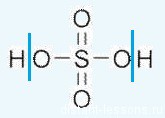
Формула серной кислоты — H2SO4
Тяжелая, маслянистая жидкость.
Чтобы лучше понять строение и свойства кислоты, почитайте про серу — именно из-за ее способности распаривать электроны и переносить их на d-подуровень степень окисления +6 стала возможной. Это максимальная степень окисления (максимальная с.о. соответствует номеру группы), поэтому для серной кислоты характерны окислительные свойства.
Давайте разберем все по подробнее…
Свойства кислоты
Почему серная кислота считается сильной? Потому что в растворе она практически полностью диссоциирует на ионы: H2SO4 = 2H(+) + SO4(2-)
Разбавленная серная кислота реагирует именно как кислота — с отщеплением водорода:
Качественная реакция на сульфат-ион:
Ba(2+) + SO4(-2) = BaSO4↓ (осадок белого цвета)
Окислительные свойства серной кислоты
Концентрированная серная кислота — довольно сильный окислитель:
Серная кислота и вода
C серной кислотой надо ОЧЕНЬ АККУРАТНО обращаться: при ее разбавлении надо приливать именно кислоту к воде.
Дело в том, что растворение кислоты сопровождается выделением большого количества тепла (стакан, пробирка или колба могут нагреться до 90 градусов!) , вода сильно нагревается и может произойти выброс ее из посуды (пробирка «плюнет» кислотой). Ожог от кислоты (тем более горячей) — очень страшный. Рубцы от ожога кислотой убрать нельзя никаким хирургическим путем.
Соли серной кислоты
- Средние: все атомы водорода замещены на металл: Na2SO4
- Кислые: от кислоты остался один водород: NaHSO4 — гидросульфат натрия.
Переход средняя соль —-> кислая соль:
Переход кислая соль —->средняя соль:
Как видите, серная кислота не обладает большим разнообразием продуктов реакции, но по химическим свойствам — очень активна и как кислота, и как кислота-окислитель.
Источник
Серная кислота
Серная кислота
Строение молекулы и физические свойства
Серная кислота H2SO4 – это сильная кислота, двухосновная, прочная и нелетучая. При обычных условиях серная кислота – тяжелая маслянистая жидкость, хорошо растворимая в воде.
Растворение серной кислоты в воде сопровождается выделением значительного количества кислоты. Поэтому по правилам безопасности в лаборатории при смешивании серной кислоты и воды мы добавляем серную кислоту в воду небольшими порциями при постоянном перемешивании.
Валентность серы в серной кислоте равна VI.
Способы получения
1. Серную кислоту в промышленности производят из серы, сульфидов металлов, сероводорода и др. Один из вариантов — производство серной кислоты из пирита FeS2.
Основные стадии получения серной кислоты :
- Сжигание или обжиг серосодержащего сырья в кислороде с получением сернистого газа.
- Очистка полученного газа от примесей.
- Окисление сернистого газа в серный ангидрид.
- Взаимодействие серного ангидрида с водой.
Рассмотрим основные аппараты, используемые при производстве серной кислоты из пирита (контактный метод):
| Аппарат | Назначение и уравнения реакций |
| Печь для обжига | 4FeS2 + 11O2 → 2Fe2O3 + 8SO2 + Q Измельченный очищенный пирит сверху засыпают в печь для обжига в «кипящем слое». Снизу (принцип противотока) пропускают воздух, обогащенный кислородом, для более полного обжига пирита. Температура в печи для обжига достигает 800 о С |
| Циклон | Из печи выходит печной газ, который состоит из SO2, кислорода, паров воды и мельчайших частиц оксида железа. Такой печной газ очищают от примесей. Очистку печного газа проводят в два этапа. Первый этап — очистка газа в циклоне. При этом за счет центробежной силы твердые частички ссыпаются вниз. |
| Электрофильтр | Второй этап очистки газа проводится в электрофильтрах. При этом используется электростатическое притяжение, частицы огарка прилипают к наэлектризованным пластинам электрофильтра). |
| Сушильная башня | Осушку печного газа проводят в сушильной башне – снизу вверх поднимается печной газ, а сверху вниз льется концентрированная серная кислота. |
| Теплообменник | Очищенный обжиговый газ перед поступлением в контактный аппарат нагревают за счет теплоты газов, выходящих из контактного аппарата. |
| Контактный аппарат | 2SO2 + O2 ↔ 2SO3 + Q В контактном аппарате производится окисление сернистого газа до серного ангидрида. Процесс является обратимым. Поэтому необходимо выбрать оптимальные условия протекания прямой реакции (получения SO3):
Как только смесь оксида серы и кислорода достигнет слоев катализатора, начинается процесс окисления SO2 в SO3. Образовавшийся оксид серы SO3 выходит из контактного аппарата и через теплообменник попадает в поглотительную башню. |
| Поглотительная башня | Получение H2SO4 протекает в поглотительной башне. Однако, если для поглощения оксида серы использовать воду, то образуется серная кислота в виде тумана, состоящего из мельчайших капелек серной кислоты. Для того, чтобы не образовывался сернокислотный туман, используют 98%-ную концентрированную серную кислоту. Оксид серы очень хорошо растворяется в такой кислоте, образуя олеум: H2SO4·nSO3. Образовавшийся олеум сливают в металлические резервуары и отправляют на склад. Затем олеумом заполняют цистерны, формируют железнодорожные составы и отправляют потребителю. |
Общие научные принципы химического производства:
- Непрерывность.
- Противоток
- Катализ
- Увеличение площади соприкосновения реагирующих веществ.
- Теплообмен
- Рациональное использование сырья
Химические свойства
Серная кислота – это сильная двухосновная кислота .
1. Серная кислота практически полностью диссоциирует в разбавленном в растворе по первой ступени:
По второй ступени серная кислота диссоциирует частично, ведет себя, как кислота средней силы:
HSO4 – ⇄ H + + SO4 2–
2. Серная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например , серная кислота взаимодействует с оксидом магния:
Еще пример : при взаимодействии серной кислоты с гидроксидом калия образуются сульфаты или гидросульфаты:
Серная кислота взаимодействует с амфотерным гидроксидом алюминия:
3. Серная кислота вытесняет более слабые из солей в растворе (карбонаты, сульфиды и др.). Также серная кислота вытесняет летучие кислоты из их солей (кроме солей HBr и HI).
Например , серная кислота взаимодействует с гидрокарбонатом натрия:
Или с силикатом натрия:
Концентрированная серная кислота реагирует с твердым нитратом натрия. При этом менее летучая серная кислота вытесняет азотную кислоту:
Аналогично – концентрированная серная кислота вытесняет хлороводород из твердых хлоридов, например , хлорида натрия:
4. Т акже серная кислота вступает в обменные реакции с солями.
Например , серная кислота взаимодействует с хлоридом бария:
5. Разбавленная серная кислота взаимодействует с металлами, которые расположены в ряду активности металлов до водорода. При этом образуются соль и водород.
Например , серная кислота реагирует с железом. При этом образуется сульфат железа (II):
Серная кислота взаимодействует с аммиаком с образованием солей аммония:
Концентрированная серная кислота является сильным окислителем . При этом она обычно восстанавливается до сернистого газа SO2. С активными металлами может восстанавливаться до серы S, или сероводорода Н2S.
Железо Fe, алюминий Al, хром Cr пассивируются концентрированной серной кислотой на холоде. При нагревании реакция возможна.
При взаимодействии с неактивными металлами концентрированная серная кислота восстанавливается до сернистого газа:
При взаимодействии с щелочноземельными металлами и магнием концентрированная серная кислота восстанавливается до серы:
При взаимодействии с щелочными металлами и цинком концентрированная серная кислота восстанавливается до сероводорода:
6. Качественная реакция на сульфат-ионы – взаимодействие с растворимыми солями бария. При этом образуется белый кристаллический осадок сульфата бария:
Видеоопыт взаимодействия хлорида бария и сульфата натрия в растворе (качественная реакция на сульфат-ион) можно посмотреть здесь.
7. Окислительные свойства концентрированной серной кислоты проявляются и при взаимодействии с неметаллами.
Например , концентрированная серная кислота окисляет фосфор, углерод, серу. При этом серная кислота восстанавливается до оксида серы (IV):
Уже при комнатной температуре концентрированная серная кислота окисляет галогеноводороды и сероводород:
Источник
Серная кислота вода что происходит
При смешивании концентрированной серной кислоты и воды выделяется много тепла. Для химика этот факт очень важен, поскольку и в лаборатории, и в промышленности часто приходится готовить разбавленные растворы серной кислоты. Для этого нужно смешивать концентрированную серную кислоту с водой — не всегда, но часто.
Как смешать концентрированную серную кислоту и воду?
Во всех учебниках и практикумах настоятельно рекомендуют лить серную кислоту в воду (тонкой струйкой и при хорошем перемешивании) — а не наоборот: нельзя лить воду в концентрированную серную кислоту!
Почему? Серная кислота более тяжелая, чем вода.
Если лить кислоту тонкой струйкой в воду, то кислота опустится на дно. Тепло, которое выделится при смешивании, рассеется — пойдет на нагрев всей массы раствора, поскольку над слоем кислоты, которая опустилась на дно сосуда, расположено большое количество воды.
Тепло рассеется, раствор нагреется — и ничего плохого не произойдет, особенно, если в процессе добавлении кислоты к воде жидкость хорошо перемешивать.
А что будет, если сделать неправильно , — в концентрированную серную кислоту добавить воду? Когда первые порции воды попадут в серную кислоту, они останутся на поверхности (поскольку вода легче, чем концентрированная серная кислота). Выделится много тепла, которое пойдет на нагрев маленького количества воды.
Вода резко вскипит, в результате полетят брызги серной кислоты и образуется едкий аэрозоль. Эффект может быть примерно такой, как при добавлении воды на горячую сковородку с маслом. Брызги серной кислоты могут попасть в глаза, на кожу и одежду. Аэрозоль серной кислоты не только очень неприятен при вдыхании, но и опасен для легких.
Если стекло не термостойкое — сосуд может треснуть.
Поэтому во всех практикумах рекомендуют добавлять концентрированную серную кислоту к воде, а не наоборот!
Чтобы это правило было легче запомнить, придумывают специальные стишки вроде:
«Сначала вода, а потом кислота — иначе случиться большая беда!».
Используют также специальные фразы для запоминания — «мемы», например:
Книги — хорошо, но решил заснять, как выглядит результат неправильного смешивания концентрированной серной кислоты и воды на практике.
Разумеется, со всеми мерами предосторожности: начиная от защитных очков, заканчивая использованием небольших количеств веществ.
Провел несколько экспериментов — я пробовал смешивать серную кислоту с водой (и правильно, и неправильно). Во обоих случаях наблюдался лишь сильный разогрев. А закипания, разбрызгивания, и подобного не происходило.
Для примера, опишу один из экспериментов, проведенный в пробирке. Концентрированной серной кислоты взял 20 мл, воды 5 мл. Обе жидкости комнатной температуры.
Начал добавлять к серной кислоте воду. Вода закипела лишь в момент, когда приливал первые порции воды к кислоте. Новые порции воды погасили кипение. Едкий аэрозоль полетел (к этому я был не готов, пришлось на несколько секунд отойти). Попробовал перемешать алюминиевой проволочкой (то, что было под рукой). Эффекта ноль. Измерил температуру термометром. Оказалось 80 градусов по Цельсию. Эксперимент удался едва ли.
Новый эксперимент провел в колбе: чтобы поверхность соприкосновения двух жидкостей была максимальной (это обеспечит более резкое выделение тепла), а толщина слоя воды над серной кислотой — минимальной. Воду добавлял не всю сразу, а небольшими порциями (чтобы тепло пошло на кипение воды, а не на нагрев всей массы воды).
Итак, в коническую колбу налил около 10-15 мл концентрированной серной кислоты. Воды использовал около 10 мл.
Пока готовился к опыту, кислота под палящим солнцем разогрелась до 36-37 градусов (что градусов на 20 выше, чем начальная температура кислоты в прошлом опыте). Вода в пробирке тоже слегка нагрелась, но не так сильно. Думаю, это сыграло большую роль в успехе опыта.
При добавлении основной порции воды в серную кислоту заметно летели брызги и едкий аэрозоль. К счастью, их сносило ветром, который дул с моей стороны, поэтому я даже ничего не ощутил.
В итоге, температура в пробирке поднялась выше 100 градусов!
Какие можно сделать выводы? Если нарушить правило, что нельзя добавлять воду к концентрированной серной кислоте , разбрызгивание происходит не всегда, но оно возможно — особенно, когда вода и кислота теплые. Особенно — если добавлять воду медленно, небольшими порциями и в широкой посуде.
При работе с бОльшими количествами воды и кислоты вероятность резкого разогрева и разбрызгивания возрастает (напоминаю: мы взяли всего несколько миллилитров).
Опыт, который демонстрирует, что нельзя добавлять воду в концентрированную серную кислоту , описан в практикуме авторов Рипан и Четяну [1].
Если в концентрированную серную кислоту наливать воду, то первые капли воды, попавшие в нее, моментально превращаются в пар и из сосуда вылетают брызги жидкости. Это происходит по той причине, что вода, обладая небольшим удельным весом, не погружается в кислоту, а кислота ввиду малой теплоемкости не поглощает выделившейся теплоты. При вливании горячей воды наблюдается более сильное разбрызгивание серной кислоты.
Опыт. Смешивание воды с концентрированной Н2SO4. Стаканчик с концентрированной серной кислотой ставят на дно большого стакана, прикрытого воронкой. Теплую воду вливают при помощи пипетки (рис. 161). При вливании горячей воды внутренние стенки большого стакана и воронки моментально покрываются брызгами жидкости.
За неимением стеклянной воронки можно воспользоваться картонной, внутрь которой вводят пипетку с водой.
Если в стакан с водой приливать по каплям или тонкой струей концентрированную серную кислоту, то можно заметить, как более тяжелая серная кислота опускается на дно стакана.
При смешивании концентрированной Н2SO4 со льдом можно одновременно наблюдать два явления: гидратацию кислоты, сопровождающуюся выделением тепла, и плавление льда, сопровождающееся поглощением тепла. Поэтому в результате смешивания можно наблюдать либо повышение, либо понижение температуры. Так, при смешивании 1 кг льда с 4 кг кислоты температура повышается почти до 100°, а при смешивании 4 кг льда с 1 кг кислоты температура снижается почти до -20°.
__________________________________________________
1 Р. Рипан, И. Четяну Руководство к практическим работам по неорганической химии [ссылка]
| Неправильное смешивание концентрированной серной кислоты с водой (как это выглядит на практике) |
| К сказанному можно добавить, что при смешивании воды и олеума выделяется гораздо больше тепла, чем при смешивании воды и концентрированной серной кислоты [2]. Более того, химики, когда моют посуду от олеума, предпочитают сначала смывать олеум концентрированной серной кислотой, и только потом концентрированную серную кислоту смывают водой. Если остатки олеума сразу смывать водой, стекло может треснуть — даже термостойкое стекло. __________________________________________________ |
| Завод серной кислоты К1 Пробирочный вариант опыта: 2 мл концентрированной серной кислоты (олеум — еще лучше) и добавлять по каплям воду. Еще как кипит и хлопает. Источник |








