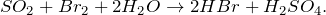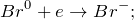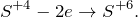Оксид серы (IV)
Оксид серы (IV) – это кислотный оксид . Бесцветный газ с резким запахом, хорошо растворимый в воде.
Cпособы получения оксида серы (IV)
1. Сжигание серы на воздухе :
2. Горение сульфидов и сероводорода:
2CuS + 3O2 → 2SO2 + 2CuO
3. Взаимодействие сульфитов с более сильными кислотами:
Например , сульфит натрия взаимодействует с серной кислотой:
4. Обработка концентрированной серной кислотой неактивных металлов.
Например , взаимодействие меди с концентрированной серной кислотой:
Химические свойства оксида серы (IV)
Оксид серы (IV) – это типичный кислотный оксид. За счет серы в степени окисления +4 проявляет свойства окислителя и восстановителя .
1. Как кислотный оксид, сернистый газ реагирует с щелочами и оксидами щелочных и щелочноземельных металлов .
Например , оксид серы (IV) реагирует с гидроксидом натрия. При этом образуется либо кислая соль (при избытке сернистого газа), либо средняя соль (при избытке щелочи):
SO2(изб) + NaOH → NaHSO3
Еще пример : оксид серы (IV) реагирует с основным оксидом натрия:
2. При взаимодействии с водой S O2 образует сернистую кислоту. Реакция обратимая, т.к. сернистая кислота в водном растворе в значительной степени распадается на оксид и воду.
3. Наиболее ярко выражены восстановительные свойства SO2. При взаимодействии с окислителями степень окисления серы повышается.
Например , оксид серы окисляется кислородом на катализаторе в жестких условиях. Реакция также сильно обратимая:
Сернистый ангидрид обесцвечивает бромную воду:
Азотная кислота очень легко окисляет сернистый газ:
Озон также окисляет оксид серы (IV):
Качественная реакция на сернистый газ и на сульфит-ион – обесцвечивание раствора перманганата калия:
Оксид свинца (IV) также окисляет сернистый газ:
4. В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства.
Например , при взаимодействии с сероводородом сернистый газ восстанавливается до молекулярной серы:
Оксид серы (IV) окисляет угарный газ и углерод:
SO2 + 2CO → 2СО2 + S
Источник
Тренажер задания 31 по химии серы
- Сернистый газ пропустили через раствор перекиси водорода. Из образовавшегося раствора выпарили воду и к остатку добавили магниевую стружку. Выделившийся газ пропустили через раствор медного купороса. Выпавший осадок черного цвета отделили и подвергли обжигу. Напишите уравнения описанных реакций.
- При обжиге некоторого минерала А, состоящего из двух элементов, образуется газ, имеющий характерный резкий запах и обесцвечивающий бромную воду с образованием в растворе двух сильных кислот. При взаимодействии вещества Б, состоящего из тех же элементов, что и минерал А, но в другом соотношении, с концентрированной хлороводородной кислотой выделился ядовитый газ с запахом тухлых яиц. При взаимодействии выделившихся газов друг с другом образуется простое вещество желтого цвета и вода. Напишите уравнения описанных реакций.
- Твердое вещество, образующееся при взаимодействии сернистого газа и сероводорода, при нагревании взаимодействует с алюминием. Продукт реакции растворили в разбавленной серной кислоте и в образовавшийся раствор добавили поташ. Напишите уравнения описанных реакций.
- Раствор средней соли, образующейся при пропускании сернистого газа через раствор щелочи, на длительное время оставили на воздухе. Твердое вещество, образующееся после выпаривания раствора, смешали с коксом и нагрели до высокой температуры. При добавлении к твердому продукту реакции соляной кислоты выделился газ с запахом тухлых яиц. Напишите уравнения описанных реакций.
- Сернистый газ растворили в воде и раствор нейтрализовали, добавляя едкий натр. В образовавшийся раствор добавили перекись водорода и после окончания реакции ─ серную кислоту. Напишите уравнения описанных реакций.
- Несколько гранул цинка внесли в сосуд с концентрированной серной кислотой. Выделяющийся газ пропустили через раствор ацетата свинца (II), осадок отделили, подвергли обжигу и образовавшийся газ ввели во взаимодействие с водным раствором перманганата калия. Напишите уравнения описанных реакций.
- К нагретой концентрированной серной кислоте добавили медную стружку и выделившийся газ пропустили через раствор едкого натра (избыток). Продукт реакции выделили, растворили в воде и нагрели с серой, которая в результате проведения реакции растворилась. В полученный раствор добавили разбавленную серную кислоту. Напишите уравнения описанных реакций.
- На сульфид двухвалентного железа подействовали раствором соляной кислоты, выделившийся газ собрали и сожгли в воздухе. Продукты реакции пропустили через избыток раствора едкого кали, после чего в образовавшийся раствор добавили раствор перманганата калия. Напишите уравнения описанных реакций.
10. Пирит подвергли обжигу, полученный газ с резким запахом пропустили через сероводородную кислоту. Образовавшийся желтоватый осадок отфильтровали, просушили, смешали с концентрированной азотной кислотой и нагрели. Полученный раствор дает осадок с нитратом серебра. Напишите уравнения описанных реакций.
11) Газ, полученный при обжиге пирита, вступил в реакцию с сероводородом. полученное в результате реакции вещество желтого цвета обработали концентрированной азотной кислотой при нагревании. К образовавшемуся раствору прилили раствор хлорида бария. Напишите уравнения описанных реакций.
12) Сульфид цинка подвергли обжигу. Образовавшийся газ с резким запахом пропустили через раствор сероводорода до выпадения желтого осадка. Осадок отфильтровали, просушили и с алюминием. Полученное соединение поместили в воду до прекращения реакции. Напишите уравнения описанных реакций.
13) Сульфид цинка обработали раствором соляной кислоты, полученный газ пропустили через избыток раствора гидроксида натрия, затем добавили раствор хлорида железа (II). Полученный осадок подвергли обжигу. Напишите уравнения описанных реакций.
14) Некоторое количество сульфида железа (II) разделили на две части. Одну часть обработали соляной кислотой, а другую часть подвергли обжигу на воздухе. При взаимодействии выделившихся газов получилось желтое вещество, которое нагрели с концентрированной азотной кислотой. Напишите уравнения описанных реакций.
15) Серу нагрели в атмосфере хлора. Полученный продукт обработали концентрированной серной кислотой при нагревании. Выделившийся при этом сернистый газ растворили в избытке раствора гидроксида калия. Получившаяся соль прореагировала с порошком серы при кипячении раствора. Напишите уравнения описанных реакций.
16) Порошок сульфида хрома (III) растворили в серной кислоте. При этом выделился газ и образовался окрашенный раствор. К полученному раствору добавили избыток раствора аммиака, а газ пропустили через раствор нитрата свинца. Полученный при этом черный осадок побелел после обработки его пероксидом натрия. Напишите уравнения описанных реакций.
17) Калий сплавили с серой. Полученную соль обработали соляной кислотой. Выделившийся при этом газ пропустили через раствор бихромата калия в кислой среде. Выпавшее вещество желтого цвета отфильтровали и сплавили с алюминием. Напишите уравнения описанных реакций.
18) Железо сплавили с серой, полученную соль обработали разбавленной серной кислотой. Выделившийся газ сожгли в избытке кислорода, а образовавшееся соединение поглотили раствором гидроксида калия. Напишите уравнения описанных реакций.
19) Серу сплавили с алюминием, полученную соль растворили в воде. Выпавший осадок растворили в избытке гидроксида калия, а газ сожгли в избытке кислорода. Напишите уравнения описанных реакций.
20) Серу растворили в кипящем растворе гидроксида натрия. к полученному раствору добавили хлорид цинка, выпавший осадок отфильтровали и сожгли а кислороде. Образовавшийся при этом газ прореагировал с сероводородом. Напишите уравнения описанных реакций.
21) Оксид серы (IV) окислили кислородом в присутствии катализатора. Образовавшееся вещество поглотили избытком гидроксида натрия, а к полученному раствору добавили раствор хлорида бария. Выпавший осадок отфильтровали и прокалили с коксом. Напишите уравнения описанных реакций.
Источник
SO2 + Br2 = ? уравнение реакции
Какие продукты образуются в результате взаимодействия диоксида серы с бромной водой (SO2 + Br2 = ?)? Относится ли эта реакция к ОВР? Укажите окислитель и восстановитель. Дайте краткую характеристику брома.
В результате взаимодействия диоксида серы с бромной водой (SO2 + Br2 = ?) происходит образование бромоводорода и серной кислоты. Молекулярное уравнение реакции имеет вид:
Записать уравнение в ионном виде в данном случае не предоставляется возможным, поскольку реакция протекает не в растворе.
Данная реакция относится к окислительно-восстановительным, поскольку химические элементы бром и сера изменяют свои степени окисления. Схемы электронного баланса выглядят следующим образом:
Бром – галоген. В жидком состоянии плохо растворяет воду. При обычных условиях умеренно растворяется в воде и в небольшой степени подвергается дисмутации («бромная вода»); в присутствии бромидов и хлоридов щелочных металлов растворимость повышается, в присутствии сульфатов — понижается. Неограниченно смешивается с сероуглеродом, тетрахлоридом углерода. Реагирует со щелочами. Сильный окислитель. Образует соединения с другими галогенами.
Подобно хлору бром находится в природе преимущественно в виде солей калия, натрия и магния. Бромиды металлов содержатся в морской воде, в некоторых озерах и подземных рассолах.
Источник
Сернистый газ обесцвечивает бромную воду
Установите соответствие между формулой газа и качественной реакцией, позволяющей идентифицировать этот газ.
| ФОРМУЛА ГАЗА | КАЧЕСТВЕННАЯ РЕАКЦИЯ |
Запишите в таблицу выбранные цифры под соответствующими буквами.
А. Оксид азота (II) на воздухе мгновенно переходит в оксид азота (IV) — газ бурого цвета. (3)
Б. В ходе взаимодействия хлора с иодкрахмальной бумагой выделяется молекулярной иод, который и окрашивает в синий цвет бумагу под действием крахмала. (2)
В. При пропускании бромоводорода через водный раствор нитрата серебра выпадает бледно-жёлтый творожистый осадок бромида серебра. (4)
Г. Сернистый газ обесцвечивает бромную воду — образуется смесь серной и бромоводородной кислот. (5)
Источник
Сернистый газ обесцвечивает бромную воду
Рассылка закрыта
При закрытии подписчики были переданы в рассылку «Все о тренингах для бизнеса» на которую и рекомендуем вам подписаться.
Вы можете найти рассылки сходной тематики в Каталоге рассылок.
Статистика
Школьная химия — легко! Урок 94. Оксиды серы
Здравствуйте, уважаемые читатели рассылки! Продолжаем изучать школьную химию с легкостью.
Спешу сообщить, что у меня появился свой сайт — пока очень простой, но я пока еще не волшебник, а только учусь, и это мое первое жизнеспособное детище. Если не обращать внимание на весьма скромный дизайн (вернее, его полное отсутствие), то в смысле информации кое-что полезное можно там найти. Принимаю советы, пожелания и все такое.
А теперь продолжим изучение соединений серы.
Из оксидов серы наиболее устойчивы два: диоксид SO 2 и триоксид SO 3 .
Диоксид серы SO 2 — сернистый газ, сернистый ангидрид — бесцветный газ с запахом горящей серы, ядовит. Довольно хорошо растворяется в воде.
1. Горение серы на воздухе или в кислороде.
2. В лаборатории SO 2 получают действием соляной или разбавленной серной кислот на сульфиты или взаимодействие меди с концентрированной серной кислотой^
K 2 SO 3 + 2HCl => 2KCl + SO 2 + H 2 O
Cu + 2H 2 SO 4 => CuSO 4 + SO 2 + 2H 2 O
3. В промышленности получают обжигом минералов, содержащих серу.
4FeS 2 + 11O 2 => 2Fe 2 O 3 + 8SO 2
SO 2 содержит атомы серы с промежуточной для нее степенью окисления +4, поэтому атомы серы могут как отдавать электроны, так и принимать их. Таким образом, в химических реакциях диоксид серы может быть как восстановителем, так и окислителем.
1. SO 2 окисляется кислородом до триоксида серы (катализатор — оксид пятивалентного ванадия V 2 O 5 ):
2SO 2 + O 2 => 2SO 3
2. SO 2 обесцвечивает бромную и иодную воду (растворы брома и иода в воде):
SO 2 + Br 2 + 2H 2 O => H 2 SO 4 + 2HBr
SO 2 + I 2 + 2H 2 O => H 2 SO 4 + 2HI
При пропускании диоксида серы в эти растворы желто-коричневого цвета их окраска постепенно бледнеет, так как при реакции образуются бесцветные соединения — серная и галогеноводородные кислоты.
3. Если одновременно пропускать в воду в одном и том же сосуде сероводород и диоксид серы, то жидкость мутнеет, так как выпадает осадок серы:
2H 2 S + SO 2 => 2H 2 O + 3S
Эта реакция — один из важнейших процессов, протекающих в природе. При извержении вулканов выделяются SO 2 и H 2 S, и при их взаимодействии образуется сера в виде крупных кристаллов.
4. SO 2 , подобно CO 2 , является кислотным оксидом: при взаимодействии с водой образует сернистую кислоту средней силы (она непрочна и легко разлагается при нагревании):
SO 2 + H 2 O => H 2 SO 3
5. SO 2 взаимодействует с оксидами активных металлов и щелочами с образованием солей сернистой кислоты — сульфитов и гидросульфитов:
SO 2 + CaO => CaSO 3
SO 2 + KOH => KHSO 3
SO 2 + 2KOH => K 2 SO 3 + H 2 O
SO 2 обесцвечивает органические красителя и применяется для отбеливания шелка, шерсти и соломы. Этим газом окуривают животных для лечения чесотки, а также склады, подвали и тару для уничтожения плесневых грибков
SO 3 — серный ангидрид, триоксид серы — существует в двух аллотропных формах: жидкой и кристаллической. В природе не встречается, получается окислением диоксида серы (смотри выше).
1. Жадно соединяется с водой, образуя серную кислоту:
SO 3 + H 2 O => H 2 SO 4
Эта реакция используется в технике для производства серной кислоты. Раствор SO 3 в безводной серной кислоты называется олеум.
2. Взаимодействует с оксидами металлов и щелочами, образуя сульфаты и гидросульфаты:
SO 3 + CaO => CaSO 4
SO 3 + NaOH => NaHSO 4
SO 3 + 2NaOH => Na 2 SO 4 + H 2 O
Вот и все на сегодня.
Автор рассылки Татьяна Кузьмина, Ульяновск astera52@mail.ru
Пишите письма, задавайте вопросы.
Скорая интернет-помощь по школьной химии
Электронные учебники «Химия для ленивых» и «Химия металлов и неметаллов»
Подробности — в предыдущих выпусках рассылки
Источник