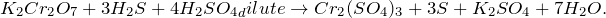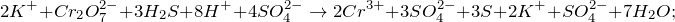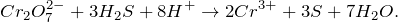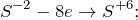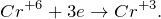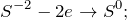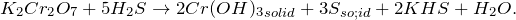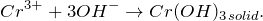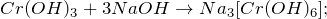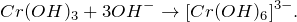K2Cr2O7 + H2S + H2SO4 = ? уравнение реакции
Составьте химическое уравнение по схеме K2Cr2O7 + H2S + H2SO4 = ? Запишите молекулярное и ионное уравнения реакции. Укажите окислитель и восстановитель. Дайте определение окислительно-восстановительным реакциям. Заранее, большое спасибо!
В результате окисления сероводорода дихроматом калия в кислой среде, создаваемой серной кислотой (K2Cr2O7 + H2S + H2SO4 = ?) происходит образование средних солей сульфатов хрома (III) и калия, воды и выделение серы в чистом виде. Молекулярное уравнение реакции имеет вид:
Запишем ионные уравнения, учитывая, что газообразные, простые вещества и вода на ионы не распадаются, т.е. не диссоциируют.
Первое уравнение называют полным ионным, а второе – сокращенным ионным.
Данная реакция относится к окислительно-восстановительным, поскольку химические элементы сера и хром изменяют свои степени окисления. Схемы электронного баланса выглядят следующим образом:
Окисление – это отдача электронов веществом, т.е. повышение степени окисление элемента. Вещества, отдающие свои электроны в процессе реакции, называются восстановителями (в данном случае это сероводород).
Восстановление – это смещение электронов к веществу или понижение степени окисления элемента. Вещества, принимающее электроны, называется окислителем (в данном случае это дихромат калия).
Источник
K2Cr2O7 + H2S = ? уравнение реакции
Подскажите, относится ли к ОВР взаимодействие между дихроматом калия и сероводородом (K2Cr2O7 + H2S = ?). Запишите уравнение реакции. Укажите основные физические и химические свойства твердого продукта реакции. Приведите способы получения этого вещества.
Реакция взаимодействия между дихроматом калия и сероводородом (K2Cr2O7 + H2S = ?) приводит к образованию аморфного осадка – гидроксида хрома (III), серы, гидросульфата калия и воды. Степень окисления серы повышается, а хрома — понижается.
Учитывая отношение чисел электронов, принятых при восстановлении хрома и отданных при окислении серы (равно 3:2), запишем уравнение в молекулярной форме с расставленными стехиометрическими коэффициентами:
Гидроксид хрома (III) выпадает в виде синевато-серого осадка при действии щелочей на соли хрома (III):
Подобно гидроксидам алюминия и цинка, он имеет амфотерный характер и растворяется в кислотах с образованием солей хрома (III), а в щелочах – с образованием изумрудно-зеленых растворов хромитов, например:
Гидроксид хрома (III) нашел применение в лабораторной практике в качестве субстрата для синтеза других соединений хрома.
Источник
Предположите продукты реакций, расставьте коэффициенты. Выбранные Вами продукты реакций обоснуйте
Пример выполнения домашнего задания:
Задание: дихромат калия с водным раствором сероводорода.
Решение: Дихромат калия – окислитель, сероводород – восстановитель, среда будет близка к нейтральной, так как сероводород – очень слабая кислота, а растворимость сероводорода незначительная.
В нейтральной среде дихромат восстанавливается до гидроксида хрома (III) (схема 3), а сероводород окисляется до серы (схема 7)
1) перманганат калия с нитритом натрия в растворе гидроксида калия;
2) сероводород с водным раствором хромата калия;
3) алюминий с очень разбавленной азотной кислотой (см. таблицу 1);
4) фосфор с концентрированной серной кислотой;
5) сульфит калия с концентрированной азотной кислотой;
6) бромат калия с йодидом калия в сернокислом растворе;
7) сульфат железа (II)с концентрированной серной кислотой;
8) сульфат хрома (III) с бромом в растворе гидроксида калия;
9) нитрат натрия с раствором гидроксида натрия в присутствии алюминия;
10) феррат калия с водным раствором аммиака.
Тема 4. Методика решения заданий С1.
Все задания С1 можно условно разделить на 2 группы:
1) в левой и правой части схемы пропущены вещества, не включающие атомы окислителя и восстановителя. В этих заданиях нужно определить побочные продукты и/или вещества, определяющие среду реакции;
2) в левой или правой части схемы пропущены вещества, содержащие атомы окислителя или восстановителя. Здесь нужно определить формулу окислителя или восстановителя, или формулу основного продукта, содержащего атомы окислителя или восстановителя. В дальнейшем мы будем условно называть эти вещества ключевыми.
Рассмотрим несколько примеров и алгоритм их решения.
ПРИМЕР 1. (указаны все ключевые вещества)
1. Определим степени окисления элементов, чтобы понять, все ли ключевые вещества указаны в схеме:
Степень окисления поменяли сера и бром. Значит, указаны все ключевые вещества.
2. Составим электронный баланс и начнем уравнивать схему:

Br +7 +8е ® Br – 1 1
4K2S – 2 + H2O +1 KBr +7 O4 ® 4S 0 +1 KBr – 1 + …
3. Как видно, в левой части 8 «лишних» атомов калия, следовательно, в правую часть нужно внести КОН
4K2S – 2 + H2O +1 KBr +7 O4 ® 4S 0 +1 KBr – 1 + 8КОН
4. Теперь уравняем водород:
4K2S – 2 +4H2O +1 KBr +7 O4 ® 4S 0 +1 KBr – 1 + 8КОН
5. Сделаем проверку по кислороду. Кислорода слева и справа по 8.
Окончательно решение выглядит так:
4K2S – 2 +4H2O + KBr +7 O4 ® 4S 0 +KBr – 1 + 8КОН

Br +7 +8е ® Br – 1 1
K2S – восстановитель за счет S – 2
KBr +7 O4 – окислитель за счет Br +7
ПРИМЕР 2. (пропущено ключевое вещество справа)
1. Определим степени окисления элементов, чтобы понять, все ли ключевые вещества указаны в схеме:
Степень окисления поменяло железо. Сера, калий и кислород не поменяли степень окисления, хлор в правой части схемы отсутствует. Следовательно, второй элемент, поменявший степень окисления – хлор.
2. Определим роль железа в этой реакции: Fe +2 – 4 е ® Fe +6 – восстановитель, значит хлор будет окислителем, то есть будет принимать электроны и понижать степень окисления.
3. Определим, во что превратится KCl +5 O3, используя материалы занятия 3. Кислородные соединения галогенов восстанавливаются до галогенидов. Значит, продуктом восстановления хлората калия будет хлорид калия.

Fe +2 – 4 е ® Fe +6 3
Cl +5 +6е ® Cl – 1 2
3Fe +2 SO4 + 2KCl +5 O3 + … ® 3K2Fe +6 O4 + 2KCl + K2SO4 + …
5. Уравняем серу:
3Fe +2 SO4 + 2KCl +5 O3 + … ® 3K2Fe +6 O4 + 2KCl + 3K2SO4 + …
6. Теперь мы видим, что калия справа 14 атомов, а слева только 2. Это говорит о том, что в левую часть схемы нужно внести KOH. Внесем и уравняем калий:
3Fe +2 SO4 + 2KCl +5 O3 + 12KOH ® 3K2Fe +6 O4 + 2KCl + 3K2SO4 + …
7. В левой части теперь 12 атомов водорода, а в правой вообще нет, значит, побочным продуктом будет вода, внесем ее формулу в правую часть схемы и уравняем:
3Fe +2 SO4 + 2KCl +5 O3 + 12KOH ® 3K2Fe +6 O4 + 2KCl + 3K2SO4 + 6H2O
8. Осуществим проверку по кислороду: по 30 атомов слева и справа.
Окончательно решение выглядит так:
3Fe +2 SO4 + 2KCl +5 O3 + 12KOH ® 3K2Fe +6 O4 + 2KCl + 3K2SO4 + 6H2O

Cl +5 +6е ® Cl – 1 2
FeSO4 – восстановитель за счет Fe +2
KClO3 – окислитель за счет Cl +5
ПРИМЕР 3. (пропущено ключевое вещество слева)
1. Определим степени окисления элементов, чтобы понять, все ли ключевые вещества указаны в схеме:
Степень окисления поменял марганец. Калий и кислород не поменяли степень окисления, в левой части схемы отсутствуют азот и водород. Скорее всего, второй элемент, поменявший степень окисления – азот.
2. Определим роль марганца в этой реакции: Mn +7 + 3 е ® Mn +4 – окислитель, значит азот будет восстановителем, то есть будет отдавать электроны и повышать степень окисления.
3. Степень окисления азота была ниже 0, а, так как в левой части уравнения нет ещё и водорода, логично предположить, что это водородное соединение азота. Это может быть аммиак или гидразин.
Для начала рассмотрим решение с аммиаком.
4. Составим баланс и начнем уравнивать схему, предварительно внеся аммиак в левую часть схемы:
 |
2N – 3 – 6 е ® N2 0 1
Mn +7 + 3 е ® Mn +4 2
2NH3 + 2KMn +7 O4 ® 1N2 0 + 2Mn +4 O2 + KOH + …
5. Уравняем калий:
2NH3 + 2KMn +7 O4 ® 1N2 0 + 2Mn +4 O2 + 2KOH + …
6. Теперь мы видим, что слева 6 атомов водорода, а справа только 2, слева 8 атомов кислорода, а справа 6, следовательно, побочным продуктом является вода:
2NH3 + 2KMn +7 O4 ® 1N2 0 + 2Mn +4 O2 + 2KOH + 2H2O
Окончательно решение выглядит так:
2NH3 + 2KMn +7 O4 ® N2 0 + 2Mn +4 O2 + 2KOH + 2H2O


Mn +7 + 3 е ® Mn +4 2
NH3 – восстановитель за счет N – 3
KMnO4 – окислитель за счет Mn +7
Второй вариант – с участием гидразина:

Mn +7 + 3 е ® Mn +4 4
3N2 – 2 H4 + 4KMn +7 O4 ® 3N2 0 + 4Mn +4 O2 + 4KOH + 4H2O
N2H4 – восстановитель за счет N – 2
KMnO4 – окислитель за счет Mn +7
ПРИМЕР 4. (пропущены ключевые вещества слева и справа)
1. Определим степени окисления элементов, чтобы понять, все ли ключевые вещества указаны в схеме:
Калий, водород и кислород не поменяли степень окисления, в левой части схемы отсутствует марганец, в правой – азот. Эти элементы и поменяли степень окисления.
2. Определим роль марганца в этой реакции: скорее всего марганец в этой реакции выполняет роль окислителя, в нейтральной среде соединения марганца +7 и +6, выступая окислителями, превращаются в MnO2 . Выберем в качестве окислителя KMnO4. Тогда нитрит будет восстановителем, окислится до нитрата.
3. Запишем схему реакции с выбранными веществами и составим электронный баланс:

N + 3 – 2 е ® N +5 3
Mn +7 + 3 е ® Mn +4 2
4. Уравняем схему:
3KN +3 O2 + 2KMn +7 O4 + H2O ® 2Mn +4 O2 + 2KOH + 3KN +5 O3
KNO2 – восстановитель за счет N + 3
KMnO4 – окислитель за счет Mn +7
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Источник