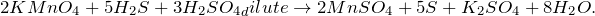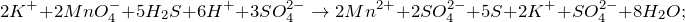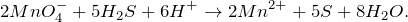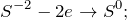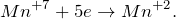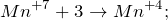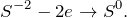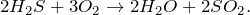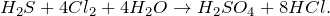KMnO4 + H2S + H2SO4 = ? уравнение реакции
Срочно нужна помощь! Какие продукты образуются в результате окисления сероводорода перманганатом калия в кислой среде, создаваемой серной кислотой (KMnO4 + H2S + H2SO4 = ?)? Запишите молекулярное уравнение реакции. Укажите окислитель и восстановитель. Дайте определение окислительно-восстановительным реакциям. Заранее, большое спасибо!
В результате окисления сероводорода перманганатом калия в кислой среде, создаваемой серной кислотой (KMnO4 + H2S + H2SO4 = ?) происходит образование средних солей сульфатов марганца (II) и калия, воды и выделение серы в чистом виде. Молекулярное уравнение реакции имеет вид:
Запишем ионные уравнения, учитывая, что газообразные, простые вещества и вода на ионы не распадаются, т.е. не диссоциируют.
Первое уравнение называют полным ионным, а второе – сокращенным ионным.
Данная реакция относится к окислительно-восстановительным, поскольку химические элементы сера и марганец изменяют свои степени окисления. Схемы электронного баланса выглядят следующим образом:
Окисление – это отдача электронов веществом, т.е. повышение степени окисление элемента. Вещества, отдающие свои электроны в процессе реакции, называются восстановителями (в данном случае это сероводород).
Восстановление – это смещение электронов к веществу или понижение степени окисления элемента. Вещества, принимающее электроны, называется окислителем (в данном случае это перманганат калия).
Источник
KMnO4 + H2S = ? уравнение реакции
Составьте химическое уравнение по схеме KMnO4 + H2S = ? Расставьте стехиометрические коэффициенты. Запишите молекулярное и ионное уравнения реакции. Охарактеризуйте соединение сероводород: приведите основные физические и химические свойства. Каким образом это вещество получают в лаборатории? А в промышленности?
В результате взаимодействия перманганата калия с сероводородом (KMnO4 + H2S = ?) происходит образование нерастворимых в воде соединений – оксида марганца (IV), серы, а также гидроксида калия и воды. Молекулярное уравнение реакции имеет вид:
Запишем ионные уравнения, учитывая, что вода и простые вещества на ионы не распадаются, т.е. не диссоциируют.
Первое уравнение называют полным ионным, а второе – сокращенным ионным.
Данная реакция относится к окислительно-восстановительным, поскольку химические элементы марганец и сера изменяют свои степени окисления. Схемы электронного баланса выглядят следующим образом:
Сероводород в обычных условиях представляет собой бесцветный газ с характерным запахом гниющего белка. Он немного тяжелее воздуха и горит голубоватым пламенем, образуя диоксид серы и воду:
Сероводород легко воспламеняется; смесь его с воздухом взрывает. Очень ядовит. При 
Сероводород – сильный восстановитель. При действии сильных окислителей он окисляется до диоксида серы или до серной кислоты; глубина окисления зависит от условий: температуры, рН раствора, концентрации окислителя. Например, реакция с хлором обычно протекает до образования серной кислоты:
Средние соли сероводорода называют сульфидами.
При высокой температуре сера взаимодействует с водородом, образуя газ сероводород.
Практически сероводород обычно получают действием разбавленных кислот на сернистые металлы, например на сульфид железа:
Источник
Сероводород
Сероводород
Строение молекулы и физические свойства
Сероводород H2S – это бинарное соединение водорода с серой, относится к летучим водородным соединениям. Следовательно, сероводород бесцветный ядовитый газ, с запахом тухлых яиц. Образуется при гниении. В твердом состоянии имеет молекулярную кристаллическую решетку.
Геометрическая форма молекулы сероводорода похожа на структуру воды — уголковая молекула. Но валентный угол H-S-H меньше, чем угол H-O-H в воде и составляет 92,1 о .
Способы получения сероводорода
1. В лаборатории сероводород получают действием минеральных кислот на сульфиды металлов, расположенных в ряду напряжений левее железа.
Например , при действии соляной кислоты на сульфид железа (II):
FeS + 2HCl → FeCl2 + H2S↑
Еще один способ получения сероводорода – прямой синтез из водорода и серы:
Еще один лабораторный способ получения сероводорода – нагревание парафина с серой.
Видеоопыт получения и обнаружения сероводорода можно посмотреть здесь.
2. Также сероводород образуется при взаимодействии растворимых солей хрома (III) и алюминия с растворимыми сульфидами. Сульфиды хрома (III) и алюминия необратимо гидролизуются в водном растворе.
Например: х лорид хрома (III) реагирует с сульфидом натрия с образованием гидроксида хрома (III), сероводорода и хлорида натрия:
Химические свойства сероводорода
1. В водном растворе сероводород проявляет слабые кислотные свойства. Взаимодействует с сильными основаниями, образуя сульфиды и гидросульфиды:
Например , сероводород реагирует с гидроксидом натрия:
H2S + 2NaOH → Na2S + 2H2O
H2S + NaOH → NaНS + H2O
2. Сероводород H2S – очень сильный восстановитель за счет серы в степени окисления -2. При недостатке кислорода и в растворе H2S окисляется до свободной серы (раствор мутнеет):
В избытке кислорода:
3. Как сильный восстановитель, сероводород легко окисляется под действием окислителей.
Например, бром и хлор окисляют сероводород до молекулярной серы:
H2S + Br2 → 2HBr + S↓
H2S + Cl2 → 2HCl + S↓
Под действием избытка хлора в водном растворе сероводород окисляется до серной кислоты:
Например , азотная кислота окисляет сероводород до молекулярной серы:
При кипячении сера окисляется до серной кислоты:
Прочие окислители окисляют сероводород, как правило, до молекулярной серы.
Например , оксид серы (IV) окисляет сероводород:
Соединения железа (III) также окисляют сероводород:
H2S + 2FeCl3 → 2FeCl2 + S + 2HCl
Бихроматы, хроматы и прочие окислители также окисляют сероводород до молекулярной серы:
Серная кислота окисляет сероводород либо до молекулярной серы:
Либо до оксида серы (IV):
4. Сероводород в растворе реагирует с растворимыми солями тяжелых металлов : меди, серебра, свинца, ртути, образуя черные сульфиды, нерастворимые ни в воде, ни в минеральных кислотах.
Например , сероводород реагирует в растворе с нитратом свинца (II). при этом образуется темно-коричневый (почти черный) осадок, нерастворимый ни в воде, ни в минеральных кислотах:
Взаимодействие с нитратом свинца в растворе – это качественная реакция на сероводород и сульфид-ионы.
Видеоопыт взаимодействия сероводорода с нитратом свинца можно посмотреть здесь.
Источник
Пособие-репетитор по химии
ЗАНЯТИЕ 10
10-й класс (первый год обучения)
Продолжение. Начало см. в № 22/2005; 1, 2, 3, 5, 6, 8, 9, 11/2006
План

2. Процесс окисления, важнейшие восстановители.
3. Процесс восстановления, важнейшие окислители.
4. Окислительно-восстановительная двойственность.
5. Основные типы ОВР (межмолекулярные, внутримолекулярные, диспропорционирование).
7. Методы составления уравнений ОВР (электронный и электронно-ионный баланс).
Все химические реакции по признаку изменения степеней окисления участвующих в них атомов можно разделить на два типа: ОВР (протекающие с изменением степеней окисления) и не ОВР.
Степень окисления – условный заряд атома в молекуле, рассчитанный, исходя из предположения, что в молекуле существуют только ионные связи.
П р а в и л а д л я о п р е д е л е н и я с т е п е н е й о к и с л е н и я
Степень окисления атомов простых веществ равна нулю.
Сумма степеней окисления атомов в сложном веществе (в молекуле) равна нулю.
Степень окисления атомов щелочных металлов +1.
Степень окисления атомов щелочно-земельных металлов +2.
Степень окисления атомов бора, алюминия +3.
Степень окисления атомов водорода +1 (в гидридах щелочных и щелочно-земельных металлов –1).
Степень окисления атомов кислорода –2 (в пероксидах –1).
Любая ОВР представляет собой совокупность процессов отдачи и присоединения электронов.
Процесс отдачи электронов называют окислением. Частицы (атомы, молекулы или ионы), отдающие электроны, называют восстановителями. В результате окисления степень окисления восстановителя увеличивается. Восстановителями могут быть частицы в низшей или промежуточной степенях окисления. Важнейшими восстановителями являются: все металлы в виде простых веществ, особенно активные; C, CO, NH3, PH3, CH4, SiH4, H2S и сульфиды, галогеноводороды и галогениды металлов, гидриды металлов, нитриды и фосфиды металлов.
Процесс присоединения электронов называют восстановлением. Частицы, принимающие электроны, называют окислителями. В результате восстановления степень окисления окислителя уменьшается. Окислителями могут быть частицы в высшей или промежуточной степенях окисления. Важнейшие окислители: простые вещества-неметаллы, обладающие высокой электроотрицательностью (F2, Cl2, O2), перманганат калия, хроматы и дихроматы, азотная кислота и нитраты, концентрированная серная кислота, хлорная кислота и перхлораты.
Вещества, содержащие частицы в промежуточной степени окисления, могут выступать как в роли окислителей, так и в роли восстановителей, т.е. проявляют окислительно-восстановительную двойственность. Это сернистая кислота и сульфиты, хлорноватистая кислота и гипохлориты, пероксиды и др.
Различают три типа окислительно-восстановительных реакций.
Межмолекулярные ОВР – окислитель и восстановитель входят в состав различных веществ, например:
Внутримолекулярные ОВР – окислитель и восстановитель входят в состав одного вещества. Это могут быть разные элементы, например:
или один химический элемент в разных степенях окисления, например:
Диспропорционирование (самоокисление-самовосстановление) – окислителем и восстановителем является один и тот же элемент, находящийся в промежуточной степени окисления, например:
ОВР имеют огромное значение, поскольку большинство реакций, протекающих в природе, относятся к этому типу (процесс фотосинтеза, горение). Кроме того, ОВР активно используются человеком в его практической деятельности (восстановление металлов, синтез аммиака):
Для составления уравнений ОВР можно использовать метод электронного баланса (электронных схем) или метод электронно-ионного баланса.
Метод электронного баланса:
Метод электронно-ионного баланса:
Тест по теме «Окислительно-восстановительные реакции»

а) хромат калия; б) оксид хрома(III);
в) гидроксид хрома(III); г) сульфид хрома(III).
2. Какой продукт реакции между перманганатом калия и бромоводородной кислотой может реагировать с сероводородом?
а) Бром; б) бромид марганца(II);
в) диоксид марганца; г) гидроксид калия.
3. При окислении йодида железа(II) азотной кислотой образуются йод и монооксид азота. Чему равно отношение коэффициента при окислителе к коэффициенту при восстановителе в уравнении этой реакции?
а) 4 : 1; б) 8 : 3; в) 1 : 1; г) 2 : 3.
4. Степень окисления атома углерода в гидрокарбонат-ионе равна:
а) +2; б) –2; в) +4; г) +5.
5. Перманганат калия в нейтральной среде восстанавливается до:
а) марганца; б) оксида марганца(II);
в) оксида марганца(IV); г) манганата калия.
6. Сумма коэффициентов в уравнении реакции диоксида марганца с концентрированной соляной кислотой равна:
а) 14; б) 10; в) 6; г) 9.
7. Из перечисленных соединений только окислительную способность проявляют:
а) серная кислота; б) сернистая кислота;
в) сероводородная кислота; г) сульфат калия.
8. Из перечисленных соединений окислительно-восстановительную двойственность проявляют:
а) пероксид водорода; б) пероксид натрия;
в) сульфит натрия; г) сульфид натрия.
9. Из перечисленных ниже типов реакций окислительно-восстановительными являются реакции:
а) нейтрализации; б) восстановления;
в) диспропорционирования; г) обмена.
10. Степень окисления атома углерода численно не совпадает с его валентностью в веществе:
а) тетрахлорид углерода; б) этан;
в) карбид кальция; г) угарный газ.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| в | а | а | в | в | г | а, г | а, б, в | б, в | б, в |
Упражнения по окислительно-восстановительным реакциям
(электронный и электронно-ионный баланс)

1. Цинк + дихромат калия + серная кислота = сульфат цинка + сульфат хрома(III) + сульфат калия + вода.
2. Сульфат олова(II) + перманганат калия + серная кислота = сульфат олова(IV) + сульфат марганца + сульфат калия + вода.
3. Йодид натрия + перманганат калия + гидроксид калия = йод + манганат калия + гидроксид натрия.
4. Сера + хлорат калия + вода = хлор + сульфат калия + серная кислота.
5. Йодид калия + перманганат калия + серная кислота = сульфат марганца(II) + йод + сульфат калия + вода.
6. Сульфат железа(II) + дихромат калия + серная кислота = сульфат железа(III) + сульфат хрома(III) + сульфат калия + вода.
7. Нитрат аммония = оксид азота(I) + вода.
8. Фосфор + азотная кислота = фосфорная кислота + оксид азота(IV) + вода.
9. Азотистая кислота = азотная кислота + оксид азота(II) + вода.
10. Хлорат калия + соляная кислота = хлор + хлорид калия + вода.
11. Дихромат аммония = азот + оксид хрома(III) + вода.
12. Гидроксид калия + хлор = хлорид калия + хлорат калия + вода.
13. Оксид серы(IV) + бром + вода = серная кислота + бромоводородная кислота.
14. Оксид серы(IV) + сероводород = сера + вода.
15. Сульфит натрия = сульфид натрия + сульфат натрия.
16. Перманганат калия + соляная кислота = хлорид марганца(II) + хлор + хлорид калия + вода.
17. Ацетилен + кислород = углекислый газ + вода.
18. Нитрит калия + перманганат калия + серная кислота = нитрат калия + сульфат марганца(II) + сульфат калия + вода.
19. Кремний + гидроксид калия + вода = силикат калия + водород.
20. Платина + азотная кислота + соляная кислота = хлорид платины(IV) + оксид азота(II) + вода.
21. Сульфид мышьяка + азотная кислота = мышьяковая кислота + сернистый газ + диоксид азота + вода.
22. Перманганат калия = манганат калия + оксид марганца(IV) + кислород.
23. Сульфид меди(I) + кислород + карбонат кальция = оксид меди(II) + сульфит кальция +
+ углекислый газ.
24. Хлорид железа(II) + перманганат калия + соляная кислота = хлорид железа(III) + хлор +
+ хлорид марганца(II) + хлорид калия + вода.
25. Сульфит железа(II) + перманганат калия + серная кислота = сульфат железа(III) + сульфат марганца(II) + сульфат калия + вода.
Ответы на упражнения задания 1

При использовании метода полуреакций (электронно-ионный баланс) следует иметь в виду, что в водных растворах связывание избыточного кислорода и присоединение кислорода восстановителем происходит по-разному в кислой, нейтральной и щелочной средах. В кислых растворах избыток кислорода связывается протонами с образованием молекул воды, а в нейтральных и щелочных – молекулами воды с образованием гидроксид-ионов. Присоединение кислорода восстановителем осуществляется в кислой и нейтральной средах за счет молекул воды с образованием ионов водорода, а в щелочной среде – за счет гидроксид-ионов с образованием молекул воды.
Задание 2. С помощью метода электронно-ионного баланса составить уравнения ОВР, протекающих в определенной среде.
В н е й т р а л ь н о й с р е д е
1. Сульфит натрия + перманганат калия + вода = . .
2. Гидроксид железа(II) + кислород + вода = . .
3. Бромид натрия + перманганат калия + вода = . .
4. Сероводород + бром + вода = серная кислота + . .
5. Нитрат серебра(I) + фосфин + вода = серебро + фосфорная кислота + . .
В щ е л о ч н о й с р е д е
1. Сульфит натрия + перманганат калия + гидроксид калия = . .
2. Бромид калия + хлор + гидроксид калия = бромат калия + . .
3. Сульфат марганца(II) + хлорат калия + гидроксид калия = манганат калия + . .
4. Хлорид хрома(III) + бром + гидроксид калия = хромат калия + . .
5. Оксид марганца(IV) + хлорат калия + гидроксид калия = манганат калия + . .
В к и с л о й с р е д е
1. Сульфит натрия + перманганат калия + серная кислота = . .
2. Нитрит калия + йодид калия + серная кислота = оксид азота (II) + . .
3. Перманганат калия + оксид азота(II) + серная кислота = оксид азота(IV) + . .
4. Йодид калия + бромат калия + соляная кислота = . .
5. Нитрат марганца(II) + оксид свинца(IV) + азотная кислота = марганцовая кислота +
+ . .
Ответы на упражнения задания 2
В н е й т р а л ь н о й с р е д е

Задание 3. С помощью метода электронно-ионного баланса составить уравнения ОВР.
2. Оксид марганца(IV) + кислород + гидроксид калия = манганат калия +. .
3. Сульфат железа(II) + бром + серная кислота = . .
4. Йодид калия + сульфат железа(III) = . .
5. Бромоводород + перманганат калия = . .
6. Хлороводород + оксид хрома(VI) = хлорид хрома(III) + . .
8. Оксид меди(I) + азотная кислота = оксид азота(II) + . .
9. Сульфид калия + манганат калия + вода = сера + . .
10. Оксид азота(IV) + перманганат калия + вода = . .
11. Йодид калия + дихромат калия + серная кислота = . .
12. Сульфид свинца(II) + пероксид водорода = . .
13. Хлорноватистая кислота + пероксид водорода = соляная кислота + . .
14. Йодид калия + пероксид водорода = . .
15. Перманганат калия + пероксид водорода = оксид марганца(IV) + . .
16. Йодид калия + нитрит калия + уксусная кислота = оксид азота(II) + . .
17. Перманганат калия + нитрит калия + серная кислота = . .
18. Сернистая кислота + хлор + вода = серная кислота + . .
19. Сернистая кислота + сероводород = сера + . .
Ответы на упражнения задания 3
Источник