- Летучие водородные соединения
- Строение и физические свойства
- Способы получения силана
- Способы получения аммиака
- Способы получения фосфина
- Способы получения сероводорода
- Химические свойства силана
- Химические свойства фосфина
- Химические свойства сероводорода
- Химические свойства прочих водородных соединений
- Силан (соединение)
- Резюме
- Свойства и реакции
- Производство
- Промышленные методы
- В лабораторном масштабе
- Приложения
- безопасность
Летучие водородные соединения
Соединения водорода с неметаллами — летучие водородные соединения. Это метан, силан, аммиак, фосфин, арсин, сероводород, вода, галогеноводороды. Способы получения и химические свойства.
Строение и физические свойства
Все летучие водородные соединения — газы (кроме воды) при нормальных условиях.
| CH4 — метан | NH3 — аммиак | H2O — вода | HF –фтороводород |
| SiH4 — силан | PH3 — фосфин | H2S — сероводород | HCl –хлороводород |
| AsH3 — арсин | H2Se — селеноводород | HBr –бромоводород | |
| H2Te — теллуроводород | HI –иодоводород |
Способы получения силана
Силан образуется при взаимодействии соляной кислоты с силицидом магния:
Видеоопыт получения силана из силицида магния можно посмотреть здесь.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поск ольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Например , аммиак можно получить нагреванием смеси хлорида аммония и гидроксида кальция. При нагревании смеси происходит образование соли, аммиака и воды:
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
Например , гидролиз нитрида кальция:
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
Процесс проводят при температуре 500-550 о С и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непрореагировавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Способы получения фосфина
В лаборатории фосфин получают водным или кислотным гидролизом фосфидов – бинарных соединений фосфора и металлов.
Например , фосфин образуется при водном гидролизе фосфида кальция:
Или при кислотном гидролизе, например , фосфида магния в соляной кислоте:
Еще один лабораторный способ получения фосфина – диспропорционирование фосфора в щелочах.
Например , фосфор реагирует с гидроксидом калия с образованием гипофосфита калия и фосфина:
Способы получения сероводорода
1. В лаборатории сероводород получают действием минеральных кислот на сульфиды металлов, расположенных в ряду напряжений левее железа.
Например , при действии соляной кислоты на сульфид железа (II):
FeS + 2HCl → FeCl2 + H2S↑
Еще один способ получения сероводорода – прямой синтез из водорода и серы:
Еще один лабораторный способ получения сероводорода – нагревание парафина с серой.
Видеоопыт получения и обнаружения сероводорода можно посмотреть здесь.
2. Также сероводород образуется при взаимодействии растворимых солей хрома (III) и алюминия с растворимыми сульфидами. Сульфиды хрома (III) и алюминия необратимо гидролизуются в водном растворе.
Например: х лорид хрома (III) реагирует с сульфидом натрия с образованием гидроксида хрома (III), сероводорода и хлорида натрия:
Химические свойства силана
1. Силан — неустойчивое водородное соединение (самовоспламеняется на воздухе). При сгорании силана на воздухе образуется оксид кремния (IV) и вода:
Видеоопыт сгорания силана можно посмотреть здесь.
2. Силан разлагается водой с выделением водорода:
3. Силан разлагается (окисляется) щелочами :
4. Силан при нагревании разлагается :
Химические свойства фосфина
1. В водном растворе фосфин проявляет очень слабые основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H + ), он превращается в ион фосфония. Основные свойства фосфина гораздо слабее основных свойств аммиака. Проявляются при взаимодействии с безводными кислотами .
Например , фосфин реагирует с йодоводородной кислотой:
Соли фосфония неустойчивые, легко гидролизуются.
2. Фосфин PH3 – сильный восстановитель за счет фосфора в степени окисления -3. На воздухе самопроизвольно самовоспламеняется:
3. Как сильный восстановитель, фосфин легко окисляется под действием окислителей.
Например , азотная кислота окисляет фосфин. При этом фосфор переходит в степень окисления +5 и образует фосфорную кислоту.
Серная кислота также окисляет фосфин:
С фосфином также реагируют другие соединения фосфора, с более высокими степенями окисления фосфора.
Например , хлорид фосфора (III) окисляет фосфин:
2PH3 + 2PCl3 → 4P + 6HCl
Химические свойства сероводорода
1. В водном растворе сероводород проявляет слабые кислотные свойства. Взаимодействует с сильными основаниями, образуя сульфиды и гидросульфиды:
Например , сероводород реагирует с гидроксидом натрия:
H2S + 2NaOH → Na2S + 2H2O
H2S + NaOH → NaНS + H2O
2. Сероводород H2S – очень сильный восстановитель за счет серы в степени окисления -2. При недостатке кислорода и в растворе H2S окисляется до свободной серы (раствор мутнеет):
В избытке кислорода:
3. Как сильный восстановитель, сероводород легко окисляется под действием окислителей.
Например, бром и хлор окисляют сероводород до молекулярной серы:
H2S + Br2 → 2HBr + S↓
H2S + Cl2 → 2HCl + S↓
Под действием избытка хлора в водном растворе сероводород окисляется до серной кислоты:
Например , азотная кислота окисляет сероводород до молекулярной серы:
При кипячении сера окисляется до серной кислоты:
Прочие окислители окисляют сероводород, как правило, до молекулярной серы.
Например , оксид серы (IV) окисляет сероводород:
Соединения железа (III) также окисляют сероводород:
H2S + 2FeCl3 → 2FeCl2 + S + 2HCl
Бихроматы, хроматы и прочие окислители также окисляют сероводород до молекулярной серы:
Серная кислота окисляет сероводород либо до молекулярной серы:
Либо до оксида серы (IV):
4. Сероводород в растворе реагирует с растворимыми солями тяжелых металлов : меди, серебра, свинца, ртути, образуя черные сульфиды, нерастворимые ни в воде, ни в минеральных кислотах.
Например , сероводород реагирует в растворе с нитратом свинца (II). при этом образуется темно-коричневый (почти черный) осадок, нерастворимый ни в воде, ни в минеральных кислотах:
Взаимодействие с нитратом свинца в растворе – это качественная реакция на сероводород и сульфид-ионы.
Видеоопыт взаимодействия сероводорода с нитратом свинца можно посмотреть здесь.
Химические свойства прочих водородных соединений
Кислоты образуют в водном растворе: водородные соединения VIA (кроме воды) и VIIA подгрупп.
Прочитать про химические свойства галогеноводородов вы можете здесь.
Источник
Силан (соединение)
| Силан | |
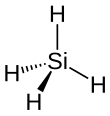  | |
| Структура силана. | |
| Идентификация | |
|---|---|
| Название ИЮПАК | силан |
| Синонимы | |
| Н о CAS | 7803-62-5 |
| N о ИК | 100 029 331 |
| N о ЕС | 232-263-4 |
| N о RTECS | VV1400000 |
| PubChem | 23953 |
| ЧЭБИ | 29389 |
| Улыбки | |
| Появление | бесцветный пирофорный газ с неприятным запахом |
| Химические свойства | |
| Грубая формула | H 4 Si SiH 4 |
| Молярная масса | 32,1173 ± 0,0006 г / моль H 12,55%, Si 87,45%, |
| Физические свойства | |
| Т ° плавления | −185 ° С |
| T ° кипения | -112 ° С |
| Растворимость | S’ гидролиза быстро в воде |
| Объемная масса | 1,44 кг / м 3 при 0 ° C |
| Пределы взрываемости в воздухе | 1,4% к объему, 19 г / м 3 |
| Давление насыщающего пара | 29 бар при −22 ° C 40,8 бар при −10 ° C 48 бар при −3,5 ° C |
| Критическая точка | 0,242 г / см 3 при -3,5 ° C при 48,4 бар |
| Тройная точка | −186,4 ° С |
| Термохимия | |
| Δ vap H ° | 12,1 кДж · моль -1 ( 1 атм , -111,9 ° C ) |
| Электронные свойства | |
| 1 повторно энергия ионизации | 11,00 ± 0,02 эВ (газ) |
| Меры предосторожности | |
| SGH | |
| Раскрытие на уровне 1,0% в соответствии со списком раскрытия ингредиентов | |
| Единицы СИ и СТП, если не указано иное. | |
редактировать  | |
Силан представляет собой химическое соединение по формуле SiH 4 . Он выглядит как бесцветный пирофорный газ с отталкивающим запахом. Кремний аналог из CH 4 метана , это простейший из гидридов кремния и простейшее из соединений ряда силана общей формулы Si n H 2 n +2 , которые сами по себе являются кремниевыми аналогами C n H 2 n +2 алканов .
В более широком смысле, мы также можем говорить о силанах для обозначения различных замещенных производных силана, таких как тетраметилортосиликат Si (OCH 3 ) 4. , тетраэтилортосиликат Si (OCH 2 CH 3 ) 4 или трихлорсилан SiHCl 3 , или кремнийорганические соединения, такие как диметилсиландиол Si (OH) 2 (CH 3 ) 2 или тетраметилсилан Si (CH 3 ) 4 .
Резюме
Свойства и реакции
Так как водород является более электроотрицательным , чем кремний (2,2 против 1,9 на шкале Полинга ), то поляризация из Si — Н связи является противоположностью , что из C — H связи (электроотрицательность углерода . Составляет 2,55 по шкале Полинга) . Это имеет несколько последствий, в частности, склонность силана к образованию комплексов с переходными металлами или тот факт, что он самовоспламеняется на воздухе без необходимости воспламенения (он пирофорен ). Данные продукты сгорания силан, однако , часто противоречат друг другу , потому что сам силан достаточно стабилен , а его воспламеняемость будет обусловлено главным образом наличием примесей , таких как образование высших силанов в процессе ее производства, в присутствии следов влаги. И по каталитических эффектов из поверхность емкостей, в которых он находится.
Уменьшение силана с помощью щелочного металла , растворенного в растворителе , дает производную силильное соответствующую щелочь. В зависимости от растворителя могут иметь место две конкурирующие реакции, например, только первая реакция в гексаметилфосфорамиде [(CH 3 ) 2 N] 3 PO. (HMPA) и оба одновременно в диметоксиэтане CH 3 OCH 2 CH 2 OCH 3 , например, здесь с калием дает силанид калия KSiH 3 :
Энергия Si — Н связи составляет около 384 кДж / моль , что составляет около 20% меньше , чем у Н — Н — связи в водородной молекулы Н 2. . Отсюда следует, что соединения, содержащие такие связи Si — H, более реакционноспособны, чем H 2. . Энергия Si — Н — связи мало влияет наличие заместителей на атоме кремния: это , таким образом , составит 419 кДж / моль для trifluorosilane SIHF 3 , 382 кДж / моль для трихлорсилана SiHCl 3 и 398 кДж / моль для триметилсилана SiH (CH 3 ) 3 .
Силан — сильный восстановитель, который горит в кислороде , взрывается в хлоре и быстро гидролизуется в щелочной воде ( pH > 7 ) в соответствии с реакциями:
С другой стороны, реакция с чистой водой протекает очень медленно: ей способствует присутствие основных следов или сильной кислоты .
Производство
Промышленные методы
Силан синтезируют несколькими методами. Обычно образуется при реакции хлороводорода HCl с силицидом магния Mg 2 Si. :
Его также можно получить из металлургического кремния в два этапа. Кремний сначала обрабатывают хлористым водородом при температуре около 300 ° C для получения трихлорсилана SiHCl 3. с водородом H 2 :
Затем трихлорсилан превращается в смесь кремния и тетрахлорида кремния SiCl 4. в присутствии катализатора :
Наиболее часто используемыми катализаторами в этом процессе являются галогениды металлов , особенно хлорид алюминия AlCl 3. . Это перераспределение , которое также можно рассматривать как диспропорционирование, хотя степень окисления кремния не меняется (это +4 для силана, трихлорсилана и тетрахлорида кремния); однако, поскольку хлор более электроотрицателен, чем водород (3,16 против 2,2 по шкале Полинга ), атом кремния SiCl 4 проявляет более высокую формальную степень окисления, чем SiH 4 .
Альтернативный способ производства относится к силану очень высокой чистоты, предназначенному для производства кремния электронного качества для полупроводниковой промышленности . В этом процессе также используется металлургический кремний, а также четыреххлористый водород и кремний. Он включает в себя серию перераспределений с побочными продуктами, которые рециркулируют в реакциях и дистилляциях , которые можно резюмировать следующим образом:
Образованный таким образом силан можно термически разложить с получением кремния и водорода высокой чистоты за один проход .
Другие методы производства силана включают восстановление тетрафторида кремния SiF 4. с помощью гидрида натрия NaH или восстановления тетрахлорида кремния SiCl 4 от лития алюминия гидрид LiAlH 4 . Также возможно восстановление диоксида кремния SiO 2. под алюминия путем водорода H 2 в смеси хлорида натрия NaCl и хлорида алюминия AlCl 3 при высоком давлении:
В лабораторном масштабе
Немецкие химики Генрих Бафф и Фридрих Вёлер обнаружили в 1857 году силан среди других продуктов, образующихся при взаимодействии соляной кислоты HCl с силицидом алюминия Al 4 Si 3. ; они назвали это соединение силицидом водорода .
Для демонстрации в классе силан можно получить путем нагревания смеси песка и порошка магния с получением силицида магния Mg 2 Si. , который затем можно вылить в соляную кислоту. Силицид магния реагирует с кислотой с образованием силана SiH 4. , который образует пузырьки, которые поднимаются на поверхность и самопроизвольно воспламеняются при контакте с воздухом за счет пирофорности , что свидетельствует о треске небольших взрывов. Мы можем рассмотреть эту реакцию в виде гетерогенной реакции кислотно-щелочной постольку , поскольку силицид анион Si 4- из антифлю- структуры (о) из Mg 2 Si может служить базой Бренстеда, принимающей четыре протона .
Наконец, способ производства силана в малых масштабах состоит из реакции амальгамы натрия с дихлорсиланом SiH 2 Cl 2. , что дает, помимо силана, полимеризованные гидриды кремния (SiH) x .
Приложения
В то время как органосиланы имеют различные приложения, сам силан используется почти исключительно в качестве предшественника из чистого кремния , в частности , для полупроводниковой промышленности . Производство недорогих фотоэлектрических солнечных модулей привело к значительному потреблению силана для осаждения гидрогенизированного аморфного кремния (a-Si: H) с помощью плазменного химического осаждения из паровой фазы ( PECVD ) на различные подложки, такие как стекло , кристаллы, металлы или пластмассы. .
Осаждение кремния с помощью PECVD относительно неэффективно, поскольку используется только около 15% силана, остальное теряется. Для повышения эффективности процесса и уменьшения воздействия на окружающую среду были разработаны различные методы рециркуляции .
безопасность
Поскольку силан пирофорен , утечки этого газа воспламеняются самопроизвольно, поэтому на заводах происходит много несчастных случаев со смертельным исходом в результате пожаров и взрывов. Сгорания силана при низкой концентрации будет происходить в два этапа, с окислением из водорода , происходящих после образования диоксида кремния , тем конденсации , которые бы ускорить образование воды под действием тепловой обратной связи . Силан, разбавленный инертными газами, такими как азот или аргон, с большей вероятностью воспламеняется на воздухе, чем чистый силан: даже смесь 1% силана в чистом азоте легко воспламеняется. Разбавление силана в водороде позволяет снизить промышленные риски при производстве солнечных элементов из аморфного кремния, а также имеет преимущество в стабилизации фотоэлектрических солнечных модулей, полученных таким образом, путем ограничения эффекта Штеблера-Вронски ( WSE ).
Источник


---No%2C1_%E3%80%90_Pictures_taken_in_Japan_%E3%80%91.jpg/220px-Container_%E3%80%90_28T9_%E3%80%91_SINU_212002(1)---No%2C1_%E3%80%90_Pictures_taken_in_Japan_%E3%80%91.jpg)



