Na2SiO3 + CO2 = ? уравнение реакции
Расставьте коэффициенты преобразовав схему Na2SiO3 + CO2 = ? в уравнение реакции. Охарактеризуйте твердый продукт реакции: приведите его основные физические и химические свойства, а также другие способы получения.
В результате взаимодействия метасиликата натрия с диоксидом углерода (Na2SiO3 + CO2 = ?) происходит образование аморфного оксида кремния (IV) и карбоната натрия. Молекулярное уравнение реакции имеет вид:
Запишем ионные уравнения, учитывая, что оксиды на ионы не распадается, т.е. не диссоциирует.
Первое уравнение называют полным ионным, а второе – сокращенным ионным.
Кристаллический диоксид кремния находится в природе главным образом в виде минерала кварца. Прозрачные, бесцветные кристаллы кварца, имеющие форму шестигранных призм с шестигранными пирамидами на концах, называются горным хрусталем. Горный хрусталь, окрашенный примесями в лиловый цвет, называется аметистом, а в буроватый – дымчатым топазом.
Кристаллический диоксид кремния очень тверд, нерастворим в воде и плавится около 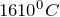
Диоксид кремния – кислотный оксид. Ему соответствуют слабые малорастворимые в воде кремниевые кислоты. Их можно представить общей формулой 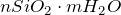
Соли кремниевых кислоты – силикаты – в большинстве своем нерастворимы в воде; растворимы лишь силикаты натрия и калия. Они получаются при сплавлении диоксида кремния с едкими щелочами или карбонатами калия и натрия, например:
Источник
Силикат натрия вода сернистый газ
Ключевые слова конспекта: соединения серы, сернистый газ, сульфаты, строение, получение, использование.
Оксид серы (IV) — сернистый газ
Оксид серы (IV) SO2 – вещество молекулярного строения, молекула имеет угловую конфигурацию.
При обычных условиях оксид серы (IV) SO2 – бесцветный газ с удушливым запахом, растворим в воде (1 объём воды при комнатной температуре растворяет 36 объёмов SO2).
Оксид серы (IV) SO2 – кислотный оксид.
- Взаимодействует с водой, образуя сернистую кислоту (слабый электролит):
В водном растворе она ступенчато диссоциирует:
Наличие ионов водорода обусловливает изменение окраски индикатора. Например, при пропускании сернистого газа через раствор лакмуса окраска меняется с фиолетовой на красную.
- Реагирует с основаниями и основными оксидами. В реакциях могут образовываться как средние соли, так и кислые соли (гидросульфиты). Например:
SO2 + 2КОН = K2SO3 + H2О или SO2 + КОН = KHSO3
Так как в SO2 степень окисления серы промежуточная +4, для диоксида серы характерна окислительно-восстановительная двойственность. В реакциях с более сильными восстановителями SO2 – окислитель:
А в реакциях с более сильными окислителями SO2 – восстановитель:
В промышленности сернистый газ получают при обжиге пирита (FeS2) и других сульфидов:
или сжиганием серы в кислороде: S + O2 = SO2
В лаборатории сернистый газ получают действием сильных кислот на сульфиты. Обычно используют концентрированную H2SO4 и твёрдый сульфит натрия Na2SO3:
Сульфаты
Сульфаты – соли серной кислоты. Серная кислота образует два ряда солей: средние (содержат сульфат–ион SO4 2– ) и кислые (содержат гидросульфат-ион HSO4 – ).
Сульфаты можно рассматривать как ионные соединения, в узлах кристаллической решётки – катионы металлов и сульфат-анионы.
Сульфаты – твёрдые кристаллические вещества. Большинство сульфатов бесцветны, но окраска может быть обусловлена наличием того или иного катиона (например, медный купорос – кристаллы синего цвета, железный купорос – кристаллы светло–зелёного цвета и т. п.). Растворимость сульфатов в воде различна. Часто сульфаты кристаллизуются в виде кристаллогидратов.
Для распознавания сульфатов можно воспользоваться качественной реакцией на сульфат-ион. Реагентом является растворимая соль бария Ba(NO3)2, ВаCl2, (СН3СОО)2Ва. При взаимодействии реагента с раствором сульфата выпадает белый кристаллический осадок:
Наиболее распространёнными сульфатами являются:
Конспект урока «Соединения серы: сернистый газ и сульфаты».
Источник
Тренировочный вариант №30.
Ответом к заданиям 1–26 является последовательность цифр. Ответ запишите в поле ответа в тексте работы, а затем перенесите в БЛАНК ОТВЕТОВ № 1 справа от номера соответствующего задания, начиная с первой клеточки. Последовательность цифр записывайте без пробелов, запятых и других дополнительных символов. Каждый символ пишите в отдельной клеточке в соответствии с приведёнными в бланке образцами.
Цифры в ответах на задания 5, 8, 9, 11, 16, 17, 21–26 могут повторяться.
Из указанных в ряду химических элементов выберите два элемента, число валентных электронов у которых совпадает с числом полностью заполненных подуровней:
Запишите в поле ответа номера выбранных элементов.
Из предложенного перечня выберите три элемента, неспособных образовывать оксиды. Расположите выбранные элементы в порядке уменьшения атомного радиуса.
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Из предложенного перечня химических элементов выберите два таких, которые могут иметь одинаковые степени окисления в образованных ими анионах с общей формулой ЭОх — .
Запишите в поле ответа номера выбранных элементов.
Из предложенного перечня выберите два соединения, имеющих немолекулярное строение, ковалентные связи в которых образованы только по обменному механизму.
Запишите номера выбранных ответов.
Установите соответствие между парой веществ и классами/группами, к которым эти вещества соответственно принадлежат: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВА | КЛАССЫ/ГРУППЫ |
| А) K[Al(OH)4], PO(OH)3 Б) Al(OH)3, Zn(OH)2 В) Fe(OH)SO4, Sr(OH)2 | 1) соль, основание 2) два основания 3) амфотерный гидроксид, основание 4) два амфотерных гидроксида 5) соль, кислота 6) соль, амфотерный гидроксид |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Из приведенного перечня выберите два вещества, с которыми при определенных условиях может взаимодействовать оксид углерода(IV).
Запишите номера выбранных ответов.
При пропускании сероводорода с пробирку с раствором вещества Х наблюдали образование осадка, растворимого в горячем растворе щелочи. При пропускании сероводорода в пробирку с раствором вещества Y наблюдали образование осадка, нерастворимого в щелочах и концентрированной соляной кислоте. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
Запишите номера выбранных веществ под соответствующими буквами.
Установите соответствие между реагентом и веществами, с каждым из которых этот реагент может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
А) азотная кислота (разб.)
Б) сернистый газ
В) гидроксид алюминия
Г) карбонат кальция (взвесь в воде)
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между схемой реакции и продуктами этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СХЕМА РЕАКЦИИ | ПРОДУКТЫ РЕАКЦИИ | |||||||||||||||||||||
| НАЗВАНИЕ УГЛЕВОДОРОДА | ФОРМУЛА СОЕДИНЕНИЯ | |||||||||||||||
| СОЕДИНЕНИЕ | ФОРМУЛА ПРОДУКТА |
| А) этиленгликоль Б) бензойная кислота В) бензальдегид Г) пропанол-1 | 1) C4H7O3 2) C8H8O2 3) C4H6O4 4) C6H14O 5) C7H8O 6) C6H8O2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) изопропиловый спирт
2) формальдегид
3) этанол
4) ацетон
5) метанол
6) ацетальдегид
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Из предложенного перечня реакции выберите все, относящиеся к окислительно-восстановительным и в результате протекания которых образуется простое вещество.
1) взаимодействие хлорида железа(III) и сульфида натрия
2) разложение дихромата аммония при сильном нагревании
3) взаимодействие твердого хлорида аммония и концентрированной серной кислоты
4) взаимодействие горячих растворов сульфата аммония и нитрита калия
5) взаимодействие растворов сульфата меди(II) и йодида калия
Запишите номера выбранных ответов.
Из предложенного перечня реакций выберите все, которые можно замедлить как охлаждением, так и увеличением объема реакционного сосуда.
1) окисление меди азотной кислотой
2) взаимодействие сероводорода и сернистого газа
3) нитрование бензола
4) электролиз раствора хлорида калия
5) нитрование этана
Запишите номера выбранных ответов.
Установите соответствие между выделенным символом химического элемента в формуле вещества и окислительно-восстановительными свойствами, которые данный химический элемент в этом веществе может проявлять: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Б) HCHO
В) Ca(ClO)Cl
1) не проявляет окислительно-восстановительных свойств
2) может быть только восстановителем
3) может быть как окислителем, так и восстановителем
4) может быть только окислителем
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между названием соли и веществами, которые будут находиться в околоанодном пространстве после израсходования всей соли на реакцию электролиза ее водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СОЛИ | ВЕЩЕСТВА В ОКОЛОАНОДНОМ ПРОСТРАНСТВЕ |
| А) хлорид калия Б) нитрат меди(II) В) ацетат натрия Г) фторид серебра | 1) кислота + кислота 2) вода 3) кислота + щелочь 4) щелочь + вода 5) соль + вода 6) кислота + вода |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между смесью солей и окраской лакмуса в растворе, содержащем эти соли: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
1) синий
2) красный
3) малиновый
4) фиолетовый
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между способом воздействия на равновесную систему
и смещением химического равновесия в результате этого воздействия. К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой..
| ВОЗДЕЙСТВИЕ НА СИСТЕМУ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ | ||||||||
| А) добавление щелочи Б) добавление соляной кислоты В) интенсивное перемешивание раствора Г) сильное разбавление дистиллированной водой |
| РЕАГЕНТЫ | ПРИЗНАК РЕАКЦИИ |
| А) силикат калия(р-р) и углекислый газ Б) аммиак и перхлорат железа (III)(р-р) В) рыбий жир и бромная вода Г) пероксид водорода и сульфит калия(р-р) | 1) поглощение газа 2) образование черного осадка 3) поглощение газа и образование осадка 4) нет видимых признаков 5) обесцвечивание раствора |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между веществом и областью его применения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | ОБЛАСТЬ ПРИМЕНЕНИЯ |
| А) глицерин Б) этиленгликоль В) лимонная кислота | 1) производство метанола 2) компонент антифризов 3) пищевая промышленность 4) производство серной кислоты |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Ответом к заданиям 27–29 является число. Запишите это число в поле ответа в тексте работы, соблюдая при этом указанную степень точности. Затем перенесите это число в БЛАНК ОТВЕТОВ № 1 справа от номера соответствующего задания, начиная с первой клеточки. Каждый символ пишите в отдельной клеточке в соответствии с приведёнными в бланке образцами. Единицы измерения физических величин в бланке ответа указывать не нужно.
В результате упаривания 200 г 10%-ного раствора нитрата калия масса раствора уменьшилась на 15%. Какую массу 25%-ного раствора нитрата калия (в граммах) необходимо добавить к полученному в результате упаривания раствору для получения раствора с массовой долей соли равной 20%? (Запишите число с точностью до целых).
При нейтрализации 49 г неизвестной кислоты раствором щелочи при определенных условиях выделяется 48 кДж теплоты. Вычислите количество теплоты, выделяющееся при нейтрализации 9,8 г данной кислоты в тех же условиях. (Запишите ответ с точностью до десятых)
Вычислите минимальную массу (в граммах) порошка алюминия, необходимую для полного восстановления в щелочном растворе 1,515 г нитрата калия. Считать, что реакция протекает с выходом 100%. (Запишите число с точностью до сотых.)
Не забудьте перенести все ответы в бланк ответов № 1 в соответствии с инструкцией по выполнению работы. Проверьте, чтобы каждый ответ был записан в строке с номером соответствующего задания.
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
гидроксид бария, нитрат калия, сера, гидрофосфат аммония, оксид хрома(III), азотная кислота.
Из предложенного перечня веществ выберите такие, окислительно-восстановительная реакция между которыми протекает с образованием нерастворимого в воде соединения желтого цвета. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Из предложенного перечня веществ выберите два таких, реакция ионного обмена между которыми может сопровождаться образованием раствора, практически не содержащего сильных электролитов. Запишите молекулярное, полное и сокращенное ионное уравнения данной реакции с участием выбранных веществ.
Сернистый газ пропустили через трубку с пероксидом натрия. Содержимое трубки растворили в воде с образованием нейтрального раствора, который подвергли электролизу. Образовавшийся раствор нагрели до кипения и внесли последовательно навеску питьевой соды, затем сульфат алюминия. Напишите уравнения четырех описанных реакций.
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
В стакан с 26%-ным раствором хлорида железа (III) внесли навеску железной стружки и нагревали некоторое время. В момент, когда количество ионов Fe 2+ стало равно 0,24 моль, остаток стружки отделили от раствора магнитной сепарацией. В образовавшийся раствор пропустили газообразный хлор до момента, когда отношение количеств ионов Fe 2+ и Fe 3+ стало равно 1:4. Отделенную ранее железную стружку смешали с дополнительным количеством железа и внесли в полученный раствор. После образования однородного раствора без осадка добавили 260 г раствора сульфида калия. Образовавшийся при этом осадок представлял собой единственное соединение, а раствор над осадком имел нейтральную среду. Вычислите массовую долю воды в конечном растворе, если известно, что всего в ходе эксперимента использовали 13,44 г железной стружки. Испарением воды в ходе всех процессов пренебречь.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
При полном сгорании неизвестного органического соединения А массой 1,98 г образовалось 2,016 л углекислого газа (н.у.) и 1,62 г воды. Известно, что в молекуле данного соединения все атомы углерода находятся в состоянии sp 3 -гибридизации, а также то, что молекула вещества А содержит в своем составе в два раз больше атомов углерода, чем молекула вещества Б — продукта окисления некоторого алкена раствором перманганата калия.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение получения А из вещества Б.
Ответы к первой части варианта №30
1)35
2) 521
3) 24
4) 25
5) 541
6) 35
7) 53
8) 6412
9) 6252
10) 53
11) 555
12) 24
13) 25
14) 24
15) 34
17) 3254
18) 52
19) 1245
20) 25
21) 433
22) 2626
23) 1222
24) 1232
25) 3354
26) 323
27) 280
28) 9,6
29) 1,08
Ответы ко второй части варианта №30
Задание №30
хром в степени окисления +3 (или оксид хрома (III)) является восстановителем;
азот в степени окисления +5 (или нитрат калия) – окислителем.
Задание 31
3Ba 2+ + 6OH — + 4NH4 + + 2HPO4 2- = Ba3(PO4)2 + 4NH3 + 6H2O (сокращенное ионное уравнение совпадает с полным ионным)
Задание 32
Задание 33
Задание 34
В стакан с 26%-ным раствором хлорида железа (III) внесли навеску железной стружки и нагревали некоторое время. В момент, когда количество ионов Fe 2+ стало равно 0,24 моль, остаток стружки отделили от раствора магнитной сепарацией. В образовавшийся раствор пропустили газообразный хлор до момента, когда отношение количеств ионов Fe 2+ и Fe 3+ стало равно 1:4. Отделенную ранее железную стружку смешали с дополнительным количеством железа и внесли в полученный раствор. После образования однородного раствора без осадка добавили 260 г раствора сульфида калия. Образовавшийся при этом осадок представлял собой единственное соединение, а раствор над осадком имел нейтральную среду. Вычислите массовую долю воды в конечном растворе, если известно, что всего в ходе эксперимента использовали 13,44 г железной стружки. Испарением воды в ходе всех процессов пренебречь.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение:
Вычислим количество железа, которое израсходовали в ходе реакций:
n(Fe общ.) = m(Fe)/M(Fe) = 13,44/56 = 0,24 моль
Поскольку нам известно количество образовавшейся соли железа (II) в первой реакции, справедливы будут следующие записи:
n(Fe реакция I) = n(FeCl2)/3 = 0,24/3 = 0,08 моль
n(Fe реакция III) = n(Fe общ.) — n(Fe реакция I) = 0,24 — 0,08 = 0,16 моль
n(FeCl3 реакция III) = 2n(Fe 3 реакция) = 0,32 моль
n(FeCl2 после доб. хлора) = n(FeCl3 реакция III)/4 = 0,32/4 = 0,08 моль
Поскольку было 0,24 моль соли железа (II), а осталось 0,08 моль, можно сказать, что из нее получилось 0,16 моль соли железа (III). Тогда изначально было 0,32 моль соли железа (III). Вычислим его массу и массу раствора:
m(FeCl3 исх.) = n(FeCl3 исх.)·M(FeCl3) = 0,32·162,5 = 52 г
m(р-ра FeCl3) = m(FeCl3 исх.)/ω(FeCl3)·100% = 52/0,26·100% = 200 г
Общее количество соли железа (II), которое вступило в реакцию с сульфидом натрия:
n(FeCl2 конечн.) = n(Fe общ.) + n(FeCl3 исх.) = 0,24 + 0,32 = 0,56 моль
Далее вычислим количества и массы хлора и сульфида железа (II):
n(Cl2) = n(FeCl3 реакция II)/2 = 0,16/2 = 0,08 моль
m(Cl2) = n(Cl2)·M(Cl2) = 0,08·71 = 5,68 г
n(FeS) = n(FeCl2 конечн.) = 0,56 моль
m(FeS) = n(FeS)·M(FeS) = 0,56·88 = 49,28 г
Масса конечного раствора сложится из масс металлического железа, хлора, растворов хлорида железа (III) и сульфида калия за вычетом сульфида железа (II). Проведем необходимые вычисления:
m(р-ра конечн.) = m(р-ра FeCl3) + m(р-ра K2S) + m(Fe) + m(Cl2) — m(FeS) = 200 + 260 + 13,44 + 5,68 — 49,28 = 429,84 г
В конечном растворе, исходя из описания, содержится только хлорид калия, поэтому массу воды можно получить по разности масс конечного раствора и хлорида калия. Проведем необходимые вычисления:
n(KCl) = 2n(FeCl2 конечн.) = 0,56·2 = 1,12 моль
m(KCl) = n(KCl)·M(KCl) = 1,12·74,5 = 83,44 г
m(Н2О) = m(р-ра конечн.) — m(KCl) = 429,84 — 83,44 = 346,4 г
Вычислим массовую долю воды в конечном растворе:
ω(Н2О) = m(Н2О)/m(р-ра конечн.)·100% = 346,4/429,84·100% = 80,6%
Задание 35
При полном сгорании неизвестного органического соединения А массой 1,98 г образовалось 2,016 л углекислого газа (н.у.) и 1,62 г воды. Известно, что в молекуле данного соединения все атомы углерода находятся в состоянии sp 3 -гибридизации, а получить его можно в одну стадию из вещества Б — продукта окисления некоторого алкена раствором перманганата калия. Также известно то, что молекула вещества А содержит в два раза больше атомов углерода, чем молекула вещества Б.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение получения А из вещества Б.
Решение:
n(CO2) = V/Vm = 2,016/22,4 = 0,09 моль, следовательно, n(C) = n(CO2) = 0,9 моль, тогда, m(C) = n·M = 0,09·12 = 1,08 г,
n(H2O) = m/M = 1,62/18 = 0,09 моль, следовательно, n(H) = 2n(H2O) = 2·0,09 = 0,18 моль, тогда m(H) = n·M = 0,18·1 = 0,18 г.
Проверим содержит ли искомое вещество кислород:
m(O) = m(в-ва) — m(C) — m(H) = 1,98 г — 1,08 г — 0,18 г = 0,72 г.
Как видим, m(O) не равно нулю, значит в состав искомого вещества входит кислород. Рассчитаем количество вещества кислорода в указанной в условии порции вещества:
n(O) = m(O)/M(O) = 0,72/16 = 0,045 моль.
Найдем простейшую формулу вещества:
n(C) : n(H) : n(O) = 0,09 : 0,18 : 0,045 = (0,09/0,045) : (0,18/0,045) : (0,045/0,045) = 2 : 4 : 1
Таким образом, простейшая формула искомого вещества А — C2H4O.
Предположим, что простейшая формула совпадает с истинной молекулярной.
Тогда искомым веществом А могли бы оказаться либо ацетальдегид, либо этиленоксид, однако, ни то, ни другое вещество не может быть получено из вещества с одним атомом углерода в молекуле, которое еще при этом было бы продуктом окисления раствором перманганата калия некоторого алкена (напомним, что по условию молекула вещества А содержит в два раза больше атомов углерода, чем молекула вещества Б).
Тогда удвоим простейшую формулу, получим C4H8O2.
Предположим, что истинная молекулярная формула совпадает с удвоенной.
Тогда, для в качестве решения подходит структура циклического простой эфира — диоксана:
Диоксан удовлетворяет всем требованиям задачи: может быть получен в одну стадию дегидратацией этилегликоля (вещества Б с вдвое меньшим числом атомов углерода в молекуле), а этиленгликоль (вещество Б) в свою очередь может быть получен в одну стадию из этилена его окислением нейтральным холодным раствором перманганата калия.
Таким образом:
1) молекулярная формула вещества A — C4H8O2
2) структурная формула вещества А:
3) уравнение получения вещества А из вещества Б:
Источник












