- Силицид натрия плюс вода
- Кремний. Химия кремния и его соединений
- Кремний
- Положение в периодической системе химических элементов
- Электронное строение кремния
- Физические свойства, способы получения и нахождение в природе кремния
- Качественные реакции
- Соединения кремния
- Способы получения кремния
- Химические свойства
- Бинарные соединения кремния
- Силициды металлов
- Силан
- Карбид кремния
- Галогениды кремния
- Оксид кремния (IV)
- Физические свойства и нахождение в природе
- Химические свойства
- Кремниевая кислота
- Строение молекулы и физические свойства
- Способы получения
- Химические свойства
- Силикаты
Силицид натрия плюс вода
Электрический велосипед Pedego ездит на воде с порошком
Химические соединения металлов и некоторых неметаллов с кремнием называют силицидами, которые образуются при высоких температурах. Силициды разделяются на три основные группы: -металлоподобные. Образуются переходными металлами. -ковалентные – азотом, серой, бором, фосфором, углеродом, кислородом. -ионно-ковалентные образуются щелочноземельными и щелочными (кроме калия и натрия) металлами.
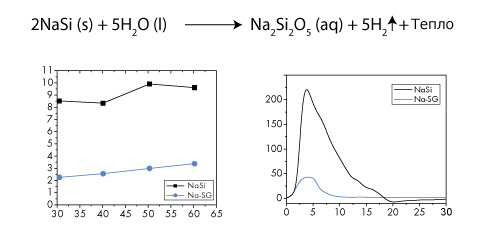
Здесь показана ключевая реакция в картридже от SiGNa Chemistry. Внизу слева: массовый процент H2 (вертикальная шкала) по отношению к весу исходного порошка в зависимости от температуры смеси в градусах Цельсия (горизонтальная шкала). Справа: темп генерации водорода после включения системы (горизонтальная шкала в секундах).
Чёрные линии показывают параметры для силицида натрия, синие – для альтернативного состава натрий-силикагель, с которым также экспериментировала компания (иллюстрации SiGNa Chemistry).
5 октября 2010 года, в Нью-Йорке, в рамках Interbike International Trade Expo, компанией SiGNa Chemistry Inc. был устроен показательный заезд, для демонстрации высоко-эффективного водородного двигателя. Это инновационное устройство производит водородный газ мгновенно и затем преобразовывает водород в электричество, используя дешевый топливный элемент. Двигатель развивает мощность до 200W. Излишняя энергия сохраняется в литиевой батарее для использования в условиях энергоемких ускорений или взбирания на холм. Уникальное преимущество — высокая степень безопасности, что было продемонстрировано в течение непрерывной трехдневной эксплуатации на Interbike EXPO. Водород производится при низком давлении (50 %, давления банки с содой), а единственная эмиссия — водный пар. Электро-велосипед на топливном элементе SiGNa преодолевает 60 миль (96,56 км) на одной зарядке. Самое впечатляющее то, что для этого нужна обычная вода.
Сам велосипед лишь витрина для технологии топливного элемента, структура которого напоминает объемную матрицу, ячейки которой используют порошковый силицид натрия. Добавив воды, Вы немедленно получите водородный газ. Этот водород используется для производства электричества. Поскольку водород не накапливается, ячейки безопасны, а излишнее электричество сохраняется в батареях для дополнительного усиления, когда Вы движитесь на подъем или ускоряетесь. Быстро-сменные картриджи полностью пригодны для вторичной переработки.
Опытный образец велосипеда с генератором от SiGNa Chemistry (чёрный ящик сзади). Белая коробочка ниже – буферная литиевая батарея (фото с сайта wired.com).
По информации ICIS Green Chemicals, компания SiGNa построила и испытала первый образец комбинированного генератора под названием H300 (на снимке) ещё год назад.
http://www.icis.com/blogs/green-chemicals/2009/11/portable-fuel-cell-for-christm.html
Система была создана в кооперации с американской компанией Trulite. Она отвечала за топливный элемент, который утилизирует водород, вырабатываемый по технологии SiGNa. Среди возможных областей применения уже тогда назывались электровелосипеды, что и было продемонстрировано нынешней осенью (фото с сайта icis.com). http://www.trulitetech.com/
Главное преимущество (кроме аспекта безопасности) состоит в том, что есть возможность быстро заменить один картридж на другой, когда Вы торопитесь, вместо того чтобы ждать перезарядки (вес составляет около 1.5 фунта (680 грамм) — меньше чем большинство батарей. Вы также получаете большую дистанцию пробега: велосипед на аккумуляторах, как правило, может проехать 20-30 миль (32-48 км) на одной зарядке. Данные изделия могут быть разработаны для производства энергии в диапазоне от 1 Вт до 1 КВт. , тем не менее, их будущее связано не столько с велосипедами, сколько с большими транспортными средствами. SiGNa объявила о приеме предварительных заказов на топливные элементы. Предполагается, что велосипеды будут доступны следующим летом.
Для велосипедиста преимущества очевидны: водородный байк утраивает длину пробега на одной зарядке, в сравнении с обычным электро-велосипедом, при минимальном дополнительном весе. У существующих электро-велосипедов пробег на одной зарядке батареи (без использования педалей) составляет 20 (реже 30 км); SiGNa увеличила дистанцию до 60 миль (96,56 км). В водородных картриджах на 1 кг веса вырабатывается более чем 1 000 Вт/ч по сравнению с продвинутыми литий-ионными аккумуляторами приблизительно в 65 Вт/ч на килограмм.
Двигатель использует безопасные реактивные металлические порошки, чтобы произвести электроэнергию. «Продемонстрировав водородную технологию на электро-велосипеде, мы показали беспрецедентное решение для выработки энергии без выбросов парниковых газов», — говорит Михаэль Лефенфельд SEO и Президент SiGNa. «Устройство было продемонстрировано на электрическом велосипеде Pedego®, но оно совместимо с большинством моделей электрических велосипедов.»
Силицид натрия, благодаря которому портативный двигатель стал возможным — безопасный, устойчивый к окислению реактивный металлический порошок, создающий водородный газ при соприкосновении с водой. Годится любая вода, включая пригодную для питья воду, загрязненную воду, морскую воду, или даже мочу. Как только топливный картридж исчерпан,его можно отправлять в переработку — после окончания цикла эксплуатации остается экологически безопасный побочный продукт — силикат натрия.
Водородный велосипед является еще одной вехой в давнем споре между противниками и сторонниками водородной энергетики. А начался он в 80-е годы ХХ века, когда выяснилось, что запасы нефти и газа не бесконечны, а выхлопы двигателей внутреннего сгорания и тепловых электростанций сильно загрязняют окружающую среду. Главным козырем противников водородных двигателей было то, что известные способы получения водорода были очень энергоемки: для производства 1тонны водорода, нужно сжечь десятки тонн нефти, что опять же загрязняет окружающую среду и не отменяет нефтезависимость. Новое устройство — весомый аргумент в этом споре: единственный недостаток, о котором пока упоминается — практически абсолютная бесшумность двигателя, мол, транспортное средство передвигающееся практически бесшумно потенциально опасно для пешеходов.
Коллективное сознание постепенно выбирается из нефте-газового угара. Каждый день приносит новые вести об альтернативных источниках энергии. К более-менее привычным фермам солнечных батарей и ветряков добавляются хитроумные конструкции на базе нано-технологий, человечество 6е бросает попыток приручить атом, все громче заявляет о себе микроэнергетика. Куда все это ведет? По-видимому, в не столь уж отдаленное будущее, где для общения друг с другом на расстоянии, равно как и для перемещения в пространстве, люди не будут использовать сколь-нибудь заметных устройств, не говоря уж о такой ерунде, как старомодное поддержание комфортного температурного режима при помощи шкур убитых животных.
Химия Кремния. Взаимодействия Кремния с металлами (Силициды)
Кристаллический кремний является веществом химически довольно инертным, тогда как аморфный значительно более реакционноспособен. Он хорошо растворим во многих расплавленных металлах, причем в одних случаях (Zu, AI, Su, Рb, Au, Ag) с ними химически не взаимодействует, а в других (Mg, Са, Сu, Fе, Pt, Bi) образует соединения, например, Mg2Si, называемые силицидами. Для них известны простейшие формулы, отвечающие обычным валентностям образующих их металлов и кремния, например, Mn2Si, MnSi, Сг2Siз, но в некоторых случаях валентные отношения не очень ясны, например, Сг3Si, MnSi2. Как правило, почти все силициды устойчивы по отношению к воде и кислотам, за исключением силицидов некоторых активных металлов (в частности, лития, кальция). Так, силицид Li бурно реагирует с водой, выделяя смесь водорода, моно- и дикремневодородов. Расплавленные едкие щелочи активно взаимодействуют с силицидами, образуя силикаты. Разбавленные щелочи реагируют с си-лицидами медленнее, но силициды с большим содержанием кремния щелочами разлагаются довольно легко.
При нагревании до 500-600 С силициды щелочных металлов (кроме силицида натрия), теряют часть металла, переходя в полисилициды — KSi6, CsSi8 с образованием сложных структурных группировок из атомов кремния. Силициды — кристаллические вещества, обладающие металлическим блеском и значительной хрупкостью. Важнейшие промышленные способы получения силицидов основаны на использовании восстановительных свойств элементарного кремния. Известны следующие методы получения силицидов:
Благодаря своим ценным физико-химическим свойствам силициды широко применяются в технике. Так, сплавы системы медь-кремний применяются как кремнистые бронзы, Mg2Si обладает высоким электросопротивлением, входит в состав дюралюминия. Силицид кальция используется в качестве сильного восстановителя для предупреждения окисления легирующих примесей при плавке стали, для очистки стали от серы и фосфора. Как уже отмечалось, кремний с алюминием не образует силицид, но их сплав используется как конструкционный материал (силумин). Высокая химическая стойкость MoSi2 обусловливает его применение для аппаратуры в химической промышленности, а ферросилиций используется в производстве сварочных материалов, для получения кислотоупорных изделий. Также соединения с его участием применяются для защиты металла.
Инженеры научились заряжать мобильники водой
Источник
Кремний. Химия кремния и его соединений
Кремний
Положение в периодической системе химических элементов
Кремний расположен в главной подгруппе IV группы (или в 14 группе в современной форме ПСХЭ) и в третьем периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение кремния
Электронная конфигурация кремния в основном состоянии :
+14Si 1s 2 2s 2 2p 6 3s 2 3p 2
Электронная конфигурация кремния в возбужденном состоянии :
+14Si * 1s 2 2s 2 2p 6 3s 1 3p 3
Атом кремния содержит на внешнем энергетическом уровне 2 неспаренных электрона и 1 неподеленную электронную пару в основном энергетическом состоянии и 4 неспаренных электрона в возбужденном энергетическом состоянии.
Степени окисления атома кремния — от -4 до +4. Характерные степени окисления -4, 0, +2, +4.
Физические свойства, способы получения и нахождение в природе кремния
Кремний — второй по распространенности элемент на Земле после кислорода. Встречается только в виде соединений. Оксид кремния SiO2 образует большое количество природных веществ – горный хрусталь, кварц, кремнезем.
Простое вещество кремний – атомный кристалл темно-серого цвета с металлическим блеском, довольно хрупок. Температура плавления 1415 °C, плотность 2,33 г/см 3 . Полупроводник.
Качественные реакции
Качественная реакция на силикат-ионы SiO3 2- — взаимодействие солей-силикатов с сильными кислотами . Кремниевая кислота – слабая. Она легко выделяется из растворов солей кремниевой кислоты при действии на них более сильными кислотами.
Например , если к раствору силиката натрия прилить сильно разбавленный раствор соляной кислоты, то кремниевая кислота выделится не в виде осадка, а в виде геля. Раствор помутнеет и «застынет».
Na2SiO3 + 2HCl = H2SiO3 + 2 NaCl
Видеоопыт взаимодействия силиката натрия с соляной кислоты (получение кремниевой кислоты) можно посмотреть здесь.
Соединения кремния
Основные степени окисления кремния +4, 0 и -4.
Наиболее типичные соединения кремния:
| Степень окисления | Типичные соединения |
| +4 | оксид кремния (IV) SiO2 бинарные соединения с неметаллами (карбид кремния SiC) |
| -4 | силан SiH4 силициды металлов (силицид натрия Na4Si) |
Способы получения кремния
В свободном состоянии кремний был получен Берцелиусом в 1822 г. Его латинское название «силиций» произошло от латинского слова « sile х», что означает «кремень». Аморфный кремний в лаборатории можно получить при прокаливании смеси металлического магния с диоксидом кремния. Для опыта диоксид кремния следует тщательно измельчить. При нагревании смеси начинается бурная реакция. Одним из продуктов этой реакции является аморфный кремний.
SiO2 + 2Mg → Si + 2MgO
Видеоопыт взаимодействия оксида кремния (IV) с магнием можно посмотреть здесь.
Еще один способ получения кремния в лаборатории — восстановление из оксида алюминием:
В промышленности использовать дорогие алюминий и магний неэффективно, поэтому используют другие, более дешевые способы:
1. Восстановление из оксида коксом в электрических печах:
SiO2 + 2C → Si + 2CO
Однако в таком процессе процессе образующийся кремний загрязнен примесями карбидов кремния, и для производства, например, микросхем уже не подходит.
2. Наиболее чистый кремний получают восстановлением тетрахлорида кремния водородом при 1200 °С:
SiCl4 +2H2 → Si + 4HCl
или цинком :
SiCl4 + 2Zn → Si + 2ZnCl2
3. Также чистый кремний получается при разложении силана :
Химические свойства
При нормальных условиях кремний существует в виде атомного кристалла, поэтому химическая активность кремния крайне невысокая.
1. Кремний проявляет свойства окислителя (при взаимодействии с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (при взаимодействии с элементами, расположенными выше и правее). Поэтому кремний реагирует и с металлами , и с неметаллами .
1.1. При обычных условиях кремний реагирует с фтором с образованием фторида кремния (IV):
При нагревании кремний реагирует с хлором, бромом, йодом :
1.2. При сильном нагревании (около 2000 о С) кремний реагирует с углеродом с образованием бинарного соединения карбида кремния (карборунда):
C + Si → SiC
При температуре выше 600°С взаимодействует с серой:
Si + 2S → SiS2
1.3. Кремний не взаимодействует с водородом .
1.4. С азотом кремний реагирует в очень жестких условиях:
1.5. В реакциях с активными металлами кремний проявляет свойства окислителя. При этом образуются силициды:
2Ca + Si → Ca2Si
Si + 2Mg → Mg2Si
1.6. При нагревании выше 400°С кремний взаимодействует с кислородом :
2. Кремний взаимодействует со сложными веществами:
2.1. В водных растворах щелочей кремний растворяется с образованием солей кремниевой кислоты. При этом щелочь окисляет кремний.
2.2. Кремний не взаимодействует с водными растворами кислот , но аморфный кремний растворяется в плавиковой кислоте с образованием гексафторкремниевой кислоты :
При обработке кремния безводным фтороводородом комплекс не образуется:
С хлороводородом кремний реагирует при 300 °С, с бромоводородом – при 500 °С.
2.3. Кремний растворяется в смеси концентрированных азотной и плавиковой кислот :
3Si + 4HNO3 + 12HF → 3SiF4 + 4NO + 8H2O
Бинарные соединения кремния
Силициды металлов
Силициды – это бинарные соединения кремния с металлами, в которых кремний имеет степень окисления -4. Химическая связь в силицидах металлов — ионная.
Силициды, как правило, легко гидролизуются в воде или в кислой среде.
Например , силицид магния разлагается водой на гидроксид магния и силан:
Соляная кислота легко разлагает силицид магния:
Получают силициды сплавлением простых веществ или восстановлением смеси оксидов коксом в электропечах:
2Mg + Si → Mg 2 Si
2MgO + SiO2 + 4C → Mg2Si + 4CO
Силан
Силан – это бинарное соединение кремния с водородом SiH4, ядовитый бесцветный газ.
Если поместить порошок силицида магния в очень слабый раствор соляной кислоты, то на поверхности раствора образуются пузырьки газа. Они лопаются и загораются на воздухе. Это горит силан. Он образуется при взаимодействии кислоты с силицидом магния:
Видеоопыт получения силана из силицида магния можно посмотреть здесь.
На воздухе силан горит с образованием SiO2 и H2O:
Видеоопыт сгорания силана можно посмотреть здесь.
Силан разлагается водой разлагается с выделением водорода:
Силан разлагается (окисляется) щелочами :
Силан при нагревании разлагается :
Карбид кремния
В соединениях кремния с неметаллами — ковалентная связь.
Рассмотрим карбид кремния – карборунд Si +4 C -4 . Это вещество с атомной кристаллической решеткой. Он имеет структуру, подобную структуре алмаза и характеризуется высокой твердостью и температурой плавления, а также высокой химической устойчивостью.
Карборунд окисляется кислородом при высокой температуре:
Карборунд окисляется кислородом в расплаве щелочи :
Галогениды кремния
Хлорид и фторид кремния – галогенангидриды кремниевой кислоты.
SiCl4.
Получают галогениды кремния действием хлора на сплав оксида кремния с углем :
Галогениды кремния разлагаются водой до кремниевой кислоты и хлороводорода:
Хлорид кремния (IV) восстанавливается водородом :
SiCl4 + 2H2 → Si + 4HCl
Оксид кремния (IV)
Физические свойства и нахождение в природе
Оксид кремния (IV) – это твердое вещество с атомной кристаллической решеткой. В природе встречается в виде кварца, речного песка, кремнезема и прочих модификаций:
Химические свойства
Оксид кремния (IV) – типичный кислотный оксид . За счет кремния со степенью окисления +4 проявляет слабые окислительные свойства.
1. Как кислотный оксид, диоксид кремния (IV) взаимодействует с растворами и расплавами щелочей и в расплаве с основными оксидами . При этом образуются силикаты.
Например , диоксид кремния взаимодействует с гидроксидом калия:
Еще пример : диоксид кремния взаимодействует с оксидом кальция.
SiO2 + CaO → CaSiO3
2. Оксид кремния (IV) не взаимодействует с водой , т.к. кремниевая кислота нерастворима .
3. Оксид кремния (IV) реагирует при сплавлении с карбонатами щелочных металлов . При этом работает правило: менее летучий оксид вытесняет более летучий оксид из солей при сплавлении.
Например , оксид кремния (IV) взаимодействует с карбонатом калия. При этом образуется силикат калия и углекислый газ:
4. Из кислот диоксид кремния реагирует только с плавиковой или с газообразным фтороводородом :
5. При температуре выше 1000 °С оксид кремния реагирует с активными металлами, при этом образуется кремний.
Например , оксид кремния взаимодействует с магнием с образованием кремния и оксида магния:
SiO2 + 2Mg → Si + 2MgO
Видеоопыт взаимодействия оксида кремния (IV) с магнием можно посмотреть здесь.
При избытке восстановителя образуются силициды:
SiO2 + 4Mg → Mg2Si + 2MgO
6. Оксид кремния (IV) взаимодействует с неметаллами.
Например , оксид кремния (IV) реагирует с водородом в жестких условиях. При этом оксид кремния проявляет окислительные свойства:
Еще пример : оксид кремния взаимодействует с углеродом. При этом образуется карборунд и угарный газ:
SiO2 + 3С → SiС + 2СО
При сплавлении оксид кремния взаимодействует с фосфатом кальция и углем:
Кремниевая кислота
Строение молекулы и физические свойства
Кремниевые кислоты — очень слабые, малорастворимые в воде соединения общей формулы nSiO2•mH2O. Образует коллоидный раствор в воде.
Метакремниевая H2SiO3 существует в растворе в виде полимера:
Способы получения
Кремниевая кислота образуется при действии сильных кисло т на растворимые силикаты (силикаты щелочных металлов).
Например , при действии соляной кислоты на силикат натрия:
Видеоопыт получения кремниевой кислоты из силиката натрия можно посмотреть здесь.
Даже слабая угольная кислота вытесняет кремниевую кислоту из солей:
Химические свойства
1. Кремниевая кислота — нерастворимая. Кислотные свойства выражены очень слабо, поэтому кислота реагирует только с сильными основаниями и их оксидами :
Например , кремниевая кислота реагирует с концентрированным гидроксидом калия:
2. При нагревании кремниевая кислота разлагается на оксид и воду :
Силикаты
Силикаты — это соли кремниевой кислоты. Большинство силикатов нерастворимо в воде, кроме силикатов натрия и калия, их называют «жидким стеклом».
Способы получения силикатов:
1 . Растворение кремния, кремниевой кислоты или оксида в щелочи:
2. Сплавление с основными оксидами:
СаО + SiO2 → CaSiO3
3. Взаимодействие растворимых силикатов с солями:
Оконное стекло (натриевое стекло) — силикат натрия и кальция: Na2O·CaO·6SiO2.
Стекло получают при сплавлении в специальных печах смеси соды Na2CO3, известняка CaCO3 и белого песка SiO2:
Для получения специального стекла вводят различные добавки, так стекло содержащее ионы Pb 2+ – хрусталь; Cr 3+ – имеет зеленую окраску, Fe 3+ – коричневое бутылочное стекло, Co 2+ – дает синий цвет, Mn 2+ – красновато-лиловый.
Источник