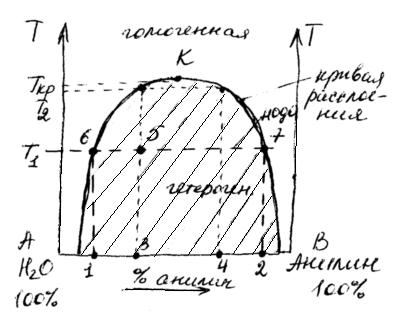
Диаграмма состояния вода-анилин.
Если поместить в цилиндр с пробкой анилин и воду и встряхивать смесь до достижения равновесия (при постоянной температуре и давлении), то после анализа получим два слоя жидкости – (1) воды с растворенным анилином ( 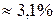
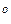
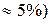
Однако, состав этих слоев зависит от температуры (при р=const) или от давления (при Т=сonst).
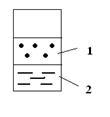
В заштрихованной области наблюдается расслоение:
1 (верх) – раствор анилина в воде
2 (низ) – раствор воды в анилине
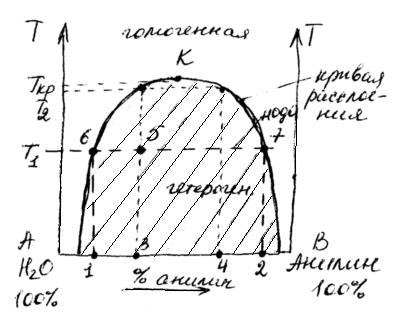
Точка К определяет критическую температуру растворения.
Критическая температура растворения – это та температура, ниже или выше которой ограниченно растворимые жидкости неограниченно растворяются друг в друге.
Гетерогенная область отделена от гомогенной кривой расслоения.
Пусть суммарный состав характеризуется точкой 5. Чтобы определить состав двух слоев, нужно через т.5 провести прямую, параллельную оси х, до пересечения с кривой расслоения (получим точки 6 и 7). Опустим из этих точек перпендикуляры к оси х. Тогда слой раствора анилина в воде будет иметь состав т.1, а слой раствора воды в анилине имеет состав в т.2. Если диаграмма построена в координатах “температура–массовые проценты компонентов”, то соотношение масс обоих слоев жидкости можно найти по правилу рычага:
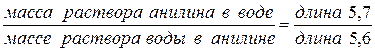
Точка 5 будет характеризовать состав слоя анилина в воде при температуре Т 
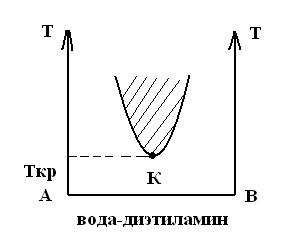
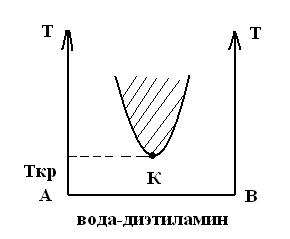
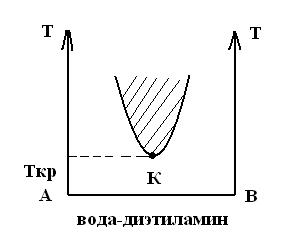
Система анилин–вода имеет верхнюю критическую температуру растворения. Существуют системы с нижней критической температурой растворения. Например, система вода-диэтиламин.
Есть системы с двумя критическими температурами (верхней и нижней), система вода-никотин.
Источник
Диаграмма состояния вода-анилин
Ограниченно растворимые друг в друге жидкости.
Существуют такие жидкие системы, компоненты которых почти полностью нерастворимы друг в друге (вода–керосин, вода–ртуть и др.); существуют и такие системы, компоненты которых обладают ограниченной взаимной растворимостью (например, вода–анилин, вода-фенол, метиловый спирт–нормальный гексан), и, наконец, во многих других системах наблюдается полная взаимная растворимость компонентов (вода–ацетон и др.) строго говоря, абсолютно нерастворимых друг в друге жидкостей нет, так как в той или иной степени все жидкости могут растворяться одна в другой.
Рассмотрим какую-нибудь систему с ограниченной взаимной растворимостью компонентов, например, систему вода–анилин.
Если поместить в цилиндр с пробкой анилин и воду и встряхивать смесь до достижения равновесия (при постоянной температуре и давлении), то после анализа получим два слоя жидкости – (1) воды с растворенным анилином (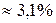
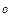
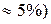
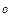
Однако, состав этих слоев зависит от температуры (при р=const) или от давления (при Т=сonst).
В заштрихованной области наблюдается расслоение:
1 (верх) – раствор анилина в воде
2 (низ) – раствор воды в анилине
Точка К определяет критическую температуру растворения.
Критическая температура растворения – это та температура, ниже или выше которой ограниченно растворимые жидкости неограниченно растворяются друг в друге.
Гетерогенная область отделена от гомогенной кривой расслоения.
Пусть суммарный состав характеризуется точкой 5. Чтобы определить состав двух слоев, нужно через т.5 провести прямую, параллельную оси х, до пересечения с кривой расслоения (получим точки 6 и 7). Опустим из этих точек перпендикуляры к оси х. Тогда слой раствора анилина в воде будет иметь состав т.1, а слой раствора воды в анилине имеет состав в т.2. Если диаграмма построена в координатах “температура–массовые проценты компонентов”, то соотношение масс обоих слоев жидкости можно найти по правилу рычага:
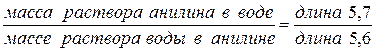
Точка 5 будет характеризовать состав слоя анилина в воде при температуре Т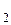
Система анилин–вода имеет верхнюю критическую температуру растворения. Существуют системы с нижней критической температурой растворения. Например, система вода-диэтиламин.
Есть системы с двумя критическими температурами (верхней и нижней), система вода-никотин.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Источник
Диаграмма растворимости вода – анилин
На рисунке 6 представлена диаграмма растворимости системы вода – анилин, которая относится к случаю ограниченной растворимости одной жидкости в другой. Взаимная растворимость жидкостей в этой системе увеличивается с ростом температуры.
 |
Рис. 6. Диаграмма системы H2O – C6H5NH2 (вода – анилин)
Кривая АКВ называется бинодальной кривой растворимости или кривой расслоения, ветвь АК отражает растворимость анилина в воде, ветвь ВК указывает на растворимость воды в анилине в зависимости от температуры.
Бинодальная кривая АКВ делит диаграмму на две области: гомогенную, лежащую над кривой и гетерогенную, находящуюся под кривой расслоения.
Фигуративные точки гомогенной области, например точка Р, изображают состояния однофазной условно дивариантной системы (S = 2 – 1 + 1 = 2).
Фигуративные точки, лежащие внутри гетерогенной области, например точка О, изображают состояние двухфазной условно моновариантной системы (S = 2 – 2 + 1 = 1).
Каждая точка, лежащая на бинодальной кривой, отражает сопряженную фазу. Точки ветви АК отвечают насыщению воды анилином, а точки ветви ВК отвечают насыщению анилина водой.
По диаграмме растворимости можно определить состав исходной смеси и состав двух сопряженных растворов, которые образуются при расслоении системы.
Например, рассмотрим исходную смесь двух жидкостей, которая содержит 70% воды и 3% – анилина (состав х).
Эта смесь будет расслаиваться при обычных условиях и даже при нагревании системы до 155 0 С. И только выше этой температуры (выше точки d) смесь будет гомогенной, однофазной, т.е. при этих условиях жидкости неограниченно растворимы друг в друге.
При температуре, например 100 0 С рассматриваемая смесь представляет собой два сопряженных раствора.
Состав образующихся двух растворов можно определить следующим образом: через точку О надо провести изотерму до пересечения с бинодальной кривой, которая является границей фазового поля (точки а и в).
Опуская перпендикуляры из этих точек на ось состава, определяют состав обоих образующихся растворов.
Состав одного из сопряженных растворов определяется точкой х1 (93% Н2О, 7% C6H5NH2), состав другого – точкой х2 (84% C6H5NH2, 16% Н2О).
По правилу рычага можно определить и относительные массы сопряженных растворов: mр-ра состава х1 . ℓао = mр-ра состава х2 . ℓов,
где ℓ – длина плеча.
Точка К разделяет бинодальную кривую на две ветви и называется верхней критической точкой растворения, а соответствующая ей температура – верхней критической температурой растворения. Выше этой температуры смесь любого состава имеет неограниченную растворимость и представляет собой однофазную гомогенную жидкую систему (S = 2 – 1 + 1 = 2).
|
Верхнюю критическую температуру растворения (ВКТР) находят по правилу Алексеева:
проводят несколько изотерм (коннод) и соединяют их середины, тогда эта прямая будет проходить через точку К, которая и указывает на ВКТР.
Источник
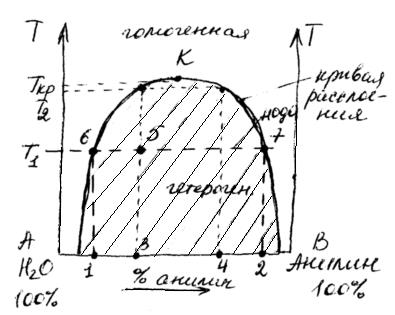
Диаграмма состояния вода-анилин.
Если поместить в цилиндр с пробкой анилин и воду и встряхивать смесь до достижения равновесия (при постоянной температуре и давлении), то после анализа получим два слоя жидкости – (1) воды с растворенным анилином ( 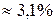
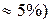
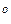
Однако, состав этих слоев зависит от температуры (при р=const) или от давления (при Т=сonst).
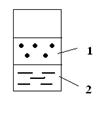
В заштрихованной области наблюдается расслоение:
1 (верх) – раствор анилина в воде
2 (низ) – раствор воды в анилине
Точка К определяет критическую температуру растворения.
Критическая температура растворения – это та температура, ниже или выше которой ограниченно растворимые жидкости неограниченно растворяются друг в друге.
Гетерогенная область отделена от гомогенной кривой расслоения.
Пусть суммарный состав характеризуется точкой 5. Чтобы определить состав двух слоев, нужно через т.5 провести прямую, параллельную оси х, до пересечения с кривой расслоения (получим точки 6 и 7). Опустим из этих точек перпендикуляры к оси х. Тогда слой раствора анилина в воде будет иметь состав т.1, а слой раствора воды в анилине имеет состав в т.2. Если диаграмма построена в координатах “температура–массовые проценты компонентов”, то соотношение масс обоих слоев жидкости можно найти по правилу рычага:
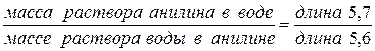
Точка 5 будет характеризовать состав слоя анилина в воде при температуре Т 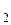
Система анилин–вода имеет верхнюю критическую температуру растворения. Существуют системы с нижней критической температурой растворения. Например, система вода-диэтиламин.
Есть системы с двумя критическими температурами (верхней и нижней), система вода-никотин.
Источник
Опыты по химии. Амины
Бромирование анилина
Аминогруппа влияет на свойства бензольного кольца. Она делает его более реакционноактивным. К насыщенному водному раствору анилина прильем бромную воду. Раствор мутнеет. Выпадает белый осадок 2,4,6-триброманилина.
С6Н5NH2 + 3 Br2 = C6H2Br3 + 3HBr
Оборудование: пробирки, штатив для пробирок.
Техника безопасности. Соблюдать правила работы с ядовитыми веществами и бромом.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Взаимодействие анилина с соляной кислотой
Анилин – слабое основание. С сильными кислотами анилин способен образовывать соли. Приготовим смесь анилина с водой. Прибавим к смеси соляную кислоту. Происходит растворение анилина. В растворе образуется солянокислый анилин или хлорид фениламмония
С6Н5NH2 + HCI = [C6H5NH3] CI
Оборудование: пробирки, штатив для пробирок.
Техника безопасности. Соблюдать правила работы с ядовитыми веществами и кислотами.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Изучение среды раствора анилина
Анилин мало растворим в воде. При 18 о С в 100 мл воды растворяется 3,6г. анилина. Раствор анилина не изменяет окраски индикаторов. Возьмем пробу раствора анилина. Добавим в пробирку лакмус. Окраска индикатора не изменяется, это значит, что раствора анилина имеет нейтральную реакцию среды. Оборудование: пробирка, штатив для пробирок.
Оборудование: пробирка, штатив для пробирок.
Техника безопасности. Соблюдать правила работы с ядовитыми веществами и кислотами.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Изучение физических свойств анилина
Анилин – бесцветная маслянистая жидкость. При хранении анилин постепенно окисляется и приобретает вначале желтую, затем бурую окраску. Изучим растворимость анилина в воде. Прибавим анилин к воде и перемешаем раствор. Анилин мало растворим в воде. При 18 о С в 100 мл воды растворяется всего 3,6г. анилина. Раствор анилина не изменяет окраски индикаторов.
Оборудование: пробирки, штатив для пробирок.
Техника безопасности. Соблюдать правила работы с ядовитыми веществами.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Качественное определение азота в органических соединениях
Очень чувствительным методом определения азота в органических соединениях является сплавление вещества с металлическим натрием. Небольшую порцию анализируемого вещества сплавляем с кусочком металлического натрия. Важно, чтобы весь натрий прореагировал или окислился. Когда весь натрий прореагировал, охлаждаем пробирку, заливаем ее водой и кипятим. К полученному раствору добавляем крупинку сульфата железа (II) и вновь нагреваем. Затем добавляем соляную кислоту. Появление синего окрашивания свидетельствует о наличии азота в исследуемом органическом соединении. При сплавлении натрия с азотсодержащим веществом образуется цианид натрия. С солью двухвалентного железа цианид натрия образует гексацианоферрат (II) натрия. Так как сульфат железа (II) всегда содержит примесь железа (III), то с железом (III) гексацианоферрат натрия образует берлинскую лазурь. Появляется голубое окрашивание.
Оборудование: штатив для пробирок, пробирки, горелка, зажим для пробирок, стакан, фильтровальная бумага, скальпель, пинцет.
Техника безопасности. Соблюдать правила работы со щелочными металлами.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Окисление анилина раствором дихромата калия
Окисление анилина дихроматом калия позволяет получить важный промышленный краситель – черный анилин. К насыщенному раствору дихромата калия прибавим раствор серной кислоты и эмульсию анилина. Жидкость окрашивается в зеленый цвет, который постепенно переходит в черный. Образуется черный анилин — нерастворимый в воде краситель.
Оборудование: пробирки, штатив для пробирок.
Техника безопасности. Соблюдать правила работы с ядовитыми веществами и кислотами.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Окисление анилина раствором хлорной извести
Определить наличие анилина в растворе можно с помощью раствора хлорной извести. К сильно разбавленному раствору анилина добавим отфильтрованный раствор хлорной извести. Раствор становится синим. Реакция с хлорной известью – качественная реакция на анилин, она основана на легкой окисляемости анилина. Реакция очень чувствительна и позволяет определить даже следы анилина.
Оборудование: пробирки, штатив для пробирок.
Техника безопасности. Соблюдать правила работы с ядовитыми веществами.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Получение гидроксида диметиламмония и изучение его свойств
Амины с водой образуют достаточно сильные основания. Приготовим раствор диметиламина в воде. Газ диметиламин хорошо растворяется в воде. При этом образуется гидроксид диметиламмония (гидрат диметиламина)
(СН3)2NH + H2O = [(СН3)2NH2]ОН
Пробу гидроксида диметиламмония (гидрата диметиламина) испытаем раствором фенолфталеина. Фенолфталеин приобретает малиновую окраску: среда раствора – щелочная. К следующей порции раствора прибавим раствор хлорида железа (III) – выпадает бурый осадок гидроксида железа.
3[(СН3)2NH2]ОН + FeCI3 = Fe(OH)3 ↓+ 3[(СН3)2NH2]CI
Вносим палочку, смоченную концентрированной соляной кислотой, в выделяющийся газ диметиламин, образуется густой белый дым. Дым – кристаллы гидрохлорида диметиламина.
(СН3)2NH + HCI = [(СН3)2NH2] CI
Оборудование: пробирки, штатив для пробирок, горелка.
Техника безопасности. Соблюдать правила работы со щелочами, кислотами. Правила работы нагревательными приборами.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Получение диметиламина и его горение
Получим диметиламин действием гидроксида натрия на хлорид диметиламина. Смешаем в пробирке хлорид диметиламина со щелочью и прибавим воды. При легком нагревании выделяется газ диметиламин.
[(СН3)2NH2] CI + NaOH = (СН3)2NH + NaCI + H2O
При поджигании диметиламин сгорает с образованием углекислого газа, водяных паров и азота.
4(СН3)2NH +15 O2 = 8CO2 + 14H2O + 2N2
Оборудование: штатив для пробирок, пробирки, горелка, зажим для пробирок, газоотводная трубка.
Техника безопасности. Соблюдать правила работы со щелочами и нагревательными приборами.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Источник