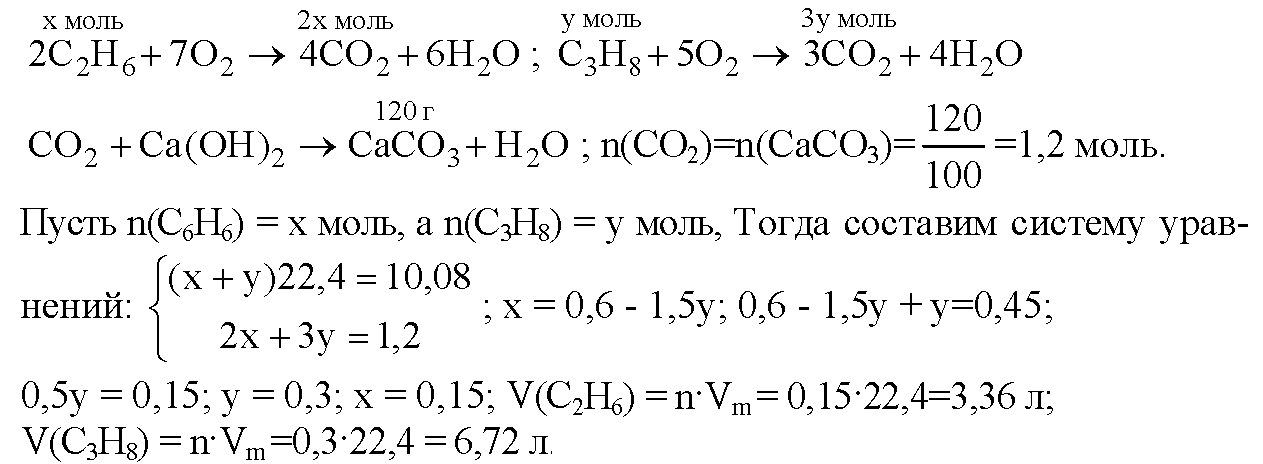Известковая вода и углекислый газ
Человеку вода нужна как в быту, постоянно, так и на производстве. Даже если само производство воды не касается, то людей, которые это производство обслуживают нужно и кормить, и поить, и мыться им тоже нужно где-то. Потому представить себе жизнь человека без использования воды, сегодня невозможно, а вот представить себе человека, который каждый день использует в пищу известковую воду очень даже. Проблема эта решаема! Но далеко не все пока стремятся этот недостаток воды устранить.
Нежелание умягчать воду – истоки
История с водой началась не недавно. Потребители далеко не все стремятся мгновенно устанавливать у себя умягчающие аппараты, хоть и понимают вред от известковой воды. С таким положением вещей производители умягчающих установок борются не первый год. Просвященность населения растет, но поскольку такой прибор не является прибором первой необходимости, то и потребности в нем в кризис, не испытывают.
Какую воду можно считать жесткой, а какая под это понятие не подходит. Ниже представлена таблица ранжирования видов воды, в зависимости от количества углекислого газа и размера примесей солей жесткости. Причем соотношение кальция и магния в такой воде совершенно безразлично, вода все равно будет считаться известковой, даже если одной соли в ней будет 0,000001, а другой 0,9999999 . Причем и устранение излишков не подразумевает направленность методов на вычитание из состава воды только одного вида соли.
Таблица 1. Показатель известковой воды в эквиваленте миллиграмм на литр
Такое разделение является примерным. Некоторые специалисты выделяют еще слабо жесткую воду с параметрами от 5 до 7. Кстати такая вода может встречаться в центральной системе водоснабжения. Но показатель семь уже означает, что на стенках посуды оборудования будет образовываться вредный осадок.
Что еще сдерживает потребителей от приобретения нужных фильтров для очистки известковой воды, кроме стоимости их и необходимости экономить в кризис. Здесь выходит на передний фон медленная достаточно реакция организма на углекислый газ. Что собственно человека может заставить совершить траты?
- Определенная выгода;
- Угроза здоровью;
- Поломки дорогих приборов.
Все три причины вполне применимы к работе известковости, только вот работают эти причины не всегда достаточно стимулирующее. Понимая даже угрозу своему организму, потребитель далеко не всегда может проголосовать в сторону приобретения прибора-умягчителя. Больше всего он переживает о своих сиюминутных тратах. И если вода слишком известковая, то поломка бытового прибора без защиты не заставит долго себя ждать.
Второй момент, важный для потребителя, более экономный расход воды – она ведь тоже сегодня не дешевая, а при использовании мягкой воды и воды идет меньше на ту же стирку, и средств для стирки тоже используется меньше.
Известь в воде приводит к ряду проблем. Одна из них, это помутнение воды. Более всего расстраивает потребителя, да и промышленность – образование налета на стенках оборудования. В случае с личным потреблением этот налет образовывается везде, абсолютно. В том числе и на поверхностях внутренних органов. Некачественная вода является причиной появления углекислого газа и образования камней и песка в органах человека.
И если организму все равно, проводит тепло или нет известковый осадок, то для оборудования, которое греет воду, это крайне важно. Задача теплогрейного оборудования быстро анагреть воду до определенной температуры. Если оно работает с известковой жидкостью, то очень быстро на стенках образуется определенный блокирующий налет. Изоляционные свойства углекислого газа не дают возможности греть воду, как и раньше. Многие спрашивают, почему происходит помутнение известковой воды при контакте с углекислым газом? Чем больше нарастает осадок на поверхностях, тем хуже вода греется и тем больше тепла остается внутри поверхностей или нагревательного элемента. И каким бы ни бил закаленным металл, из которого производят прибор, долго перегревы он не выдержит. Результатом таких атак станет перегорание прибора. Без возможности восстановления зачастую. Чем не аргумент для потребителя приобрести подобное устройство защиты.
К тому же работа с мягкой водой приятнее и волосам, и коже. Не будет сухости, выпадания. Мыло будет лучше мылиться, да и для того, чтобы его смыть потом с кожи, понадобиться меньше воды.
Некоторые люди склонны покупать мягкую питьевую воду. Так они надеются защитить хотя бы свой организм от плохой воды. Но ведь в этом случае хорошая вода попадает только во внутрь, а купаться человек продолжает в некачественной воде, да и вся система тепло и водоснабжения остается, как старушка с корытом, со своей известковой водой и углекислым газом. Так, что покупка специальной питьевой воды только расходов добавляет, но проблему в сути ее не решает, увы.
Осторожность при работе с известковой водой!
К минералам, образующим известковость в воде следует относиться осторожно. Не все с ними так однозначно. Сегодня, наверное, даже ребенок скажет, что кости образует такой минерал, как кальций. Вот он то и является одной из составляющих частей известковости. И тут крайне важно соблюдать норму. Тоже самое относится и к магнию. Человек не должен злоупотреблять такими минералами в воде. Но и дефицит своему организму он тоже не должен устраивать.
Соли кальция являются основными для костей, зубов. Любой вывих при дефиците кальция в организме может обернуться закрытым переломом. И виной тому хрупкие кости. Вырастить роскошную шевелюру и иметь крепкие ногти при потреблении бедной на кальций воды невозможно.
Точно также сохранить здоровье не получится, если использовать воду с избыткой извести. Тогда пойдет обратная реакция и внутри организма начнут образовываться солевые центры, которые потом при выведении из организма могут доставлять адские боли или же совсем порежут каналы, соединяющие почки и мочеполовую систему.
Дефицит магния относится немного к другим жизненно важным системам организма. Только вот на кости наличие углекислого газа тоже влияет, тем более, что это естественные соли, а не синтетически созданные. Но более всего от отсутствия магния страдает нервная система. Магний влияет на баланс в организме. При его дефиците человек становится чрезвычайно раздражительным и нервным без причины. Да и на состояние мышц магний тоже влияет. Потому крайне важно правильно умягчать воду, и неконтролируемо ничего не делать.
Кстати, подобные ограничения очень хорошо показывают претензии, которые на сегодня предьявляются врачами к мембранным фильтрам, как варианту борьбы с жесткостью. Мембранный прибор хорош для промышленности более чем. Он выдаст воду, с такими показателями какие ему зададут. Главное мембрану правильную установить.
Оставляет разве только растворенные газы. Но в этом и главная незадача. Слишком. Все очень слишком. Получается, что вместе с плохим, уходит и хорошее. И это делает воду дистиллированной, и значит бедной в сравнении с нормальной мягкой водой. В связи с этим мембранные фильтры снабжают кондиционерными установками для восстановления минеральных солей. Но врачи считают, что такие привнесенные соли намного хуже человеческим организмом воспринимаются. Потому советуют хотя бы смешивать известковую воду и очищенную, для достижения баланса, хотя бы минимально.
У мембранного устройства есть еще минусы, которые правда успешно нивилируются качеством получаемой воды. Во-первых, когда вода очищается в этом приборе, то очень большой объем воды задерживается внутри прибора и в дренаж от этого объема сливается больше половины, то есть очень большой отход при производстве хорошей воды. Потому мембранные приборы устанавливают под мойку, чтобы уловить карбонатную жесткость, ведь вода себе неспешно умягчалась, не задерживая при этом остальной поток.
Отходы не такие вредные, как при смоляной обработке. Но слишком много воды с собой они забирают. Но для квартиры такой прибор считается одним из лучших для получения питьевой воды.
Есть еще кувшин-очиститель. Он переносной, компактный, удобный. Но большого объема питьевой воды не произведет. Для этого нужно врезать в систему смоляной катионный фильтр в магистральном виде. Кувшин же без посторонней помощи чистит воду, просто пропуская ее через картридж с ионообменной смолой. При контакте ионы сменяют друг друга и происходит помутнение. В кувшине остается обогащенная, натриевыми солями вода с нормальным порогом жесткости. Если его нужно еще понизить, то можно просто еще раз залить эту же воду на очистку.
Но смола быстро вымывается. Для получения питьевой воды ее нужно поменять. Стоит такой картридж примерно треть стоимости прибора. То есть сам прибор дешевый, а вот замена постоянная картриджей стоит недешево. Но это нужно делать обязательно, т.к. если этого не сделать, произойдет помутнение воды. Об этом очень многие потребители забывают. Заморочки с заменами и перекрытием углекислого газа доставляют потребителю неудобства.
Нет таких недостатков у электромагнитного устройства. Вот для обработки всей воды, поступающей в квартиру такой прибор является самым удобным. И вода вся проходит абсолютно, никаких дренажей и сливов, и менять что-то не надо. Крайне удобно. Поставил и мойся, купайся, стирай. Все оборудование находится под надежной защитой.
Источник
Пособие-репетитор по химии
Продолжение. Cм. в № 22/2005; 1, 2, 3, 5, 6, 8, 9, 11, 13, 15, 16, 18, 22/2006;
3, 4, 7, 10, 11, 21/2007;
2, 7, 11, 18, 19, 21/2008;
1, 3, 10, 11, 16, 21/2009;
10-й класс (первый год обучения)
Углерод и его соединения

2. Краткая история открытия и происхождение названия.
3. Физические свойства. Аллотропные модификации углерода.
4. Химические свойства.
5. Нахождение в природе.
6. Основные методы получения.
7. Важнейшие соединения углерода (угарный газ, углекислый газ, угольная кислота и ее соли).
Углерод находится в главной подгруппе IV группы периодической системы химических элементов. Электронная формула атома углерода имеет вид 1s 2 2s 2 p 2 , это р-элемент, проявляющий неметаллические свойства. В невозбужденном состоянии углерод проявляет валентность II, при переходе в возбужденное состояние – IV. Характерные степени окисления в соединениях –4, +2, +4, например: 
С: 1s 2 2s 2 2p 2 (валентность II),
С*: 1s 2 2s 1 2p 3 (валентность IV).
Характерной особенностью углерода является его способность к образованию углерод-углеродных цепей, что обуславливает существование органических молекул. Для органических соединений понятие степени окисления является очень условным, например:
Русское название углерода означает “рождающий уголь”. Латинское название carboneum также означает “уголь”.
Ф и з и ч е с к и е с в о й с т в а
Химический элемент углерод в виде простого вещества образует несколько аллотропных модификаций.
Алмаз – аллотропная модификация углерода, существующая в природе и полученная искусственным путем. По внешнему виду это прозрачные кристаллы высокой твердости. После обработки природных алмазов получают драгоценный камень – бриллиант. Кристаллическая решетка алмаза имеет тетраэдрическое строение, расстояние между всеми атомами углерода одинаковое, что обусловлено их sp 3 -гибридизацией. В кристаллической решетке алмаза отсутствуют свободные электроны, поэтому алмаз не проводит электрического тока. Химическая активность алмаза ниже активности другой аллотропной модификации углерода – графита.
Графит – мягкое темно-серое вещество с металлическим блеском, жирное на ощупь. Графит легко измельчается (порошок графита называется сажей). Кристаллическая решетка графита имеет слоистое строение и состоит из слоев правильных шестиугольников, конденсированных по всем сторонам. Атомы углерода в графите находятся в состоянии sp 2 -гибридизации. В образовании химических связей участвуют три электрона атома углерода, а четвертый электрон остается относительно свободным, что обеспечивает высокую электропроводность графита.
Карбин – аллотропная модификация углерода, очень редко встречающаяся в природе. Это полимер, состоящий из линейных макромолекул, атомы углерода находятся в состоянии sp-гибридизации. Карбин – прозрачное и бесцветное вещество, полупроводник. В химическом отношении менее активен, чем графит. Широкого применения не имеет.
Фуллерен – порошок темного цвета (после очистки перекристаллизацией – желтые кристаллы), полупроводник. В природе эта аллотропная модификация углерода не встречается, получена искусственным путем, в настоящее время изучаются свойства фуллерена. Состоит из молекул состава С60 или С70, атомы углерода находятся в состоянии sp 2 -гибридизации. Объемная молекула фуллерена имеет полициклическое строение, по внешнему виду напоминает футбольный мяч.
Х и м и ч е с к и е с в о й с т в а
В химическом отношении углерод при обычных условиях малоактивен, но при нагревании реагирует со многими простыми и сложными веществами. В реакциях углерод может быть как восстановителем, так и окислителем.
C + 2H2 
C + O2 
2C + O2 
4Al + 3C 
2C + Ca 
Ag, Au, Pt + 
С + 2S 
C + 2F2 
С + Н2О (г. ) 
2PbO + C 
CaO + C 
CaO + 3C (кокс) 
С + 2H2SO4 (конц.) = CO2 

С + 4HNO3 (конц.) = CO2 

3С + 4HNO3 (разб.) = 3CO2 

В природе углерод встречается как в виде простого вещества (см. аллотропные модификации), так и в виде соединений, важнейшими из которых являются: мел, мрамор, известняк (CaCO3), доломит (CaCO3•MgCO3) и др. В атмосфере углерод содержится в виде угарного и углекислого газов. Соединения углерода – основные компоненты природного топлива. Кроме того, все органические соединения являются соединениями углерода.
В а ж н е й ш и е с о е д и н е н и я у г л е р о д а
Оксид углерода(II), или угарный газ (СО). Газ без цвета, вкуса и запаха, легче воздуха, плохо растворим в воде, токсичен. Термически устойчив. Атомы в молекуле угарного газа связаны двумя видами ковалентной связи: ковалентной полярной и донорно-акцепторной (кислород является донором, углерод – акцептором):
По химическим свойствам угарный газ является несолеобразующим оксидом, химически достаточно пассивен. При повышенной температуре оксид углерода(II) взаимодействует с кислородом и оксидами металлов, являясь сильным восстановителем, например:
2CO + O2 
CO + MgO 
При пропускании смеси угарного газа и хлора через слой активированного угля можно получить ядовитый газ фосген (химическое оружие, вызывает паралич дыхательных путей):
CO + Cl2 
При нагревании монооксида углерода с водородом в присутствии катализатора при повышенном давлении образуется метиловый спирт:
CO + 2H2 
При пропускании угарного газа через расплав щелочи при высоком давлении образуется соль муравьиной кислоты, поэтому формально монооксид углерода можно рассматривать как ангидрид муравьиной кислоты:
CO + KOH (расплав) 
Лабораторный метод получения угарного газа – разложение муравьиной кислоты при нагревании в присутствии дегидратирующего агента:
HCOOH 
Кроме того, угарный газ можно получить неполным сжиганием кокса или восстановлением углекислого газа раскаленным коксом (t > 1000 °С):
2C + O2 
CO2 + С 
Оксид углерода(IV), или углекислый газ (СО2). Газ без цвета, вкуса и запаха, тяжелее воздуха, растворим в воде (88 объемов углекислого газа в 100 объемах воды), не поддерживает горения и дыхания (правда, в атмосфере углекислого газа могут гореть некоторые активные металлы, отнимая кислород, например магний):
CO2 + 2Mg 
В молекуле CO2 атом углерода образует две 

В химическом отношении диоксид углерода проявляет все свойства кислотного оксида:
CO2 + H2O 
CO2 + CaO 
Качественная реакция на углекислый газ – пропускание его через известковую или баритовую воду:
Ca(OH)2 + CO2 = CaCO3 
аналогично протекает реакция с Ba(OH)2.
Углекислый газ можно получить разложением известняка:
CaCO3 

действием на карбонаты металлов растворами сильных минеральных кислот:
CaCO3 + 2HCl = CaCl2 + H2O + CO2
при полном сжигании кокса:
C + O2 
Угольная кислота (H2CO3) и ее соли. Угольная кислота – слабая двухосновная кислота, в свободном виде не получена, существует только в растворе. Молекула имеет полярное строение, атомы углерода в sp 2 -гибридизации. Термически неустойчива, проявляет все свойства, характерные для слабых кислот (даже органические кислоты вытесняют угольную из ее солей):
H2CO3 
H2CO3 + Zn = ZnCO3 + H2
Угольная кислота, как двухосновная, образует два типа солей: карбонаты и гидрокарбонаты:
Все карбонаты, кроме карбонатов щелочных металлов, разлагаются при нагревании, например:
MgCO3 
но Na2CO3 
Качественной реакцией на карбонаты и гидрокарбонаты является их взаимодействие с растворами сильных минеральных кислот, например:
Na2CO3 + 2HCl = NaCl + H2O + CO2
NaHCO3 + HCl = NaCl + H2O + CO2
Тест по теме “Углерод и его соединения”

б) оксид азота(II);
в) оксид азота(IV);
2. При насыщении известковой воды углекислым газом вначале выпадает осадок массой 20 г, который затем полностью растворяется. Минимальный объем (в л) газа при н.у., который необходим для этого, равен:
а) 4,48; б) 22,4; в) 11,2; г) 8,96.
3. Углерод может необратимо взаимодействовать с:
а) кальцием; б) оксидом кальция;
в) водородом; г) серой.
4. Сколько электронов участвует в образовании химических связей в молекуле углекислого газа?
а) 8; б) 6; в) 4; г) 2.
5. Какие газы тяжелее воздуха?
а) Угарный газ; б) углекислый газ;
в) фосген; г) метан.
6. Сумма коэффициентов в уравнении реакции взаимодействия углерода с концентрированной серной кислотой равна:
а) 6; б) 8; в) 5; г) реакция невозможна.
7. Какие кислоты способны вытеснить угольную кислоту из раствора ее соли?
а) Соляная; б) уксусная;
в) дихромовая; г) кремниевая.
8. Образец газа массой 112 г при н.у. занимает объем 89,6 л. Определите газ.
а) Кислород; б) азот;
в) углекислый газ; г) угарный газ.
9. В молекуле угольной кислоты число 
а) 1; б) 3; в) 5; г) 6.
10. В результате реакции
поглотилось 5,1 кДж теплоты. Объем (в л) выделившегося углекислого газа (н.у.) равен:
а) 11,2; б) 1,12; в) 2,24; г) 22,4.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| в | г | а, б, г | а | б, в | б | а, б, в | б, г | в | б |
Задачи и упражнения на углерод и его соединения

1. Углерод —> метан —> угарный газ —> углекислый газ —> карбонат кальция —> гидрокарбонат кальция —> углекислый газ —> угарный газ.
2. Оксид кальция —> карбид кальция —> гидроксид кальция —> гидрокарбонат кальция —> карбонат кальция —> оксид кальция.
3. Угольная кислота —> углекислый газ —> угарный газ (+ оксид железа(II)) —> А (+ вода, + карбонат бария) —> В —> углекислый газ.
У р о в е н ь А
1. Рассчитайте среднюю молярную массу и плотность по диоксиду углерода смеси газов, содержащей по объему 38 % фосгена и 62 % углекислого газа (н.у.).
2. После прокаливания смеси карбонатов магния и кальция масса выделившегося газа оказалась в 1,1 раза меньше массы твердого остатка. Определите массовые доли веществ в исходной смеси.
Ответ. 

3. Через известковую воду пропустили 1,344 л (н.у.) смеси оксидов углерода. Выпавший осадок отфильтровали и прокалили. Масса полученного вещества составила 1,4 г. Определите массу исходной газовой смеси и ее относительную плотность по воздуху.
При пропускании смеси СО и СО2 через раствор Са(ОН)2
СО не реагирует с Са(ОН)2:
При прокаливании СаСО3 образуется СаО:
Количество вещества в смеси СО и СО2:


Из уравнений (2) и (3) следует:



Количество взятого СO2 (реакция 2) составляет:


m(CO2) = M(CO2) • 
m(CO) = M(CO) • 
m(смеси СО и CO2) = 1,1 + 0,98 = 2,08 г.
Mср = m(смеси) / • 
4. Углекислый газ, полученный при полном сгорании 4,48 л метана (н.у.), полностью поглотили 200 г 7%-го раствора гидроксида натрия. Определите состав полученного раствора.
5. 400 г смеси карбоната и гидрокарбоната натрия прокалили при 300 °С до постоянной массы, равной 276 г. Определите массовые доли веществ в исходной смеси.
6. Вычислите объем углекислого газа, который добавили к 5,6 л угарного газа, если известно, что число электронов в полученной смеси стало в 14,5 раз больше числа Авогадро. Объемы газов измерены при н.у.
7. При разложении смеси карбонатов магния и кальция массой 14,2 г выделилось 3,36 л (н.у.) углекислого газа. Определите массовые доли карбонатов в исходной смеси.
1. Растворение образца карбоната кальция в соляной кислоте при 18 °С заканчивается через 90 с, а при 38 °С такой же образец соли растворяется за 10 с. За какое время данный образец карбоната кальция растворится при 48 °С?
2. Углекислый газ, образовавшийся при сжигании 15 г угля, содержащего 20 % негорючих примесей, пропущен через 480 г 10%-го раствора гидроксида натрия. Рассчитайте массовые доли образовавшихся в растворе солей.
3. Для полного осаждения карбоната кальция к 100 г 10,6%-го раствора карбоната натрия добавили 22,2%-й раствор хлорида кальция. Какую массу воды необходимо удалить из фильтрата, чтобы получить 20%-й раствор хлорида натрия?
Уравнение протекающей реакции:
Na2CO3 + CaCl2 = CaCO3 
Определим количество вещества исходного Na2CO3:


Из уравнения реакции:




m(СaCl2) = 
Найдем массу добавленного раствора CaCl2:
m(р-ра CaCl2) = m(CaCl2) / 
m(NaCl) = 
По условию задачи в полученном растворе:

m(р-ра) = 11,7 / 0,2 = 58,5 г.
m(CaCO3) = 
Определяем массу удаленной воды:
Ответ. 81,5 г воды.
4. Найдите массу раствора с массовой долей карбоната натрия 5 % и массу декагидрата карбоната натрия, которые потребуются для приготовления 200 г 10%-го раствора карбоната натрия.
5. Плотности по воздуху паров хлорида и бромида одного и того же элемента равны соответственно 5,31 и 11,45. Какой элемент входит в указанные галогениды?
6. При длительном прокаливании некоторой массы гидрокарбоната двухвалентного металла выделилось 17,92 л газа (н.у.), а масса оставшегося вещества составила 31,8 г. Определите состав и массу исходного гидрокарбоната.
К а ч е с т в е н н ы е з а д а ч и
1. С какими из перечисленных ниже соединений будет реагировать углекислый газ: негашеная известь, гашеная известь, каустическая сода, кристаллическая сода, магний, серная кислота, серный ангидрид. Подтвердите свой ответ уравнениями реакций.
Ответ. Уравнения реакций:
CaO + CO2 
Mg + CO2 
H2SO4 + CO2 
SO3 + CO2 
2. Вещество А, входящее в состав одного из самых распространенных в земной коре минералов, разлагается при высокой температуре на два оксида, один из которых В всегда образуется в процессе жизнедеятельности. При взаимодействии вещества В с графитом при нагревании получается токсичный для теплокровных животных газ С, без цвета и запаха, горючий. Идентифицируйте вещества, составьте уравнения реакций.
Ответ. Вещества: А – СaCO3, В – СО2, C – CO.
СaCO3 
CO2 + C 
3. При пропускании бесцветного газа А без запаха над простым веществом В при высокой температуре образуется только одно вещество С, которое восстанавливает оксид D черного цвета до красного металла Е. Идентифицируйте вещества, составьте уравнения реакций.
Ответ. Вещества: А – CO2, В – С,
C – CO, D – CuO, E – Cu.
CO2 + C 
CuO + CO 
4. При нагревании соли А, используемой в пищевой отрасли промышленности, образуется соль В и бесцветный газ без запаха С. При действии на соль В соляной кислоты выделяется газ С. Идентифицируйте вещества, составьте уравнения реакций.
2NaHCO3 

Na2CO3 + 2HCl = 2NaСl + H2O + CO2
* Знак +/– означает, что данная реакция протекает не со всеми реагентами или в специфических условиях.
Источник