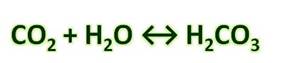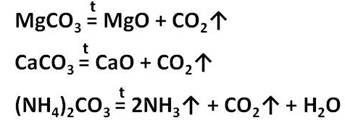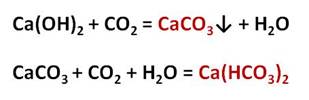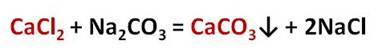- Угольная кислота. Свойства, получение, применение и цена угольной кислоты
- Угольная кислота. Карбонаты. Жёсткость воды
- Урок 27. Химия 9 класс ФГОС
- В данный момент вы не можете посмотреть или раздать видеоурок ученикам
- Получите невероятные возможности
- Конспект урока «Угольная кислота. Карбонаты. Жёсткость воды»
Угольная кислота. Свойства, получение, применение и цена угольной кислоты
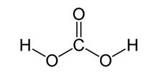
Ее сложно увидеть. Угольная кислота известна науке в форме раствора. В воде размешен углекислый газ . Последнее вещество – это диоксид углерода с формулой CO2. Химическая запись воды, как известно, — H2O.
Вместе получается угольная кислота. Формула вещества записывается как H2CO3. Однако, выделить кислоту в виде порошка, как многие, не получается. Максимум – льдинки. Почему? Давайте разбираться.
Свойства угольной кислоты
Раствор угольной кислоты легко составляется и столь же просто распадается на изначальные компоненты. Особенно активно углекислый газ выделяется при нагреве. При пониженных температурах диссоциация угольной кислоты замедляется.
Вещество превращается в прозрачные кристаллы . Но, температуры, делающие кислоту стабильной, нетипичны для обычных условий. Поэтому, героиню статьи считают слабой, не способной сохранить собственную структуру и с трудом взаимодействующей с другими веществами.
Так, с растворами щелочей, металлами и их оксидами угольная кислота реагирует минимум в 2-е ступени. Сильная угольная кислота лишь в связке с еще более слабыми кислотами . Их героиня статьи вытесняет из растворов солей . «Капитулировать» приходится, к примеру, метакремниевой кислоте .
Химические свойства угольной кислоты являются робким выражением свойств двухосновных кислот . Героиня статьи относится к ним, поскольку содержит в структуре 2 атома водорода . Если точнее, в молекуле угольного соединения есть 2-е группы COOH.
Это, в частности, заставляет героиню статьи проявлять электролитические свойства. Проводить ток позволяет частичное распадение кислоты на ионы. У твердых электролитов они движутся внутри кристаллических решеток. Угольная кислота выделяет ионы только в растворах.
Как и прочие двухосновные вещества, угольная кислота в реакции вступает, дающие два ряда солей . Это бикарбонаты и простые карбонаты. Последние нерастворимы в воде и известны людям под видом мрамора , мела , известняка . Все три камня основаны на карбонате кальция с формулой CaCO3.
Угольная кислота и ее соли бесцветны. Помните, что мел, известняк и мрамор, зачастую, белые ? В растворе героиня кислоты тоже белеса, находится, в основном, в свободном виде.
Так именуют отдельное существование молекул воды и распределенного в ней углекислого газа. Но, встречаются в растворах и карбонатные ионы CO 32- и бикарбонатные частицы HCO3. Все вместе представляет долю кислоты в воде.
Система отличается кинетическим равновесием, то есть, неизменной концентрацией составляющих. Если допускается избыточное содержание диоксида углерода, вода становится агрессивной. Такой раствор расщепляет металлы , бетоны, различные конструкции и камни .
В обычных условиях доля угольной кислоты в воде мала, как и в воздухе, почве. В земле вещества, к примеру, от 0,0002 до 0,0005 частей. Ученые считают, что так было не всегда.
Ища причины гигантских размеров древних растений, исследователи пришли к выводу, что в прошлые эпохи и в почве, и в атмосфере, героини статьи было в несколько раз больше.
Растения способны усваивать вещество и пользуются его влиянием на растворимость в земле минеральных веществ, необходимых травам, кустам и деревьям для питания.
Проводились опыты выращивания растений в атмосферах с разным содержанием угольной кислоты. Рекорды показали экземпляры, находящие в воздухе с содержанием H2CO3 от 5-ти до 10-ти процентов.
Получение угольной кислоты
Важно не столько получение угольной кислоты, сколько ее соединений. Одно из них, к примеру, сода . Она является солью угольного соединения. Сода – кристаллическое вещество.
Но, как засечь образование чистой кислоты , раз она бесцветна? Отличить раствор от простой воды поможет лакмусовая бумажка . Она фиолетовая . В нейтральной среде цвет не меняется. Кислота окрасит лакмус в красный .
Раз героиня статьи получается добавлением в воду диоксида углерода, для начала нужно получить его. Поможет соляная кислота . Она сильная, с легкостью растворяет многие камни, в том числе и мрамор. Реакция ведет к выделению углекислого газа. С водой он смешается самостоятельно.
Получение углекислой кислоты , кстати, налажено в человеческом организме. Героиня статьи входит в буферные системы крови . Они контролируют постоянный pH организма.
Если извне поступают продукты с явной кислотностью или щелочной средой, буферные агенты удерживают нужный pH, пока «гости» переработаются и выведутся с потом, калом, мочой.
Лишние ионы блокируются и нейтрализуются. Это делают белковый, бикарбонатный, фосфатный и гемоглобиновый буферы. Каждый из них состоит из слабой кислоты , одной из ее солей и сильного основания.
В промышленности углекислоту получают 5-ю путями. Первый – извлечение вещества, как сопутствующего углеводородам при их откачке из скважин. При сжигании нефти , угля , кокса, кислоту тоже получают. Получается углекислота и при производстве аммиака . Героиня статьи становится побочным продуктом реакции.
Побочным продуктом углекислота является, так же, при брожении. Так что, соединением запасаются, к примеру, во время изготовления вина. Еще один источник углекислоты – выпуск гашеной извести.
Правда, от нее «отлетают» еще и азот, прочие примеси. Они же затрудняют получение реагента при сжигании углеводородов и на аммиачных заводах . Так что, эффективными способами промышленного получения героини статьи считаются лишь три из перечисленных.
Применение угольной кислоты
В чистом виде угольная кислота нужна не только организму человека растениям, но и на производствах. В процессе сварки, к примеру, героиня статьи служит защитной средой, подобно аргону.
Правда, углекислое соединение приходится раскислять. Для этого используют марганец и кремний . Иначе, нагрев при сварке провоцирует выделение из диоксида углерода активного кислорода.
Он провоцирует коррозию металлов. Именно из-за необходимости обработки угольной кислоты в качестве защитной среды чаще выбирают газ аргон. В пищевой промышленности углекислота – антиокислитель. Его добавляют в чаи , сыры, кофе . Примесь консервирует их, способствуя продолжительному хранению.
Пожарные бригады знают героиню статьи, как средство борьбы с огнем . Кислотой заполняют емкости, из которых соединение поступает к соплам. Для этого используют распределительные трубопроводы. Сопла находятся в защищаемых помещениях.
Выходя «на свободу» кислота превращается в пар, поглощая тепло окружающей среды, заполняя площади. В открытых помещениях системы углекислого пожаротушения не используют, лишь в трюмах, кладовых, насосных, отсеках электростанций. Принцип действия сводится к снижению уровня кислорода до 8%. Горение при таком показатели прекращается.
Раз угольная кислота нужна организму, ее используют медики, фармацевты. Вещество применяется в производстве аспирина, добавляется при некоторых видах анестезии, к примеру, в кислородные маски .
К угнетению дыхательного центра прибегают, в основном, при отравлениях летучими ядами и асфиксии новорожденных. Асфиксия – удушение. У младенцев вызывается, обычно, рвотными массами и первородным калом. Углекислота способствует сокращению легочных тканей, восстановлению их функции.
Применяют медики и углекислый снег. Это те самые кристаллы кислоты , которые получают при низких температурах. Так что, врачам удается увидеть героиню статьи в кристаллическом виде.
Удается это, так же, больным волчанкой, бородавками, лепрозными узлами. Соприкасаясь с кислотным льдом, пораженные участки кожи разрушаются. Грубо говоря, угольная кислота вырезает лишнее, подобно лазеру.
В жидком виде углекислота тоже может выступать хладагентом, используется в морозильном оборудовании. Еще одно поле применения – умягчение воды. Ее, правда, улучшает не чистая кислота, а одна из ее солей – атронная известь.
Цена угольной кислоты
Структурная формула угольной кислоты вмещается промышленниками в баллоны и цистерны. Прежде чем поместить героиню статьи в них, ее охлаждают. Это помогает сгустить вещество.
Предложений купить его единицы. Чаще, реализуют углекислые соединения. За димитилкарбонат, к примеру, просят около 1 500 рублей за килограмм. Вещество растворяет эфиры целлюлозы, а посему, применяется в органическом синтезе.
За натриевую соль, а попросту соду, приходится выкладывать 80-200 рублей за килограмм. Ценники разнятся в зависимости от производителей и добавок к продукту. Так, бывает, к примеру, кальцированная сода.
Если смотреть в глобальных масштабах, угольная кислота бесценна. Именно она является источником углерода для живых материй, причем, единственным. Углерод есть и в нефти, вулканических выбросах.
Элемент составляет ряд минералов, к примеру, графит и алмаз . Но, там элемент непотребен для животных . Они, как и растения, развиваются за счет угольной кислоты.
Есть даже мнение, что атланты – не чудо-люди или пришельцы из космоса, а всего лишь достойные «дети» атмосферы, насыщенной соединением воды и углекислого газа. Но, это теория в стиле «РенТВ». Сосредоточимся на научных фактах.
Роль угольной кислоты в жизни человека , животных, растений, ученые осознали и изучили около 3-ех столетий назад. С тех пор соединение и стали именовать бесценным. Наибольший вклад в изучение углекислоты внес Ян Ингенхоуз.
Голландский химик жил на рубеже 18-го и 19-го веков. Свои исследования Ян сосредоточил на гелиотропизме растений. Так именуют стремление зелени к солнцу , поворот стебля и бутонов в его сторону. Заодно, Ингенхоуз изучил газы, выделяемые растениями. Отсюда, собственно, и «понеслась» тема со значением в жизни трав и жизни вообще углекислоты.

Источник
Угольная кислота. Карбонаты. Жёсткость воды
Урок 27. Химия 9 класс ФГОС
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Угольная кислота. Карбонаты. Жёсткость воды»
Угольная кислота. Карбонаты. Жёсткость воды
Угольная кислота образуется при растворении оксида углерода (IV) в воде. Эта кислота нестойкая и почти сразу распадается на исходные вещества – углекислый газ и воду.
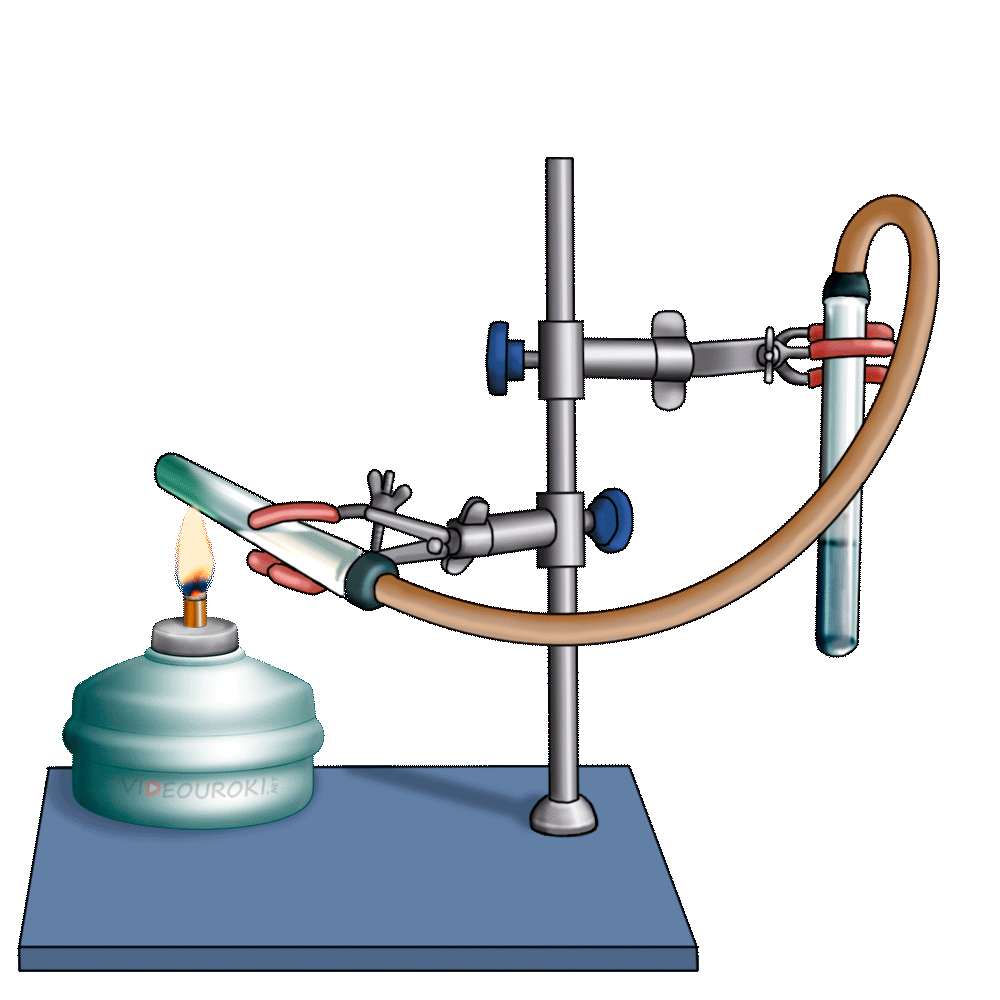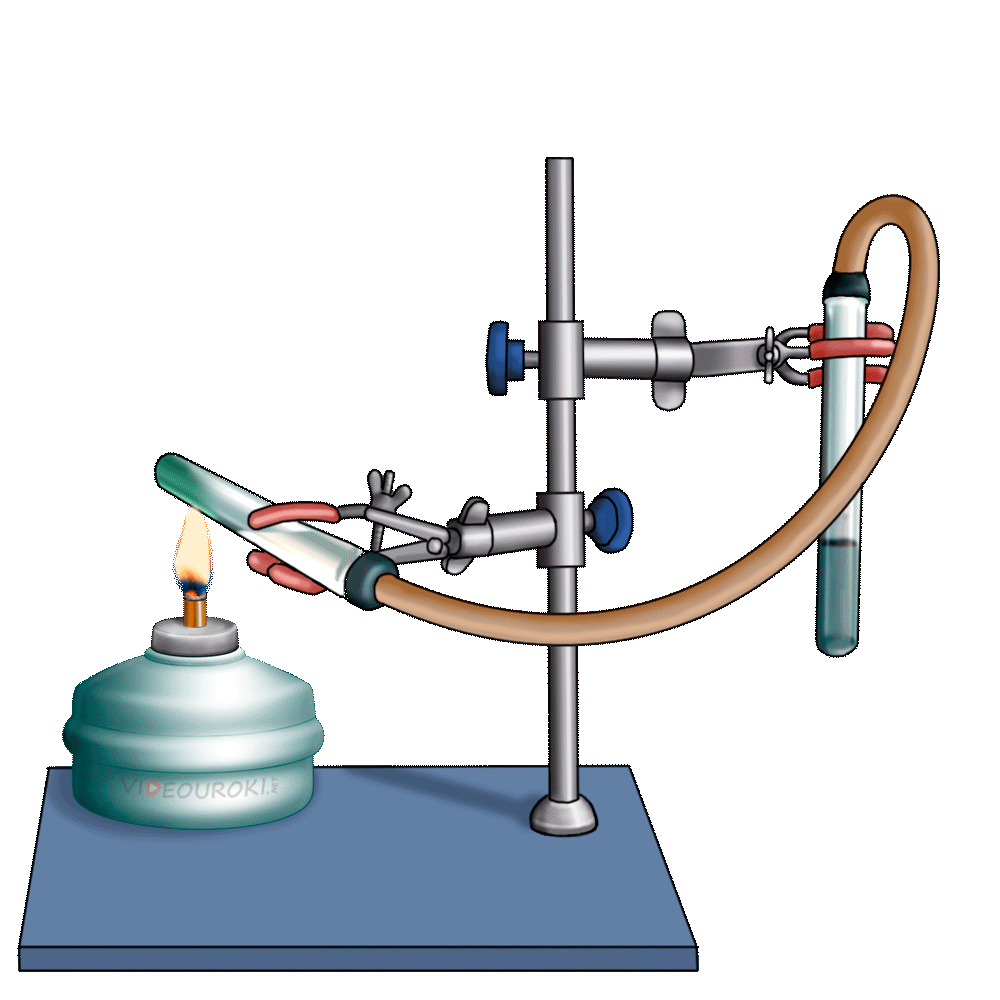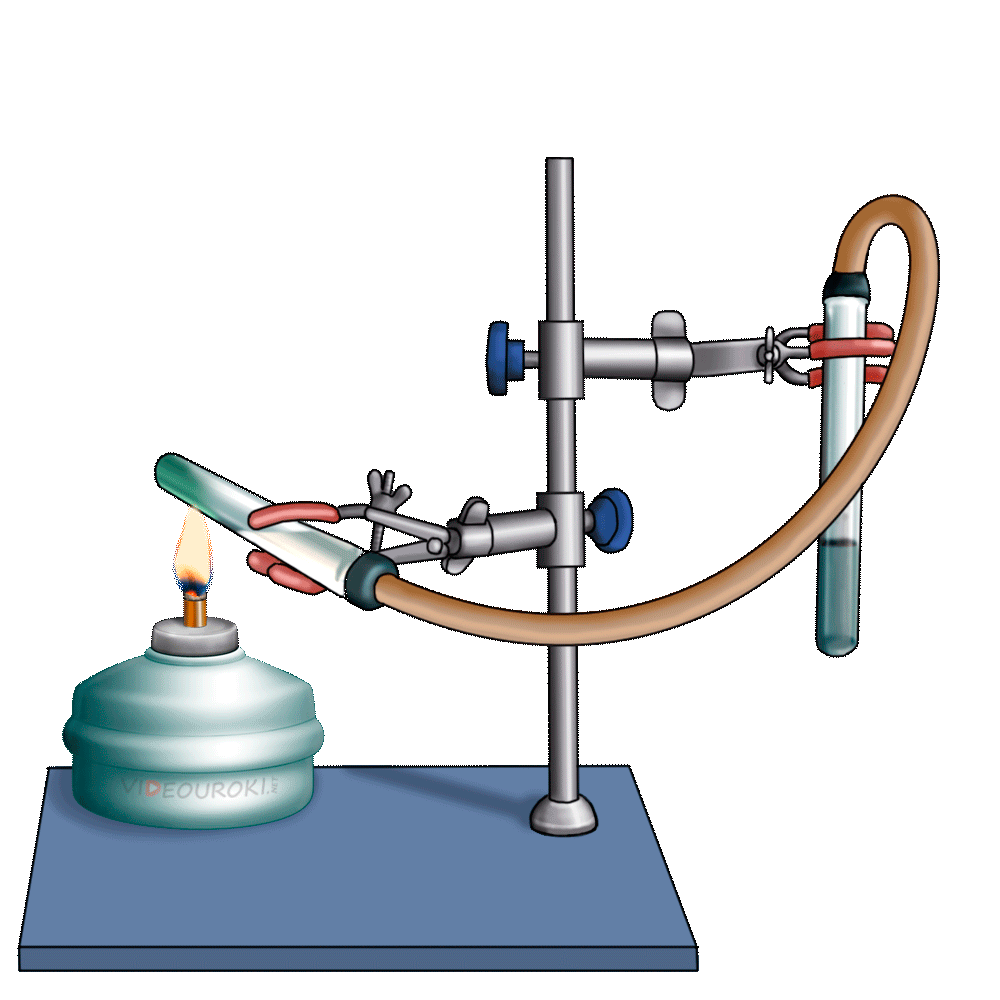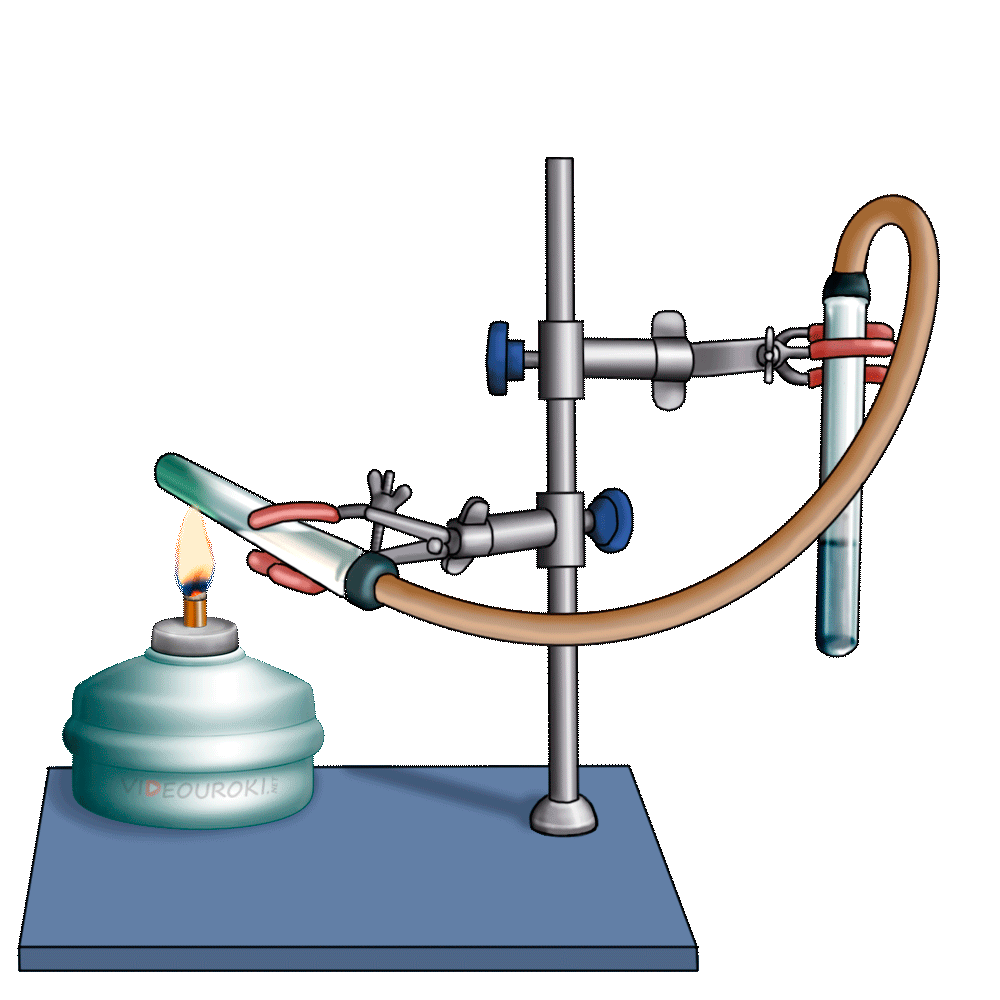
Получим угольную кислоту и исследуем её свойства. Собрав прибор для получения газов и проверив его на герметичность, следует поместить в пробирку кусочки мрамора и прилить соляной кислоты. После чего мы можем наблюдать выделение газа, который следует пропустить через воду с лакмусом. При этом видно, что лакмус изменил окраску с фиолетовой на красную. Но через некоторое время лакмус опять меняет свою окраску с красной на фиолетовую, потому что образовавшаяся угольная кислота является нестойкой и через некоторое время распадается на исходные вещества – углекислый газ и воду.

Как двухосновная кислота угольная кислота диссоциирует по двум ступеням: на первой ступени образуется ион водорода и гидрокарбонат-ион, а на второй – ион водорода и карбонат-ион:
Угольная кислота образует два типа солей: средние – карбоната и кислые – гидрокарбонаты. Например, CaCO3 – карбонат кальция, Ca(HCO3)2 – гидрокарбонат кальция. Из карбонатов в воде растворимы только соли калия, натрия и аммония. Карбонаты других металлов нерастворимы в воде и при нагревании разлагаются на оксид металла и углекислый газ. При разложение карбоната магния образуется оксид магния и углекислый газ, а при разложении карбоната кальция образуется оксид кальция и углекислый газ. При нагревании карбоната аммония образуется аммиак, вода и углекислый газ.
Кислые соли растворимы в воде.
Карбонаты могут превращаться в гидрокарбонаты: если через них пропустить углекислый газ в присутствии воды. Например, если через известковую воду пропускать углекислый газ, то сначала известковая вода мутнеет, вследствие образования карбоната кальция, но при дальнейшем пропускании углекислого газа помутнение исчезает, потому что карбонат переходит в гидрокарбонат.
Наличием гидрокарбонатов кальция и магния в природной воде объясняется её временная жёсткость. В жёсткой воде плохо мылится мыло, трудно стирать бельё, плохо развариваются овощи. Если нагреть растворимый гидрокарбонат кальция, то образуется снова карбонат кальция – нерастворимая в воде соль.
Эта реакция приводит к образованию накипи на стенках котлов, чайников, труб парового отопления. В природе в результате этой реакции в пещерах формируются свисающие вниз сталактиты, навстречу которым снизу вырастают сталагмиты.


Другие соли кальция и магния, такие как хлориды и сульфаты, придают воде постоянную жёсткость. Для её устранения нужно использовать карбонат натрия – Na2CO3 – соду, которая переводит ионы кальция в осадок. Например, в реакции хлорида кальция с карбонатом натрия образуется нерастворимая соль – карбонат кальция и хлорид натрия. Таким образом, карбонат натрия перевёл растворимую соль кальция – хлорид кальция, в нерастворимую – карбонат кальция.
Соду можно использовать и для устранения временной жёсткости.
Качественными реакциями на карбонаты и гидрокарбонаты являются реакции этих солей с кислотами. Например, если в расвтор карбоната натрия добавить соляной кислоты, то происходит «вскипание» раствора, из-за образовавшегося углекислого газа. То же самое можно наблюдать при добавлении соляной кислоты к гидрокарбонату натрия.
Из солей угольной кислоты наиболее широко применяют кристаллическую соду – Na2CO3 ∙ 10H2O, кальцинированную соду – Na2CO3 – в стекольной, мыловаренной, целлюлозно-бумажной, текстильной, нефтеперерабатывающей и других отраслях промышленности, а в быту её используют как моющее средство.
Сода была известна человеку примерно за полторы – две тысячи лет до нашей эры, а может быть и раньше. Её добывали из содовых озёр и извлекали из месторождений. Первые сведения о получении соды путём упаривания воды озёр относятся к шестьдесят четвертому г н. э. и приведены в сочинениях древнеримского врача и ботаника Диоскорида Педания о лекарственных веществах.
Питьевая сода – NaHCO3 – применяется в медицине, хлебопечении, пищевой промышленности, питьевая сода входит в состав наполнителя для огнетушителей.
Карбонат калия, или поташ – K2CO3 – используют для получения мыла, в фотографии, в качестве удобрения, при изготовлении тугоплавкого стекла.
Известняк, или мрамор – CaCO3 – используют в строительстве как облицовочный и строительный материал. Он необходим для получения извести, его вносят в почву для понижения кислотности, мел необходим для побелки, а также в стекольной, резиновой и других областях промышленности.
Таким образом, угольная кислота – это двухосновная слабая неустойчивая кислота, которая образуется при растворении в воде углекислого газа, она диссоциирует по двум ступеням, поэтому образует два типа солей – карбонаты и гидрокарбонаты, карбонаты многих металлов нерастворимы в воде и при нагревании разлагаются, а гидрокарбонаты – это растворимые соли. Карбонаты можно перевести в гидрокарбонаты и наоборот. Для перевода карбоната в гидрокарбонат через карбонат пропускают углекислый газ в воде, а при нагревании гидрокарбонатов образуются карбонаты. Различают временную и постоянную жёсткость. Временная жёсткость обусловлена наличием гидрокарбонатов кальция и магния и устраняется кипячением, постоянная жёсткость обусловленая наличием других солей кальция и магния, и устраняется добавлением соды. Качественными реакциями на карбонат и гидрокарбонат-ион является действие кислот на эти соли, при этом наблюдается бурное выделение углекислого газа. Карбонаты и гидрокарбонаты многих металлов находят широкое применение во многих отраслях народного хозяйства.
Источник