- Соли жесткости
- LiveInternetLiveInternet
- —Видео
- —Поиск по дневнику
- —Подписка по e-mail
- —Статистика
- Жесткость воды. Соли жесткости.
- Различают следующие виды жесткости воды.
- Измерение жесткости воды
- По значению общей жесткости природные воды делят на группы:
- Регулярное использование жесткой воды в гигиенических и пищевых целях имеет целый ряд негативных последствий.
Соли жесткости
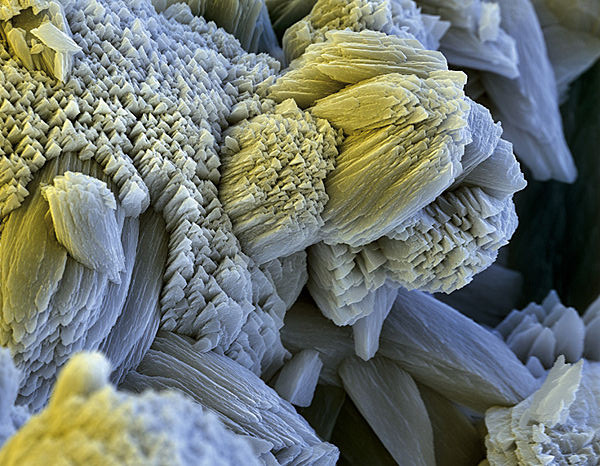
Постоянная (некарбонатная жесткость) – сульфаты, хлориды и нитраты магния и кальция растворенные в воде. Они выпадают в осадок исключительно при полном испарении воды, поэтому образуют постоянную жесткость.
Карбонатная жесткость – это соли магния и кальция, растворенные в воде. Такую жесткость называют также временной, так как в процессе нагревания вода выпадает в осадок в виде накипи.
Как образуются соли жесткости в воде?
Источниками солей жесткости является сама природы. Проходя через известковые породы, грунтовые воды вымывают и растворяют минеральные вещества, соли магния и кальция в том числе. Таким образом, уже в момент забора вода имеет повышенную жесткость. Зачастую показатель жесткости полученной из скважин воды превышает уровень жесткости воды городских водопроводных систем.
Чем опасны соли жесткости в воде?
Соли жесткости отвечают за образование накипи в чайнике, известковых отложений на сантехнике, нагревательных элементах стиральных машин. Отлагаясь в системах горячего водоснабжения и отопления соли жесткости раньше положенного срока выводят из строя бойлеры, приводят к перерасходу энергоносителей. Слой накипи толщиной 1.5 мм способен уменьшить теплопередачу до 15%,3 ммна 25%, 10 мм – до 50% потерь тепла. Более того, накипь – химически активное вещество, разъедающее прокладки и уплотнения. При этом отслоившиеся частицы начинают «путешествовать» по системе водоснабжения, попадают в приборы автоматики, в краны, зачастую выводят их из строя. В большей степени от зарастания этими частицами страдают устройства с маленькими отверстиями – гидромассажные насадки в джакузи, разбрызгивающие головки посудомоечных и стиральных машин, душевые сетки.

Учитывая тот факт, что кожа дышит через поры,и через них же выводятсяи шлаки, содержащийся в жесткой воде кальций в избытке, соединяясь с этими выделениями, закупоривает поры. Чем большим будет уровень жесткости, тем более опасной будет закупорка. Под кожей могут образоваться кристаллы кальция — именно та накипь, которую мы наблюдаем в чайниках.
При постоянном употреблении внутрь воды с повышенной жесткостью снижается моторика желудка, происходит накопление солей, и как следствие, развиваются заболевания суставов – артриты, полиартриты.
Следует отметить, что очень мягкая вода также опасна, как и излишне жесткая. Наиболее активна мягкая вода. Она способна вымывать кальций из костей, провоцировать развитие рахита. Если употреблять такую воду с детства, то во взрослом возрасте станут ломкими кости. Проходя через пищеварительный тракт, вода вымывает не только минеральные, но и полезные органические вещества, полезные бактерии в том числе. Поэтому жесткость воды должна быть не меньше 1.5-2 мг-экв/л.
Предельно допустимые концентрации солей жесткости в воде

- Очень мягкая вода – до 1.5 мг-экв/л
- Мягкая вода – 1.5-4 мг-экв/л
- Вода средней жесткости – 4-8 мг-экв/л
- Жесткая вода – 8-12 мг-экв/л
- Очень жесткая вода -более 12 мг-экв/л.
Согласно нормам СанПиН 2.1.4.1074-01 жесткость воды для хозяйственно-питьевых целей не должна превышать 7-10 мг-экв/л (или 350 мг/л).
Методы очистки воды от солей жесткости
На сегодняшний день большинство бытовых систем очистки воды от солей жесткости основаны на принципе ионного обмена. Фильтром ионного обмена,через который проходит поток воды, служат гранулированные компоненты умягчения воды. В процессе протекания воды через слой гранул ионообменной смолы, которые умягчают воду, осуществляется удаление солей жесткости. Таким образом, вода приобретает мягкость и становится пригодной для использования в бытовых целях.
Многие мировые производители устройств по очистке воды отдают предпочтение методу ионного обмена. Ионообменные смолы – это маленькие полимерные шарики, насыщенные ионами, так называемыми, ионитами. Иониты извлекают из воды разные ионы и отдают взамен свои. Особенностью ионообменных смол является влажность, химически связанная в смоле, объемная и весовая (определяется стандартными методами), а также рабочая ионообменная (зависит от свойств растворов, слоя смолы) емкости.
Вода, насыщенная ионами магния и кальция, проходит через ионообменную смолу, отдает ей собственные ионы и забирает ионы натрия, не образующие отложений.
Электрохимический метод очистки воды
В основе данного метода лежат сложные окислительно-восстановительные реакции, а также, электрохимическая активация воды в электрическом поле, происходящая в процессе воздействия на нее сильного электрического тока.В результате таких процессов образуется «живая» и «мертвая» вода. Электрохимическая активация провоцирует переход воды в метастабильное состояние, для которого характерны аномальные значения активности электронов и прочих физико-химических параметров.
При протекании постоянного электрического тока через воду, поступление в воду у катодаи удаление электронов из воды у анода происходит наряду с электрохимическимиреакциями на поверхности катода и анода. Это провоцирует образование новых веществ, трансформацию системы межмолекулярных воздействий, состава и структуры воды как раствора.
Получить такую воду удается при помощи диафрагменного проточного электрохимического состава, в составе которого специальная мембрана, так называемая диафрагма, разделяющая воду катода и воду анода. Особенность состава электродов (катода и анода) в том, что они способны обмениваться исключительно электронами.
Возможность добиться высокой производительности при малых затратах делает данный метод довольно экономичным. Если в России электрохимическая очистка воды широко распространена, то на Западе применима только в промышленных целях.Дело в том, что данный метод, несмотря на способность очищать воду от примесей, опасен протеканием деструктивных процессов в воде. Более того, если нет точных данных о составе исходной воды, неизвестно как прореагируют между собой находящиеся в ней вещества под воздействием сильного электрического тока. В результате таких реакций возможно образование опасных для организма соединений, радикалов и прочих.
Метод магнитной обработки воды
Магнитные приборы действуют по следующему принципу: происходит магнитное взаимодействие находящихся в воде ионов металлов (магнитный резонанс) и параллельно протекает процесс химической кристаллизации. Под воздействием постоянных магнитов с сильным магнитным полем, растворенные в воде ферромагнитные частицы становятся центрами электрохимической кристаллизации, связывая ионы магния и кальция – основныекомпоненты жесткости воды. Магнитная обработка воды – это абсолютно экологически чистый метод, так как не предполагает применение химических реактивов. Метод наиболее эффективен в борьбе с солями жесткости и образованием накипи. Суть метода состоит в следующем: при продвижении воды через магнитные силовые линии катионы солей жесткости выделяются в массе воды, а не на поверхности нагрева. Такая система актуальна при обработке вод кальциево-карбонатного класса, что составляет порядка 80% всех водоемов России.

Большую популярность среди устройств очистки воды от солей в настоящее время приобрели фильтры, функционирующие по принципу обратного осмоса. Такие фильтры оснащены специальной мембраной, через которую осуществляется движение воды из более концентрированного раствора в сторону менее концентрированного.
В том случае, если с обеих сторон полупроницаемой мембраны будут находиться солесодержащие растворы с различной концентрацией, через мембрану молекулы воды будут перемещаться из слабо концентрированного в более концентрированный раствор, повышая в последнем уровень жидкости. Вследствие осмоса, проникновение воды через мембрану происходит даже при условии одинакового внешнего давления для обоих растворов. Разница в высоте уровней двух растворов различной концентрации определяет силу, под действием которой вода поступает через мембрану. Такая сила представляет собой «осмотическое давление».
Если на раствор с большей концентрацией оказывается внешнее давление, которое превышает осмотическое, молекулы будут двигаться через мембрану в обратном направлении -из более концентрированного в менее концентрированный раствор.
Данный процесс называется обратным осмосом. Такой принцип работы характерен для всех мембран обратного осмоса. При обратном осмосе вода и вещества, растворенные в ней, разделяются на молекулярном уровне. Таким образом, с одной стороны мембраны образуется абсолютно чистая вода, а с другой стороны остаются все загрязнения. Тем самым, обратный осмос обеспечивает более высокий уровень очистки, чем другие традиционные методы фильтрации.
Источник
LiveInternetLiveInternet
—Видео
—Поиск по дневнику
—Подписка по e-mail
—Статистика
Жесткость воды. Соли жесткости.
Вторник, 08 Сентября 2015 г. 08:49 + в цитатник
Жёсткость воды — это совокупность химических и физических свойств воды, связанных с содержанием в ней растворённых солей щёлочноземельных металлов, главным образом кальция и магния (соли жесткости). Чем выше концентрация солей жесткости в воде, тем жесткость воды выше. Происхождение жесткости воды.
Ионы кальция (Ca2+) и магния (Mg2+), а также других щелочноземельных металлов, обуславливающих жесткость воды, присутствуют во всех минерализованных водах. Они поступают в воду в результате взаимодействия растворенного диоксида углерода с минералами и при других процессах растворения и химического выветривания горных пород.
Источником этих ионов могут служить также микробиологические процессы, протекающие в почвах на площади водосбора, в донных отложениях, а также сточные воды различных предприятий.
Жёсткость воды в пресных природных водоёмах величина непостоянная и меняется относительно сезона. Жёсткость воды может увеличиваться из-за испарений и уменьшаться в сезон дождей, таяния снега и льда (например, жёсткость волжской воды в марте — 4,3 мг-экв/л, в мае — 0,5 мг-экв/л).
В артезианских скважинах и глубоких колодцах вода жёстче, чем в озёрах, прудах и реках. Источником солей жесткости являются природные залежи известняков, гипса и доломитов. Содержание солей жесткости подземных вод зависит от залегания подземного горизонта и меняется от 100-200 мг/л до нескольких граммов на литр.
Различают следующие виды жесткости воды.
- Общая жесткость воды.
Определяется суммарной концентрацией ионов кальция и магния. Представляет собой сумму карбонатной (временной) и некарбонатной (постоянной) жесткости.
- Карбонатная жесткость воды.
Обусловлена наличием в воде гидрокарбонатов и карбонатов (при рН>8.3) кальция и магния. Данный тип жесткости почти полностью устраняется при кипячении воды и поэтому называется временной жесткостью. При нагреве воды гидрокарбонаты распадаются с образованием угольной кислоты и выпадением в осадок карбоната кальция и гидроксида магния.
- Некарбонатная жесткость воды.
Обусловлена присутствием кальциевых и магниевых солей сильных кислот (серной, азотной, соляной) и при кипячении не устраняется (постоянная жесткость).
Измерение жесткости воды
Для численного выражения жёсткости воды указывают концентрацию в ней катионов солей жесткости — кальция и магния. Рекомендованная единица СИ (SI, фр. Le Système International d\’Unités — международная система единиц, современный вариант метрической системы) для измерения концентрации — моль на кубический метр (моль/м³), однако, на практике для измерения жёсткости чаще используется миллимоль на литр (ммоль/л). В разных странах используются различные внесистемные единицы — градусы жёсткости.
В России жёсткость воды измеряется в мг-экв/л (миллиграмм-эквивалент на литр) жесткости. 1 мг-экв/л жёсткости соответствует 20,04 мг Са2+ (ионы кальция) или 12,16 мг Mg2+ (ионы магния).
По значению общей жесткости природные воды делят на группы:
- очень мягкая вода (0–1,5 мг-экв/л)
- мягкая вода (1,5–4 мг-экв/л)
- вода средней жесткости (4–8 мг-экв/л)
- жесткая вода (8–12 мг-экв/л)
- очень жесткая вода (более 12 мг-экв/л).
По нормам ВОЗ оптимальная жесткость воды составляет 1,0-2,0 мг-экв/л. Российские СанПиН (Санитарные Правила и Нормы) запрещают централизованное снабжение водой, содержащей \»соли жесткости\» в концентрациях, превышающих 7 мг-экв./литр.
Регулярное использование жесткой воды в гигиенических и пищевых целях имеет целый ряд негативных последствий.
- наилучшие вкусовые свойства вода имеет при жесткости 1,6–3,0 мг-экв/л (мягкая вода)
- жесткая питьевая вода горьковата на вкус и оказывает отрицательное влияние на органы пищеварения
- использование для питья жёсткой воды с большим содержанием кальциевых солей может способствовать развитию мочекаменной болезни, способствует избыточному отложению солей в организме;
- в жёсткой воде значительно дольше варятся некоторые продукты (например мясо и бобовые), так как ионы кальция образуют с белками пищевых продуктов нерастворимые соединения;
- жёсткая вода с высоким содержанием кальция и магния портит не только цвет, но и вкусовые качества чая и кофе;
- плохая вспениваемость жёсткой воды ведёт к перерасходу моющих средств;

Стирка в жёсткой воде доставляет множество неприятностей : сложно достигнуть эффекта отбеливания, невозможно качественно отполоскать бельё. Это приводит к потере исходного цвета ткани: белые ткани приобретают сероватый оттенок, цветные – тускнеют; — жёсткая вода негативно влияет на состояние кожи (при умывании кожа пересушивается, что может вызывать зуд и раздражение);
Мытьё головы жёсткой водой способствует сухости волос, что является предрасполагающим фактором развития перхоти, кожных заболеваний и, в конечном итоге, ломкости и потере определённого количества волос;
Но, конечно, основные неприятности, связанные с жесткой водой – от накипи.
Чтобы снизить жесткость, воду умягчают.
Умягчение воды — снижение (до заданных пределов) жёсткости воды природных источников удалением из неё солей кальция и магния (солей жесткости).
Источник




