Химия, Биология, подготовка к ГИА и ЕГЭ
Гидролиз солей
Гидролиз — это взаимодействие солей с водой. Многие думают, что гидролиз — это когда в условии написано «прилили воду». И это тоже 🙂 Но если нам дан раствор соли, то это значит, что эта самая соль уже вступила во взаимодействие с водой.
Вот стоит стакан с раствором какой-то соли. Если очень повезет, то раствор может быть даже цветным. Соль в растворе находится в виде ионов — т.е. она уже провзаимодействовала с водой — продиссоциировала на ионы.
Тема гидролиза довольно обширная и в данном курсе мы рассмотрим ее только в формате подготовки к ЕГЭ. Поступите в ВУЗы, будете изучать степени гидролиза, константы и т.д.
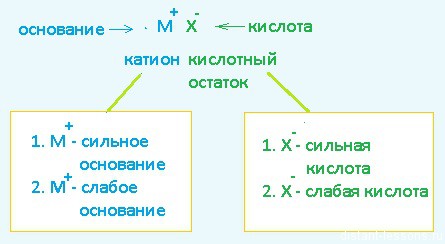
Любая соль состоит из двух составляющих — катиона (металла, например) и аниона — кислотного остатка. Классический пример образования соли — взаимодействие основания и кислоты.
основание + кислота = соль + H2O
Давайте рассмотрим эту схему на конкретных примерах
Слабые кислоты:
- H2S — сероводородная кислота. Считается слабой, т.к. плохо растворима в воде — легко улетучивается из раствора, ее запах тухлых яиц ни с чем не перепутаешь! 🙂 Она очень слабо диссоциирует на ионы.
- H2CO3 — угольная кислота. Тоже слабая, неустойчивая кислота, очень быстро распадается на CO2 и H2O
- H2SiO3 — кремниевая кислота. Ну это вообще твердое вещество .
- Все органические кислоты считаются слабыми
Слабые основания:
- мало- и нерастворимые гидроксиды ( см. таблицу растворимости )
- NH4OH — cлабое основание, т.к. легко разлагается на NH3 (улетучивается из раствора) и H2O
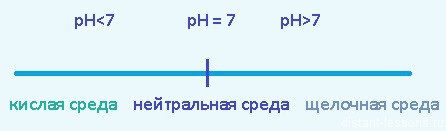
pH — водородный показатель — показатель количества ионов водорода H(+) в растворе
1.1 Соль образована сильным основанием и сильной кислотой
NaCl — соль образована сильным основание NaOH и сильной кислотой HCl.
Такие соли не гидролизуются, нейтральная среда раствора , pH примерно = 7
1.2 Соль образована сильным основанием и слабой кислотой
Na2S — соль образована сильным основанием NaOH и слабой кислотой H2S.
Давайте посмотрим, что происходит при взаимодействии такой соли с водой:
Na2S + H2O =2NaOH + H2S
2Na(+) + S(-2) + H2O =2Na(+) + 2OH(-) + H2S — полное ионное уравнение
в растворе остались ионы Na(+) и OH(-) — щелочная среда, pH>7
Это гидролиз по аниону
2.1 Соль образована слабым основанием и сильной кислотой
CuCl2 — соль образована нерастворимым в воде основанием Cu(OH)2 и сильной кислотой HCl
CuCl2 + H2O = Cu(OH)2 ↓ + 2HCl
Сu(2+) +2Cl(-) + H2O = Cu(OH)2↓ + 2H(+) + 2Cl(-) — полное ионное уравнение
в растворе остались ионы H(+) и Cl(-) — кислая среда, pH 2.2 Соль образована слабым основанием и слабой кислотой
(NH4)2S — соль образована слабым основанием NH4OH и слабой кислотой H2S
(NH4)2S + H2O =2NH3↑ + H2O + H2S↑
осталась только вода H2O — нейтральная среда, pH=7
Это гидролиз и по катиону, и по аниону
Есть очень простое для запоминания правило — что слабое, по тому идет гидролиз.
- Слабое основание — гидролиз по катиону
- Слабая кислота — гидролиз по аниону
- Слабая кислота и слабое основание — гидролиз и по катиону, и по аниону
- Все сильное — гидролиз не идет
Источник
Соли реагирующие с водой
Гидролизом называются химические реакции взаимодействия заряженных частиц растворенной соли с водой, где вода проявляет амфотерные свойства, в результате чего образуются малодиссоциирующие соединения. В результате гидролиза солей среда может оказаться кислой, щелочной или нейтральной.
Если рассматривать соли как продукты взаимодействия кислот с основаниями, то в зависимости от их силы различают четыре типа солей:
1) Соли, образованные сильной кислотой и сильным основанием, например NaCl. Соли данного типа не подвергаются гидролизу, так как при взаимодействии с водой не происходит образования малодиссоциированных соединений.
2) Соли образованные слабой кислотой и сильным основанием, подвергаются гидролизу по аниону, например:
Na2CO3 → 2Na + + CO3 2-
H2O 
H + + CO3 2- 
H + + HCO3 — 
CO3 2- + 2H2O 
Как правило, если в системе нет катионов слабого основания, гидролиз останавливается на первой ступени, т.к. образующиеся гидроксид-ионы препятствуют дальнейшему гидролизу (по принципу Ле Шателье).
3) Соли, образованные сильной кислотой и слабым основанием, подвергаются гидролизу по катиону, например:
NH4Cl → NH4 + + Cl —
H2O 
NH4 + + OH — 
NH4 + + H2O 
H2O 
NH4 + + OH — 
S 2- + H + 
HS — + H + 
(NH4)2S + 2H2O 
Количественно гидролиз характеризуется двумя величинами: степенью гидролиза и константой гидролиза.
Степень гидролиза показывает, какая часть от общего количества растворенной в воде соли подверглась гидролизу. Степень гидролиза очень часто выражают в процентах:
Константа гидролиза – величина, равная произведению констант всех стадий, из которых складывается процесс гидролиза с учетом стехиометрических коэффициентов. Например:
NH4Cl → NH4 + + Cl — ;
H2O 
NH4 + + OH — 
NH4 + + H2O 
Чем выше величина константы, тем сильнее соль подвергается гидролизу.
Источник
Взаимодействие солей с водой, в результате которого образуются кислота (или кислая соль), и основание (или основная соль), называется гидролизом солей



Гидролиз солей
Правило направления протекания ионных реакций: реакции между ионами в растворах электролитов идут практически до конца в сторону образования осадков, газов и слабых электролитов.
Гидролизу подвергаются соли образованные:
— слабым основанием и сильной кислотой (например, MgCl2, CuSO4), и гидролиз идет по катиону, т.к. молекулы слабого электролита образуются за счет катионов;
— слабой кислотой и сильным основанием (например, Na2CO3, K2S, CH3COONa), и гидролиз идет по аниону, т.к. молекулы слабого электролита образуются за счет анионов;
— слабым основанием и слабой кислотой (например, NH4CN, CH3COONH4), и гидролиз идет по аниону и катиону, т.к. молекулы слабого электролита образуются за счет анионов и катионов.
Соли, образованные сильным основанием и сильной кислотой (например, NaCl, Na2SO4, KNO3) гидролизу не подвергаются , т.к. в этом случае не образуются молекулы слабого электролита.
Уравнения реакций гидролиза пишутся аналогично другим ионным уравнениям: малодиссициированные (в том числе вода) и малорастворимые, а также газообразные продукты гидролиз и исходные вещества пишутся в виде молекул, сильные электролиты записываются в ионной форме. Краткое ионное уравнение показывает какие ионы (Н + или ОН – ) накапливаются в растворе данной соли при растворении, что позволяет определить реакционную среду рассматриваемой соли.
Так, если в кратком ионном уравнении имеются ионы Н + , то реакция среды раствора этой соли кислая, а гидролиз будет идти по катиону. Если в кратком ионном уравнении имеются ОН – , то реакция среды раствора этой соли щелочная, а гидролиз будет идти по аниону. Если же краткое ионное уравнение показывает, что в растворе присутствуют и ионы Н + и ОН – , то реакция среды нейтральная, а гидролиз будет идти и по и аниону и по катиону.
Пример. Составить уравнение гидролиза ацетата натрия СН3СООNа (соль сильного основания и слабой кислоты) и определить реакцию среды в растворе этой соли.
– запишем уравнение реакции гидролиза в молекулярной форме:
СН3СООNа + Н2О 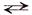
(образовался слабый электролит – уксусная кислота)
– составим полное ионное уравнение данной реакции:
СН3СОО – + Nа + + Н2О 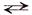
– составим краткое ионное уравнение данной реакции:
СН3СОО – + Н2О 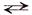
Краткое ионное уравнение гидролиза показывает, что в растворе накапливаются ионы ОН – и реакция среды будет щелочной (рН > 7).
Пример. Составить уравнение гидролиза хлорида железа (II) – соли слабого основания и сильной кислоты, определить реакцию среды в растворе этой соли.
FеСl2 + Н2O 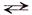
Fе 2+ + 2Сl – + Н2O 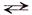
Fе 2+ + Н2O 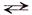
По второй ступени гидролиз протекает следующим образом:
Fе(ОН)Сl + Н2O 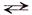
Fе(ОН) – + Сl – + Н2O 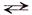
Fе(ОН) – + Н2O 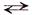
Краткое ионное уравнение гидролиза показывает, что в растворе накапливаются ионы Н + и реакция среды будет кислой (рН 7;
— если соль образована слабым основанием и сильной кислотой, то рН – и кислотного остатка, например, FеОНСl2 – гидроксохлорид железа III);
— при гидролизе солей, образованных слабой многоосновной кислотой и сильным основанием, образуются кислые соли (содержащие анионы кислотного остатка, катионы металла и Н + , например, КНСО3 – гидрокарбонат калия).
Гидролиз по второй и, особенно, по третьей ступени выражен незначительно.
Пример. Составить уравнения гидролиза и определить реакцию среды в растворе хлорида железа (III).

Реакция гидролиза FеСl3 проходит в три стадии, так как заряд иона железа равен 3+:
1) составим молекулярное, полное и краткое ионное уравнение первой ступени гидролиза:
— молекулярное уравнение: FеСl3 + НОН ↔ FеОНСl2 + НСl
— полное ионное уравнение: Fе 3+ + 3Cl – + НОН ↔ (FеОН) 2+ + 2Сl – + H + + Сl –
— краткое ионное уравнение: Fе 3+ + НОН ↔ (FеОН) 2+ + H +
2) составим молекулярное, полное и краткое ионное уравнение второй ступени гидролиза:
— FеОН 2+ + 2Сl – + НОН ↔ (Fе(ОН)2) + + Сl – + H + + Сl –
— FеОН 2+ + НОН ↔ (Fе(ОН)2) + + H +
3) составим молекулярное, полное и краткое ионное уравнение третьей ступени гидролиза:
— Fе(ОН)2 + + Сl – + НОН ↔ Fе(ОН)3↓ + H + + Сl –
4) общее уравнение реакции гидролиза в молекулярной полной и краткой ионной форме имеет вид:
— Fе 3+ + 3Сl – + 3НОН ↔ Fе(ОН)3↓ + 3H + + 3Сl –
— Fе 3+ + 3НОН ↔ Fе(ОН)3↓ + 3H +
Таким образом, гидролиз соли, образованной слабым трехкислотным основанием и сильной кислотой идет по катиону в три стадии, а накопление ионов H + приводит к тому, что рН – + HOH → OH – + HCN
Концентрация недиссоциированных молекул воды постоянна, тогда
Так как [H + ][ОН – ] = Кводы, то [ОН – ] = Кводы / [H + ], и преобразуя константу гидролиза получим:
Аналогично, константа гидролиза соли слабого основания и сильной кислоты выражается соотношением ионного произведения воды и константы диссоциации соответствующего основания: КГ = Кводы / Коснования
Источник