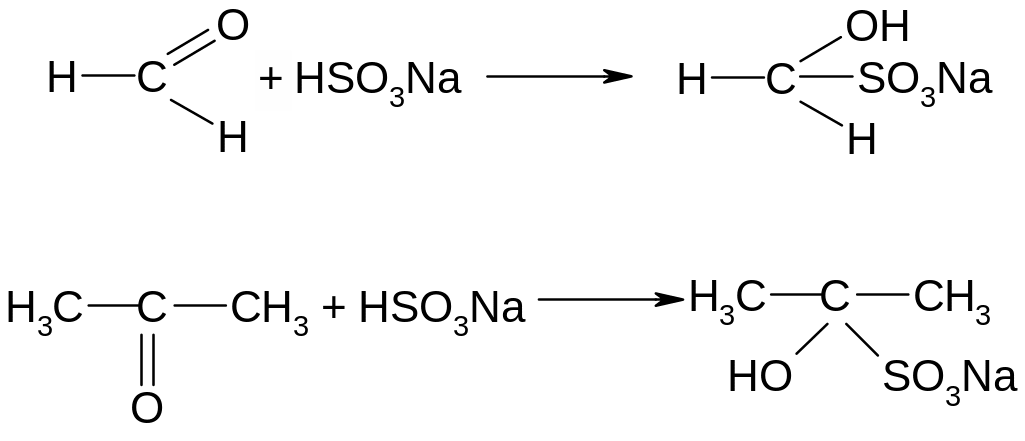
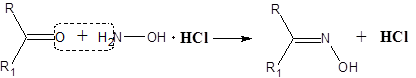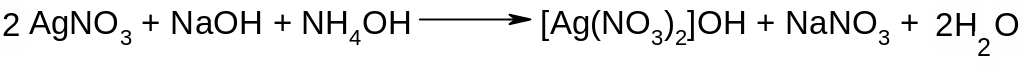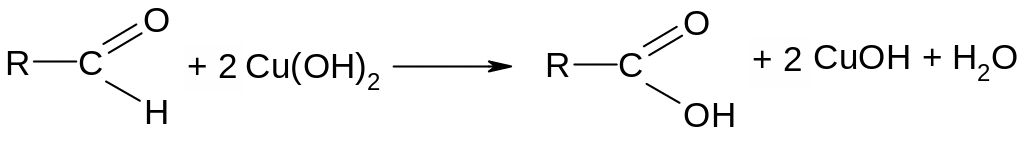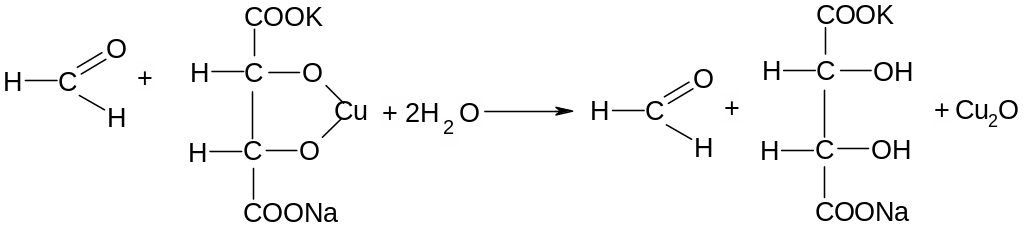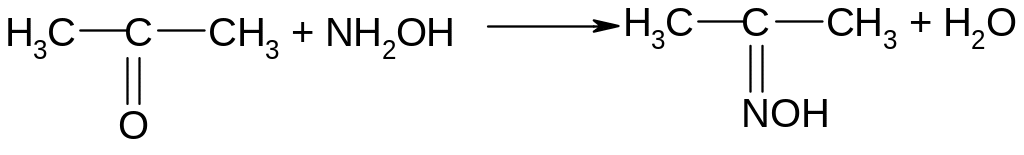Реакция с солянокислым гидроксиламином



Реакция гидроксиламина с пространственно незатрудненной карбонильной группой также является весьма общей:
Так как солянокислый гидроксиламин обладает практически нейтральной реакцией, а образующийся оксим не является сильным основанием, то ход реакции легко контролировать по увеличению кислотности среды за счет выделения хлористого водорода.
Методика проведения:к 2 см 3 3%-ного солянокислого гидроксиламина в пробирке прибавляют раствор 0,1 г исследуемого вещества в 0,5 см 3 этанола. Нагревают смесь на водяной бане. Добавляют одну каплю метилового оранжевого. Если исследуемое вещество содержит карбонильную группу, наблюдается отчетливое покраснение индикатора. Реакции мешают карбоновые кислоты, реагирующие с гидроксиламином. В их отсутствии легко убедиться, проверив исследуемый раствор на лакмус.
Источник
Большая Энциклопедия Нефти и Газа
Раствор — солянокислый гидроксиламин
Растворы солянокислого гидроксиламина и перхлората натрия очищают от железа. [1]
Раствор солянокислого гидроксиламина нейтрализуют титрованием его раствором едкого натра до появления желтого окрашивания. [2]
Раствор солянокислого гидроксиламина получают растворением 60 г соли в 1 л воды. [3]
Раствор солянокислого гидроксиламина приготовляется растворением 4 5 г этого вещества в 100 мл этилового или изопропилового спирта. Прибавляется от 5 до 10 капель к 100 мл пробы после приведения рН к нужной величине. Иногда солянокислый гидроксиламин вводят в раствор индикатора при приготовлении. Одновременно титруются барий, кадмий, свинец, стронций, цинк, кобальт и никель. [4]
Раствор солянокислого гидроксиламина обычно требует очистки. [5]
Раствор солянокислого гидроксиламина предварительно очищают от железа. К 25 мл 10 % — ного водного раствора гидроксиламина в делительной воронке прибавляют 0 5 мл 0 5 % — ного водного раствора о-фенантролина, ОД мл 2 5 М раствора перхлората лития или натрия и 5 мл нитробензола и взбалтывают 1 мин. [6]
Раствор солянокислого гидроксиламина должен быть нейтральным по метиловому оранжевому; в противном случае его предварительно точно нейтрализуют. [7]
Раствор солянокислого гидроксиламина приготовляется растворением 4 5 г этого вещества в 100 мл этилового или изопропилового спирта. Прибавляется от 5 до 10 капель к 100 мл пробы после приведения рН к нужной величине. Иногда солянокислый гидроксиламин вводят в раствор индикатора при приготовлении. Барий, кадмий, свинец, стронций, цинк, кобальт и никель не маскируются. [8]
Раствор солянокислого гидроксиламина предварительно очищают от железа. К 25 мл 10 % — ного водного раствора гидроксиламина в делительной воронке прибавляют 0 5 мл 0 5 % — ного водного раствора о-фенантролина, 0 1 мл 2 5 М раствора перхлората лития или натрия и 5 мл нитробензола и взбалтывают 1 мин. [9]
Раствор солянокислого гидроксиламина , нейтрализованного эквивалентным количеством карбоната натрия, добавляют медленно при перемешивании к горячему раствору дитиооксамида в метаноле. После кипячения в течение 30 мин на паровой бане раствор упаривают наполовину и охлаждают. Выделившееся кристаллическое вещество отфильтровывают и перекристаллизовывают из воды с применением активированного угля. [10]
Сначала готовят раствор солянокислого гидроксиламина , для чего в мерной колбе, емкостью 100 мл, растворяют в воде 7 г этого реактива. Доведя приливанием воды содержимое колбы до метки, определяют кислотность полученного раствора ( в 15 мл этого раствора, доведенных водой до 50 мл) путем титрования 0 1 н раствором едкого натра с бромфеколовым синим до появления синего оттенка и раствор сохраняют в качестве эталона окраски. [11]
Сначала готовят раствор солянокислого гидроксиламина , для чего в мерной колбе, емкостью 100 мл, растворяют в воде 7 г этого реактива. Доведя приливанием воды содержимое колбы до метки, определяют кислотность полученного раствора ( в 15 мл этого раствора, доведенных водой до 50 мл) путем титрования 0 1 н раствором едкого натра с бромфеноловым синим до появления синего оттенка и раствор сохраняют в качестве эталона окраски. [12]
Чтобы получить раствор солянокислого гидроксиламина , 27 8 г NH OH — HCl растворяют в 300 мл очищенного метилового спирта и разбавляют до 1 л очищенным изопропиловым спиртом. [13]
Добавляют 1мл раствора солянокислого гидроксиламина и встряхивают в течение 1 мин с 5 мл раствора дитизона ( — 8 у Hg) s затемненном помещении. Фазы разделяют и водную фазу последовательно встряхивают с порциями раствора дитизона до тех пор, пока экстракт не окрасится в зеленый цвет. Добавляют 10 мл раствора бромида калия и энергично встряхивают в течение, 45 сек, чтобы перевести ртуть в водную фазу. Органическую фазу отбрасывают, а водную промывают несколькими миллилитрами хлороформа и тщательно удаляют последний. [14]
Добавляют по каплям раствор солянокислого гидроксиламина до исчезновения цвета перманганата. [15]
Источник
Лабораторная работа № 7.
ТЕМА: КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ (АЛЬДЕГИДЫ И КЕТОНЫ).
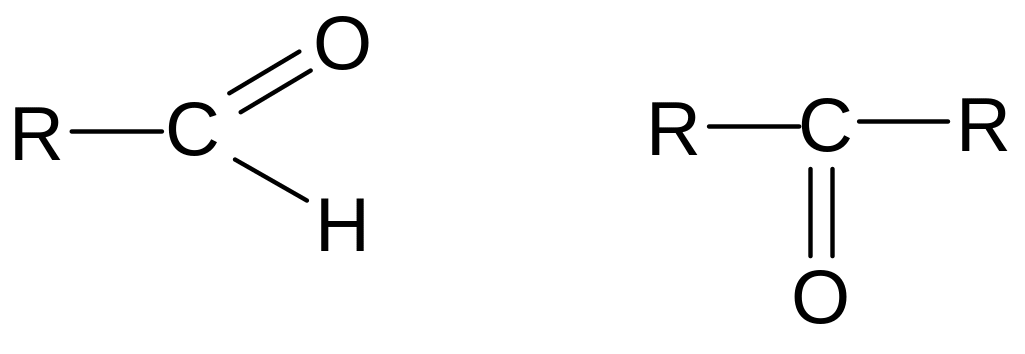
Альдегиды и кетоны – это органические вещества, содержащие карбонильную группу С=О. В альдегидах карбонильная группа соединена с водородом и радикалом, а в кетонах – с двумя радикалами:
Альдегиды и кетоны являются изомерами, их общая формула СnH2nО. Изомерия альдегидов и кетонов зависит от изомерии углеродного скелета, а у кетонов — и от положения карбонильной группы. Названия альдегидам даются, добавляя окончание -аль, а к кетонам – окончание –он. Нумерацию атомов углерода начинают с альдегидной группы, а у кетонов – со стороны, ближайшей к карбонилу, указывая в названии его положение цифрой.
Альдегиды и кетоны – сильно полярные соединения, для них характерна реакция нуклеофильного присоединения АN по карбонильной группе. Кетоны менее реакционноспособны, т.к. алкильные радикалы, имея электроноотталкивающее действие (положительный индуктивный эффект +I) компенсируют в некоторой степени частичный положительный заряд (δ + )на карбонильном атоме углерода.
Альдегиды окисляются до карбоновых кислот, они дают пробу Толленса (реакция серебряного зеркала) с аммиачным раствором оксида серебра и пробу Троммена со щелочным раствором гидроксида меди (II).
В ИК-спектрах альдегидов и кетонов имеется характерная полоса поглощения около 1700см -1 (валентные колебания С=О). Для альдегидов 2720 см -1 (валентные колебания С-Н в альдегидной группе).
Студент должен знать:
Реакции окисления альдегидов: серебряного зеркала, медного зеркала.
Почему водный раствор формальдегида имеет кислую реакцию среды.
Реакции нуклеофильного присоединения к карбонильной группе.
Способ получения ацетона и иодоформную реакцию на ацетон.
Получение оксима ацетона.
Студент должен уметь:
Проводить реакции «серебряного», медного зеркала.
Доказывать наличие в веществе карбонильной группы: проводить реакции с аммиачным раствором оксида серебра, с гидроксидом меди (II), с бисульфитом натрия и т.д.
Получить водный раствор ацетона из ацетата натрия и доказывать образование йодоформа при галоформной реакции.
Оборудование: пробирки, пробки с газоотводными трубками, пипетки, предметные стекла, микроскоп.
Реактивы: 0,2н AgNO3, 0,2н NaOH, 2н NH4OH, 1%-ный р-р формалина, 40%-ный формалин, 0,2н. CuSO4, 2н. HCI, I2 в KI, Na2CO3,2н. CH3COOH, индикатор метиловый красный, спиртовый р-р фенолфталеина, р-р белка, ацетат натрия, ацетон, гидроксиламин солянокислый NH2OH . HCI, нитропруссид натрия Na3[Fe(CN)5NO]
Опыт 1. Реакция « серебряного зеркала» (реакция Толленса на альдегидную группу). В двух чистых пробирках смешать по 3 капли 1%-ного р-ра AgNO3, 3капли 2н NaOH и по каплям до исчезновения осадка 10%-ный р-р NH4OH. В первую пробирку добавить 3 капли 1%-го формалина, во вторую — уксусного альдегида. Серебро выпадает в осадок, альдегидная группа окисляется до карбоксильной.
Опыт 2. Реакция «медного зеркала» на альдегидную группу (проба Троммера): К 1 мл 1%-го формалина добавить 1 мл 10 %-го раствора NaOH, а затем по каплям 3%-ный раствор CuSO4— образуется осадок голубого цвета. Осторожно нагреть верхнюю часть раствора, цвет его меняется в желтый (CuOH), а затем красный (Сu2O).
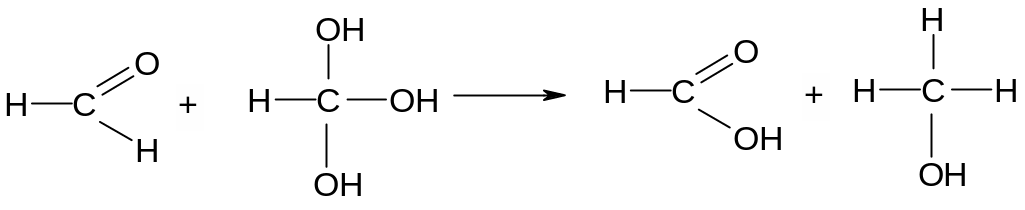
Опыт 3.Реакция дисмутации водных растворов формальдегида (реакция Канниццаро). К 3 каплям 40 %-го формалина добавить 1 каплю индикатора метилового красного – раствор краснеет, что указывает на кислую реакцию среды. Альдегиды легко окисляются в кислоты даже за счет соседней молекулы альдегида, восстанавливая его в спирт:
формальдегид гидратная форма муравьиная метиловый
формальдегида кислота спирт
Вот почему водные растворы формальдегида всегда имеют кислую реакцию.
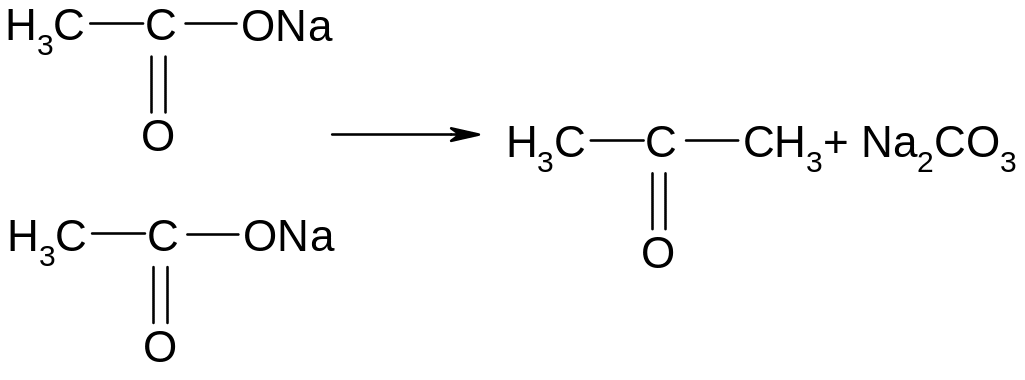
Опыт 4. Получение ацетона из ацетата натрия. Две лопаточки ацетата натрия поместить в пробирку, закрыть ее пробкой с газоотводной трубкой, второй конец которой опустить в пробирку с 2 мл воды. Сначала ацетат вспучивается от паров ацетона, затем ацетон, выходя через газоотводную трубку, конденсируется в воде. Ощущается характерный запах ацетона
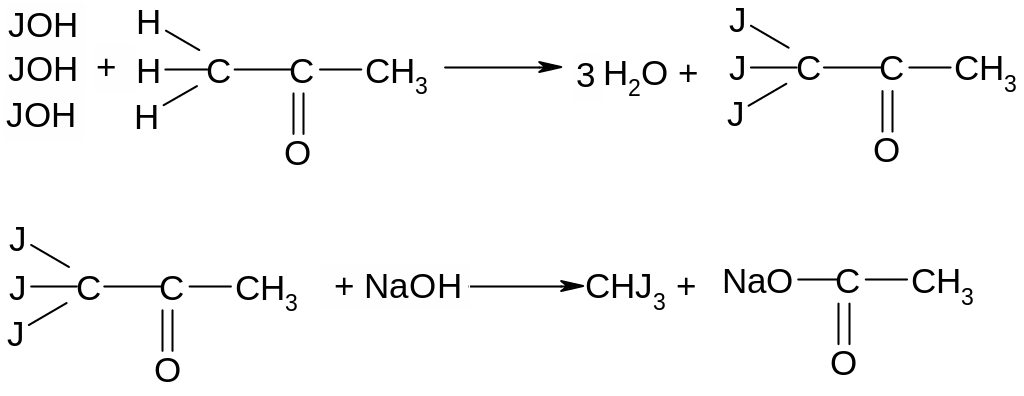
Опыт 5. Открытие ацетона посредством перевода его в йодоформ. Поместить в пробирку 1 каплю раствора иода в растворе иодида калия и почти до обесцвечивания 2 н. NaOH. К обесцвеченному раствору добавить 1 каплю водного раствора ацетона, полученного в предыдущем опыте. Немедленно без нагревания выпадает желтовато – белый осадок с характерным запахом йодоформа. Ход реакции:
При образовании йодоформа из спирта требуется нагревание смеси для получения промежуточного продукта реакции – альдегида, содержащего карбонильную группу. При наличии в веществе готовой карбонильной группы, что имеет место, например, в уксусном альдегиде или ацетоне, йодоформ образуется очень быстро и без нагревания. Йодоформная проба на ацетон очень чувствительна и позволяет открыть ацетон в водных растворах уже при содержании его около 0,04%.
Опыт 6. Реакция Фелинга. К 1 мл формалина добавить равный объём реактива Фелинга и нагреть верхнюю часть раствора до кипения. Появляется красный осадок окиси меди, свидетельствующий о восстанавливающем действии муравьиного альдегида
Опыт 7. Реакция с бисульфитом натрия. В две пробирки налить по 1 мл бисульфита натрия, затем в одну пробирку добавить 1 мл ацетона, в другую – столько же формалина, встряхнуть, охладить. Через некоторое время выпадает осадок.
Опыт 8. Получение оксима ацетона. В пробирку поместить по 1 лопаточке солянокислого гидроксиламина и безводной соды и растворить их в 10-15 каплях воды. Подождать, пока выделится основная масса СО2, затем охладить и добавить при хорошем перемешивании 15 капель ацетона. Смесь разгорается и выпадают кристаллы оксима ацетона:
Контрольные вопросы и вопросы для самостоятельной работы
Что называется альдегидами?
Дать классификацию альдегидов?
Что называется кетонами?
Написать методы получения альдегидов и кетонов.
Качественные реакции на альдегиды и кетоны.
Написать уравнения реакций получения полуацеталей и ацеталей карбонильных соединений.
Привести примеры реакций нуклеофильного присоединения к альдегидам и кетонам.
Л.Б.Дзараева Руководство к проведению лабораторных занятий по органической химии. Владикавказ, 2011
Э.Т.Оганесян Органическая химия.М. «Академия», 2011.
Под ред. Н.А.Тюкавкиной.Органическая химия. Основной курс.– М.: Дрофа, 2002.
Тестовые задания к работе №7.
Реакция «серебряного зеркала» характерна для каждого из двух веществ:
глюкозы и формальдегида
глюкозы и глицерина
сахарозы и глицерина
сахарозы и формальдегида
Метаналь может реагировать с
Качественная реакция на альдегиды – взаимодействие с:
аммиачным раствором Ag2O, t 0
Сколько изомерных кетонов имеет состав С5Н10О?
При мягком окислении первичных спиртов образуются:
Укажите возможные продукты окисления метилэтилкетона.
Укажите возможные способы синтеза кетонов:
дегидрогенизация первичных спиртов
окисление вторичных спиртов
окисление первичных спиртов
Этаналь при конденсации образует:
Укажите продукт взаимодействия метилового спирта и этаналя.
Укажите тип реакции:
Укажите возможные способы синтеза этаналя:
а) реакция Кучерова
б) дегидрогенизация первичных спиртов
в) окисление вторичных спиртов
г) окисление первичных спиртов
12. При окислении первичных спиртов образуются
в) простые эфиры
г) сложные эфиры
13. При окислении вторичных спиртов образуются
в) простые эфиры
г) сложные эфиры
14. При восстановлении альдегидов образуются
б) вторичные спирты
в) первичные спирты
г) сложные эфиры
15. При восстановлении кетонов образуются
б) вторичные спирты
в) первичные спирты
г) сложные эфиры
Ответы: 1-а; 2-а,в,г; 3-а; 4-а; 5-б;6-а,б,д; 7-в; 8-а; 9-д; 10-а; 11-а,б,г; 12-б; 13-а; 14-в; 15-б.
Источник