Что такое азеотроп со спиртом и чем он важен самогонщику
Иногда на форумах можно встретить загадочное слово “азеотроп” или сочетание “точка азеотропа”. Это понятие пришло в самогоноварение из химии и промышленной дистилляции и относится к “чистому” спирту” крепостью более 97%. Что за зверь этот азеотроп и зачем его нужно знать самогонщику — разбираемся вместе.
Что такое азеотроп?
Азеотроп — это нераздельнокипящая смесь двух и более жидкостей. Каждая из жидкостей азеотропа при стабильном атмосферном давлении образует пар и конденсат того же состава, что и она сама. Азеотроп не обязательно постоянен, чаще есть точка (точки) азеотропа, в которой совпадают все условия для неизменности состава смеси. Поэтому азеотроп обычно описывают графиком:
Зачем самогонщику точка азеотропа?
У азеотропа спирта с водой тоже есть точка — 97,17% объемных долей спирта. Точка азеотропа во время перегонки наступает при температуре 78,1оС и нормальном атмосферном давлении. До этой точки и температуры спирт с водой кипит и пары обогащаются спиртом более, чем водой. После этой точки — менее. Иначе говоря, точка азеотропа связана с конечной точкой перегонки — нет смысла разделять спирт на фракции после точки азеотропа. Здесь надо сказать, что на бытовом оборудовании получить спирт крепче 97,1% не получится вообще. Более крепкий спирт можно получить только если использовать эпюрацию, снизить атмосферное давление, либо обезводить состав, например — обезвоженным медным купоросом (но после купороса пить его будет нельзя).
Кстати, наиболее близко к спирту крепостью выше 97,17% и точке азеотропа можно подойти, используя колонну с высокоэффективной спирально-призматической насадкой (СПН). Благодаря огромной площади контакта СПН дает максимально возможное при атмосферном давлении укрепление и разделение спирта. Такая насадка используется во многих современных аппаратах, например — в Люкссталь 8m.
Источник
Азеотроп, или можно ли прыгнуть выше головы?
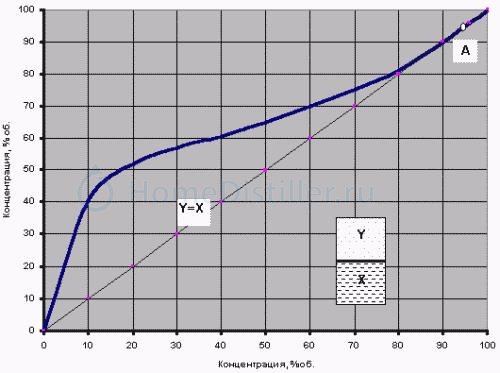
pic1.jpg Азеотроп, или можно ли прыгнуть выше головы? Вопросы ректификаторов.
Кривая равновесия фаз бинарной водно-спиртовой смеси (при давлении 760 мм рт.ст.)
Рассматривая этот график, стоит обратить внимание на диагональ Y=X. Именно благодаря тому, что почти вся кривая равновесия лежит выше этой диагонали, можно при испарении водно-спиртовой смеси получать концентрацию спирта в парах большую, чем его концентрация в исходной жидкости. Исключением является только точка А — пересечение кривой равновесия с диагональю, где X=Y=96,4%. Это особая точка азеотропы.
Азеотропными или нераздельно кипящими называют смеси, у которых пар, находящийся в равновесии с жидкостью, имеет тот же состав, что и жидкая смесь (X=Y). При перегонке азеотропных смесей образуется конденсат того же состава, что и исходная смесь. Разделение таких смесей перегонкой и ректификацией исключается .
Посл. ред. 12 Янв. 10, 19:06 от Sergey_Gusev
Все просто. В точке азеотропии жидкость испаряется без изменения состава: сколько спирта в жидкости, столько и в паре, укрепления нет. В этой точке энергия молекул воды сравнивается с энергией молекул спирта в Броуновском движении. В заазеотропной области энергия воды становится выше и при перегонке происходит обеднение спиртом до точки азеотропии.
Азеотропию в принципе можно обмануть на основе первого закона Вревского. В сильно упрощенном виде: при понижении давления точка азеотропии повышается по диагонали линии равновесия. При остаточном давлении 76 мм рт. ст. она упирается в 100% и смесь становится идеальной, подчиняясь закону Рауля.
Плюс можно воду отобрать химически, например добавив вещества не реагирующие с спиртом, но поглощающие воду, классика: обезвоженный медный купорос CuSO4.
Посл. ред. 12 Янв. 10, 19:14 от mak210
это несоответствие пока у меня окончательно не случилось раздвоение личности. Sergey_Gusev, 12 Янв. 10, 18:55
По крайней мере спирт 97 с плюсом градусов увидел только на СПН.
Игорь, 11 Янв. 10, 22:05
KD, ты первый дал толковый ответ.
Азеотропная точка для спирта — не 96% и не 96,4%. ХЗ кто придумал эту ересь. По крайней мере эта кривулька с цифрой 96,4 взата из руковыодства по перегонке и ректификации, нашкрябанного пр.г.м.т.х.никой.
Sergey_Gusev, запомни и передай внукам. Азеотроп — 97,17 объемных процентов спирта. Это максимальная концентрация, которую можно получить при перегонке или ректификации без специальных приёмов с давлением и прочих хитростей.
Спирт с собственной колонны, который Роман Николаевич отдал на лабораторные исследования, имел концентрацию 97%, что соответствует минимум 35-ти ступеням разделения в его колонне.
В пересчете на объемные доли (которые имеряет ареометр) — 97,17% и 2,83% соответственно.Плюс почти всегда меньшее давление чем 760 мм рт. ст., вранье ареометра, неточная температура, нетрезвый взляд KD, 12 Янв. 10, 20:26
Во-во!
Но взгляд KD, у меня если и вечером нетрезв иногда, то на утро как алмаз! Подопечные на работе, точно взгляда не выдерживают!
И вот не давеча, после очередной ректификации замерял АСПТ 60-100 двумя штуками, АСП 90-100 — после чего измерив температуру спирта (калиброванными-электронными) и воспользовавшись калькулятором Руди = получил 97,2%, ну давление было тогда 750 мм или 755 мм ртути (знаю потому, что тогда купил очередной барометр и выставлял его по телефону с гидрометеослужбой).
Классный кстати барометр купил, какой-то Российский (вроде Питерский) в деревянном корпусе с разными штампиками ОТК и прочими контрольными отметками. Показывают с гидрометеослужбой с точностью до мм ртути!
Спирт с собственной колонны, который Роман Николаевич отдал на лабораторные исследования, имел концентрацию 97%, что соответствует минимум 35-ти ступеням разделения в его колонне. Игорь, 12 Янв. 10, 20:39
Посл. ред. 13 Янв. 10, 01:52 от Роман Николаевич
Источник
Недоректификат
ВМБ,Так для самообразования.
95,57% мас = 97,17% об. = 89,4% мол.
И не стоит лезть в практическую ветку со своим видением мира. Для этого существует флудилка.
Добавлено через 1мин.:
миргаз, До какого сможешь.
Посл. ред. 31 Янв. 18, 10:32 от SA1348
ВМБ,Так для самообразования.
95,57% мас = 97,17% об. = 89,4% мол. SA1348, 31 Янв. 18, 10:18
Благодарю за заботу о моем самообразовании, но я :
— привёл источник «Справочник химика» где дана цифра 88,4 мол, а не 89,4 мол. Вы же серьёзного источника, вызывающего доверие, где бы была цифра для азеотропа этанола 89,4 мол. — пока что не привели;
— четко и конкретно объяснил, что это касается азеотропа при нормального давления и нормальной (комнатной — 20 град Ц) температуре;
— изначально (в исходном своем сообщении о азеотропе этанола) сказал что молярные массы рассчитываются не идеально (молярная масса этанола 46,069 г/моль, молярная масса воды 18,01528 г/моль) а сугубо для уяснения физики процесса и простоты счета(молярная масса этанола 46 уе, молярная масса воды 18 уе) — для того чтобы понять сколько в молях (или по весу) будет содержаться этанола и воды в предельно идеальной смеси — в какой на каждую молекулу воды будет приходиться три молекулы спирта, ибо при нормальных условиях азеотроп с большим количеством молекул спирта на одну молекулу воды вообще не образуется (потому как нет физической основы — возможности создать между молекулой воды и молекулами спирта водородных связей — объединения в этой смеси молекул воды с избытком молекул спирта).
Посл. ред. 31 Янв. 18, 10:39 от ВМБ
ВМБ, Мы живем в России и документально по Российскому ГОСТу в дистилляте зерновом объёмная доля этилового спирта допустима до 94,8% Поэтому свою цифирь SA1348, 31 Янв. 18, 07:44
Пы.сы. Да какая разница кто и где живёт?
ГОСТ или ДСТУ — это никак не наука, а всего лишь политика и барыжная (особенно нынче, что в России, что в Украине, что и в иных странах мира) экономика. И не более того.
При 94,8% об — в этой смеси спирт-вода на одну молекулу воды будет приходиться более одной молекулы спирта. В результате чего этот избыток молекул спирта в данной смеси будет объединяться в кластеры самого спирта, какие затем при обычном разведении водой (без повторной дистилляции этой смеси) очень трудно разрушить, потому как водородные связи между молекулами воды почти в 1,6 раза больше чем между молекулами этанола и кластеры воды поэтому будут слабо распадаться на отдельные молекулы, чтобы соединиться водородными связями с молекулами спирта.
Так что при 94,8% об. крепости смеси этанол-вода — там дистиллятом (с научной, а не политико-барыжной точки зрения) даже не пахнет — в прямом и переносном смысле.
Посл. ред. 31 Янв. 18, 10:58 от ВМБ
Реально?! Я вот такой отзыв читал: AlexVv78, 31 Янв. 18, 09:42
Посл. ред. 31 Янв. 18, 14:47 от Водкин
ВМБ, соотрошение 3:1 притянуто за уши, и атмосферное давление получается каким то уникальным, что именно для него 3:1 выполняется.
Еслиб было заявлено что это инвариант это ещё можно было бы проглотить.
Но точка азеатропии СМЕЩАЕТСЯ при изменении давление, а это с соотношением 3:1 вообще никак не вяжется. Kotische, 31 Янв. 18, 10:49
И тем не менее — это факт. И я его объяснил.
При понижении давления водородные связи между молекулами легче разрываются, в результате чего и образуется смесь молекул в какой одна часть — еще существует в виде объединения молекул водородными связями, а другая — уже просто в виде одиночных молекул ни связанных с иными (энергия броуновского движения при более низком давлении позволяет образовываться таким «самостоятельным и суверенным» молекулам). В результате чего при очень низком давлении (при условном техническом вакууме) достаточно подводимой тепловой энергии в районе 20 градусов по Цельсию чтобы началось активное испарение (кипение) данной азеотропной спирто-водной смеси 88,4 мол крепости).
Пы.Сы. Атмосферное давление на Земле — не просто уникальное, а фактор, благодаря какому подавляющее число химических соединений атомов химических веществ существует в том «обычном и привычном» для человека виде к какому мы все привыкли. На иных планетах или в открытом космосе — этих соединений как правило вообще нет. И нет именно из-за иного давления и иной средней температуры, чем на Земле.
Источник
Состав азеотропа этанол вода
Сивуха в готовый продукт поступает вообще-то двумя путями:
1. Брызгоунос;
2. В составе азеотропных смесей
И если с брызгоуносом всё более-менее ясно и мерой борьбы, причем замечу, эффективной мерой является снижение скорости потока пара (что, в свою очередь, достигается банальным уменьшением нагрева), то второй путь хотелось бы разглядеть «вооруженным глазом». И наука тут нам в помощь.
Наука гласит:
АЗЕОТРОПНЫЕ СМЕСИ (азеотропы) , жидкие смеси , характеризующиеся равенством составов равновесных жидкой и паровой фаз. При их перегонке образуется конденсат того же состава, что и исходный раствор; поэтому азеотропные смеси наз. также нераздельнокипящими. Наличие азеотропных смесей существенно затрудняет разделение жидких смесей и требует применения специальных методов ректификации .
Азеотропные смеси встречаются как в двойных, так и в многокомпонентных системах . Некоторые вещества особенно склонны к образованию азеотропных смесей, особенно с представителями к.-л. одного гомологического ряда. В многокомпонентных системах можно наблюдать явления полиазеотропии, когда гомологи и их изомеры из различных рядов могут образовывать между собой большое число двух- и многокомпонентных азеотропных смесей, охватывающих широкий концентрац. интервал.
Известно ок. 10 000 систем с азеотропными смесями, что составляет примерно половину всех изученных смесей. Поэтому изучение свойств систем с азеотропизмом необходимо для построения общего учения о фазовых равновесиях и кри.тич. состоянии.
Двухкомпонентные системы. Кривые зависимости общего давления от состава при постоянной т-ре (изотермы общего давления ) имеют максимумы или минимумы (точки А 1 , А 2 , А 3 на рис. 1).
Рис. 1. Диаграмма равновесия жидкость-пар в двойной системе с положит. (а) и отрицат. (б) азеотропами; 1-4-изотермы равновесия жилкой и паровой фаз; A1, А2, А3-азеотропы; К аз -критическая точка азеотропа; ЦС аз -линия азеотропов; М-точка, соответствующая температурному минимуму (а) и температурному максимуму (б) на критической кривой, соответственно К1К аз МК2 и К1МК аз К2.
Тройные системы. Добавление к двойной неидеальной системе третьего компонента может как уменьшить, так и увеличить ее неидеальность. Поэтому в тройной системе может не быть тройного азеотропа и при наличии азеотропных смесей в двойных системах, составляющих данную тройную. И наоборот, тройной азеотроп может появиться при отсутствии в двойных системах азеотропных смесей, причем вероятность появления тройного азеотропа тем больше, чем больше число азеотропных смесей в двойных системах.
Рис. 2. Диаграмма равновесия жидкость-пар в системе с тройным положительным азеотропом К состава А(1, 2, 3) и тремя двойными азеотропами А(1, 2), А(2, 3), А(1, 3). Заштрихована изобарическая поверхность равновесной жидкой фазы.
Экспериментальные исследования систем с тройными азеотропными смесями очень трудоемки. Поэтому большую роль здесь играют теоретические представления о возможных видах диаграмм состояния . Широко используется для этого правило азеотропии, которое качественно связывает количество и типы двойных и тройных азеотропов в системе. Поскольку в тройных системах изобарические поверхности температур кипения имеют хребты и впадины, то для проведения ректификации удобными становятся выделенные ими отдельные области параметров.
Теперь переводим всё вышесказанное на обычный русский язык обывателя, просто желающего получить качественный продукт в бутылке (или, еще лучше – в рюмке).
Итак, в исходной диспозиции мы имеем перебродивший исходный продукт. Кого-то может распирать гордость от того, что у него в бочке бродил виноград, другого может пучить от счастья брожения абрикосов, кто-то может скромно посапывать со своим сахаром. Тем не менее, итог один: мы имеем брагу для перегонки. Сложность исходного состава невообразима. Более десятка простых и сложных веществ и только один нужный – этиловый спирт.
Коварство этанола в том, что он очень легко формирует азеотропы. Поэтому крепость в 100% достигается нетривиальным химическим путем. И то ненадолго, т.к. абсолютизированный этанол осушает воздух и превращается в стабильную азеотропную смесь с концентрацией этилового спирта 96,4%.
Что такое азеотроп? В бытовом смысле – это снежок. Обычный детский шарик, слепленный из снега. Применительно к этиловому спирту мы имеем три более-менее выраженных пика азеотропных смесей. Это соответствует крепости:
10% — теоретически возможная концентрация этанола, которую можно получить на супер-пупер-мега аппарате в конце отгона. Далее вы получаете практически всю смесь перегонного куба за исключением мути.
40% — граничная стадия завершения отгона на заурядных деревенско-колхозных прямоточниках, после чего начинает идти откровенная сивуха. До этой фазы результат еще горит в ложке – классика жанра для подавляющего числа любителей самостоятельного взращивания зеленого змия.
96,4% — вожделенная мечта каждого страждущего профессионала. Рубеж, к которому устремлены умственные и творческие усилия всех самоделкиных в стройных рядах винокуров.
А делать-то чё? Справедливый вопрос. Наука прямо указывает на мегазависимость поведения азеотропа от давления. Углубление в анналы показывает улучшение процесса разделения при снижении давления. Водоструйный насос вполне справляется со своей задачей.
Сам аппарат дополняется нехитрым приспособлением, в итоге получая нечто, похожее на
Разочарую. Для первоначального процесса штука более вредная, нежели полезная. Почему? Потому что мы изначально имеем дело с многокомпонентным азеотропом. Образно говоря, в ваш «снежок» зачерпнуто помимо снега еще и горсточка собачьих какашек. И далеко не факт, что это «дополнение» не испарится при пониженном давлении.
Первый отгон на внятном аппарате с контролируемым температурным режимом весьма неплохо справляется с задачей отсекания основной массы ненужной смеси. Так что эксперименты с давлением лучше оставить на вторую перегонку, когда в «исходнике» осталось не так много ненужного. Ну и приготовьтесь к естественным потерям количества элексира.
Упрощает в определенной степени такой вот дивайс (алонж — по научному)
Изучение анналов химической мысли приводит к однозначному выводу: разделение азеотропов – это физическая задача. Не надо лезть в брагу, СС и другие промежуточные (а тем более – в финал) результаты с химией. (На память приходит одно вычитанное на просторах решение попытки увеличить температуру кипения воды посредством соли. Авторы совета утверждали о феноменальной результативности. Испытав на себе, авторитетно, со всей ответственностью, заявляю: НЕ НАДО этого делать. Хлориды весьма активно реагируют с компонентами браги. В итоге получается неустранимый горький привкус, весьма отрицательно сказывающийся на органолептике.)
Работайте с дефлегматором. Экспериментально подбирайте флегмово число. Весьма перспективным кажется мне использование «узкого места» на пути движения пара. Резкое изменение давления смеси в процессе прохода «щели» ломает азеотропные связи. Опять же как вы это организуете – вам решать. Я наполнил каплеуловитель стеклянными шариками, создав массу щелей, по которым проходит пар. Результат – выше всяких похвал.
Как-то так. Ищите, да обрящите! ( Евангелии от Матфея (гл . 7 , ст . 7 —8))
Источник

 pic1.jpg Азеотроп, или можно ли прыгнуть выше головы? Вопросы ректификаторов.
pic1.jpg Азеотроп, или можно ли прыгнуть выше головы? Вопросы ректификаторов. 



