- Состав гипохлорит натрия стабилизаторы вода
- Состав гипохлорит натрия стабилизаторы вода
- Предисловие
- Введение
- 1 Область применения
- 2 Нормативные ссылки
- 3 Технические требования
- Чистая вода — дело техники!
- 1. ОБЩИЕ СВЕДЕНИЯ
- 2. ОПИСАНИЕ И ОСНОВНЫЕ ХАРАКТЕРИСТИКИ
- 2.1 Химические свойства ГПХН
- 2.2. Бактерицидные свойства ГПХН
- 2.3. Коррозионная активность ГПХН
- 3.2. Обработка бытовых и промышленных сточных вод
- 3.3. Использование гипохлорита натрия в пищевой промышленности
- 3.4. Использование гипохлорита в рыбоводстве
- 3.5. Использование гипохлорита в здравоохранении
- 3.6. Использование ГПХН для отбеливания белья в фабриках-прачечных
- 3.7. Дезинфекция питьевой воды
- 3.8. Обеззараживание ГПХН оборудования для очистки воды
Состав гипохлорит натрия стабилизаторы вода
РЕЖИМ РАБОТЫ:
с 9.00 до 18.00
без обеда и выходных
Каталог Строительство Обслуживание Статьи Контакты Блог Ранее просмотренные товары Главная Статьи ЭМОВЕКС — стабилизированный водный раствор гипохлорита натрия
«Эмовекс» — чистый концентрированный раствор хлора, наилучшее средство из жидкой химии для бассейна, незаменимый помощник, обеспечивающий полную дезинфекцию воды и осуществляющий её защиту от бактериальных загрязнений; позволяет получить чистую прозрачную воду, лишенную водорослей и бактерий, предупреждает образование известкового налета. Содержание активного хлора в этом продукте 135 — 140 граммов на литр, расфасован в тридцатилитровые канистры (товарный вес — 34 кг), идеально подходит для установок автоматического дозирования химии.
Препарат «Эмовекс» можно использовать не только для дезинфекции воды плавательных бассейнов, но и для обеззараживания питьевой воды, очистки технологических линий и оборудования в пищевой промышленности. Это средство подходит и для сравнительно небольших бассейнов, где отсутствуют станции электронного дозирования.
При отсутствии автоматической дозирующей станции рекомендуется растворить препарат в отдельной емкости, понижая исходную концентрацию в 5-10 раз, а затем полученный раствор добавляется порциями непосредственно в воду бассейна вблизи места подачи или в нескольких местах одновременно во время работы циркуляционного насоса.
Рекомендуемые дозировки (при ручной дозации):
— текущая обработка – 30-90мл на 10м³ воды – добавляется 2-3 раза в день. При интенсивном использовании бассейна и высоких температурах следует увеличить дозировку и\или частоту обработки в соответствии с показаниями хлор-тестера (показатель должен быть в пределах 0,3-0,5 мг/л).
— «Ударная» обработка – 300мл на 10м³ воды каждые 7-14 дней. Требуется технический перерыв в работе бассейна не менее 12 часов. При «ударной» обработке после технического перерыва перед введением бассейна в эксплуатацию необходимо проверить:
— значение рН – при необходимости довести до нормы ( 7,0-7,4 );
— содержание свободного хлора (показатель не должен превышать 0,5 мг/л, в случае превышения – произвести дехлорирование воды до уровня свободного хлора 0,3-0,5 мг/л).
Меры предосторожности: беречь от детей, не смешивать с другими химическими препаратами, при попадании на кожу и глаза немедленно промыть большим количеством воды, при необходимости обратиться к врачу.
Состав: гипохлорит натрия, щёлочь, дистиллированная вода.
Срок годности: шесть месяцев с даты изготовления. По истечении срока хранения допускается использование средства, если значение концентрации активного хлора не ниже 100 г/л.
Условия хранения: хранить в крытом проветриваемом помещении и оригинальной герметично закрытой упаковке при t от –10 до +25ºС вдали от нагревательных приборов; избегать контакта с кислотами, взрывчатыми и огнеопасными веществами; беречь от нагрева и прямых солнечных лучей.
Источник
Состав гипохлорит натрия стабилизаторы вода
ГОСТ Р 57568-2017
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
Sodiumhypochlorite aqueous solution. Specifications
Дата введения 2018-02-01
Предисловие
1 РАЗРАБОТАН Федеральным государственным бюджетным учреждением науки «Институт водных проблем Российской академии наук» (ИВП РАН)
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 060 «Химия»
4 ВВЕДЕН ВПЕРВЫЕ
5 ПЕРЕИЗДАНИЕ. Апрель 2019 г.
Правила применения настоящего стандарта установлены в статье 26 Федерального закона от 29 июня 2015 г. N 162-ФЗ «О стандартизации в Российской Федерации». Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе «Национальные стандарты», а официальный текст изменений и поправок — в ежемесячном информационном указателе «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячном информационном указателе «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.gost.ru)
Введение
Настоящий стандарт разработан с целью получения конкурентоспособной и безопасной продукции (водный раствор гипохлорита натрия), особенно в отношении ограничений на содержание высокотоксичных примесей элементов 1 и 2 класса опасности. Введение стандарта позволит гарантировать безопасность использования водного раствора гипохлорита натрия в питьевом водоснабжении и других отраслях высоких технологий.
В настоящем стандарте представлен комплекс аналитических методов контроля качества водного раствора гипохлорита натрия с указанием их метрологических характеристик.
1 Область применения
Настоящий стандарт распространяется на водный раствор гипохлорита натрия (хлорноватисто-кислого натрия), получаемый методом электролиза раствора хлорида натрия в мембранном электролизере (приложение А).
Водный раствор гипохлорита натрия предназначен для применения в локальных или централизованных системах питьевого водоснабжения, для обеззараживания воды плавательных бассейнов.
Химическое название: натрия гипохлорит.
Химическая формула: NaOCI.
Относительная молекулярная масса (по международным атомным массам 2016 г.): 74,44.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты:
ГОСТ 83 Реактивы. Натрий углекислый. Технические условия
ГОСТ 1770 Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Общие технические условия
ГОСТ 3118 Реактивы. Кислота соляная. Технические условия
ГОСТ 4204 Реактивы. Кислота серная. Технические условия
ГОСТ 4220 Реактивы. Калий двухромовокислый. Технические условия
ГОСТ 4232 Реактивы. Калий йодистый. Технические условия
ГОСТ 4457 Реактивы. Калий бромновато-кислый. Технические условия
ГОСТ 4517 Реактивы. Методы приготовления вспомогательных реактивов и растворов, применяемых при анализе
ГОСТ 4919.1 Реактивы и особо чистые вещества. Методы приготовления растворов индикаторов
ГОСТ 10157 Аргон газообразный и жидкий. Технические условия
ГОСТ 10555 Реактивы и особо чистые вещества. Колориметрические методы определения содержания примеси железа
ГОСТ 10929 Реактивы. Водорода пероксид. Технические условия
ГОСТ 11125 Кислота азотная особой чистоты. Технические условия
ГОСТ 12257 Хлорат натрия технический. Технические условия
ГОСТ 17299 Спирт этиловый технический. Технические условия
ГОСТ 18300 Спирт этиловый ректификованный технический. Технические условия
В Российской Федерации действует ГОСТ Р 55878-2013.
ГОСТ 19433 Грузы опасные. Классификация и маркировка
ГОСТ 25336 Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры
ГОСТ 25794.1 Реактивы. Методы приготовления титрованных растворов для кислотно-основного титрования
ГОСТ 27025 Реактивы. Общие указания по проведению испытаний
ГОСТ 28311 Дозаторы медицинские лабораторные. Общие технические требования и методы испытаний
ГОСТ 29169 Посуда лабораторная стеклянная. Пипетки с одной отметкой
ГОСТ 29227 Посуда лабораторная стеклянная. Пипетки градуированные. Часть 1. Общие требования
ГОСТ 29251 Посуда лабораторная стеклянная. Бюретки. Часть 1. Общие требования
ГОСТ 31340 Предупредительная маркировка химической продукции. Общие требования
ГОСТ Р 52501 Вода для лабораторного анализа. Технические условия
ГОСТ Р 53228 Весы неавтоматического действия. Часть 1. Метрологические и технические требования. Испытания.
Примечание — При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодному информационному указателю «Национальные стандарты», который опубликован по состоянию на 1 января текущего года, и по выпускам ежемесячного информационного указателя «Национальные стандарты» за текущий год. Если заменен ссылочный стандарт, на который дана недатированная ссылка, то рекомендуется использовать действующую версию этого стандарта с учетом всех внесенных в данную версию изменений. Если заменен ссылочный стандарт, на который дана датированная ссылка, то рекомендуется использовать версию этого стандарта с указанным выше годом утверждения (принятия). Если после утверждения настоящего стандарта в ссылочный стандарт, на который дана датированная ссылка, внесено изменение, затрагивающее положение, на которое дана ссылка, то это положение рекомендуется применять без учета данного изменения. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, рекомендуется применять в части, не затрагивающей эту ссылку.
3 Технические требования
3.1 Водный раствор гипохлорита натрия должен быть изготовлен в соответствии с требованиями настоящего стандарта.
3.2 Технические характеристики
3.2.1 По физико-химическим показателям водный раствор гипохлорита натрия должен соответствовать требованиям и нормам, указанным в таблице 1.
Таблица 1 — Физико-химические показатели состава водного раствора гипохлорита натрия
Источник
Чистая вода — дело техники!
БИБЛИОТЕКА ЗНАНИЙ МВТ
БИБЛИОТЕКА ЗНАНИЙ МВТ
ГИПОХЛОРИТ НАТРИЯ. СВОЙСТВА, ТЕОРИЯ И ПРАКТИКА ПРИМЕНЕНИЯ.
(автор: Ген.директор компании «МИРОВЫЕ ВОДНЫЕ ТЕХНОЛОГИИ» — С.В.Черкасов)
1. ОБЩИЕ СВЕДЕНИЯ
Гипохлорит натрия — NaClO, получают хлорированием водного раствора едкого натра (NaOH) молекулярным хлором (Cl2) или же электролизом раствора поваренной соли (NaCl). Подробно о методах получения гипохлорита натрия (ГПХН) можно прочитать в статье, размещенной на нашем сайте: «Гипохлорит натрия. Процесс получения.».
В РФ состав и свойства ГПХН, выпускаемого промышленностью, или получаемого непосредственно у потребителя в электрохимических установках, должен соответствовать требованиям, предъявляемым в ГОСТе или ТУ. Основные характеристики растворов ГПХН, регламентируемые этими документами, приведены в Таблице 1.
2. ОПИСАНИЕ И ОСНОВНЫЕ ХАРАКТЕРИСТИКИ
Безводный гипохлорит натрия (ГПХН) представляет собой неустойчивое бесцветное кристаллическое вещество.
Элементный состав: Na (натрий) (30,9 %), Cl (хлор) (47,6 %), O (кислород) (21,5 %).
Молекулярная масса NaClO (по международным атомным массам 1971 г.) -74,44.
Хорошо растворим в воде: 53,4 г гипохлорита натрия растворяется в 100 граммах воды при 20°C (или 130 г в 100 г воды при 50°C). Растворимость NaClO представлена в таблице 2.1.
| Температура, °С | — 10 | 0 | 10 | 25 | 30 |
| Растворимость, % | 20,6 | 22,8 | 27,5 | 45,0 | 50,0 |
Плотность водных растворов гипохлорита натрия
| Концентрация, % | 1 | 2 | 4 | 6 | 8 | 10 | 14 |
| Плотность, г/л | 1005,3 | 1012,1 | 1025,8 | 1039,7 | 1053,8 | 1068,1 | 1097,7 |
| Концентрация, % | 18 | 22 | 26 | 30 | 34 | 38 | 40 |
| Плотность, г/л | 1128,8 | 1161,4 | 1195,3 | 1230,7 | 1268,0 | 1308,5 | 1328,5 |
Температура замерзания водных растворов гипохлорита натрия
| Концентрация | 0,8 % | 2 % | 4 % | 6 % | 8 % | 10 % | 12 % | 15,6 % |
| Температура замерзания, °C | − 1,0 | − 2,2 | − 4,4 | − 7,5 | − 10,0 | − 13,9 | − 19,4 | − 29,7 |
Термодинамические характеристики гипохлорита натрия в бесконечно разбавленном водном растворе:
- стандартная энтальпия образования, ΔH o 298: − 350,4 кДж/моль;
- стандартная энергия Гиббса, ΔG o 298: − 298,7 кДж/моль.
Водные растворы ГПХН весьма неустойчивы и со временем разлагаются даже при обычной температуре (со скоростью 0,08 до 0,1 % в сутки). На скорость распада ГПХН влияет воздействие солнечного излучения, наличие катионов тяжелых металлов и хлоридов щелочных металлов. При этом наличие в водном растворе сульфата магния или кальция, борной кислоты, силикатов и пр. замедляют процесс разложения ГПХН. Следует заметить, что наиболее устойчивы растворы с сильнощелочной средой (значение pH > 10).
У гипохлорита натрия известно три кристаллогидрата:
- моногидрат NaOCl·H2O – крайне неустойчив, разлагается выше 60°C, при более высоких температурах со взрывом.
- кристаллогидрат NaOCl·2,5 H2O – более устойчив, чем моногидрат, плавится при 57,5°C.
- пентагидрат NaOCl·5 H2O – наиболее устойчивая форма, представляет собой белые или бледно-зелёные ромбические кристаллы. Негигроскопичен, хорошо растворим в воде. В воздухе расплывается, переходя в жидкое состояние, из-за быстрого разложения. Температура плавления:18 – 24,4°C. При нагревании до температуры 30 – 50 °C разлагается.
2.1 Химические свойства ГПХН
Диссоциация, гидролиз и разложение ГПХН в водных растворах
Гипохлорит натрия (ГПХН) – неустойчивое соединение, легко разлагающееся с выделением кислорода. Самопроизвольное разложение медленно происходит даже при комнатной температуре: например, за 40 суток наиболее устойчивая форма – пентагидрат ГПХН (NaOCl·5H2O) теряет около 30 % активного хлора:
2 NaOCl → 2 NaCl + O2
При нагревании ГПХН параллельно с его разложением происходит реакция диспропорционирования:
3 NaOCl → NaClО3 + 2NaCl
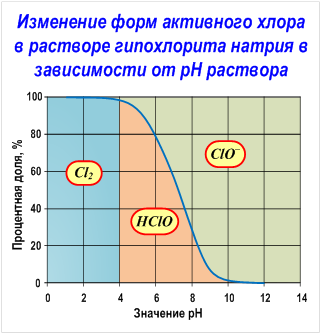
Гипохлорит натрия образует в воде хлорноватистую кислоту и гипохлорит ион в соотношениях, определяемых рН раствора, а именно соотношение между ионом гипохлорита и хлорноватистой кислотой определяется протеканием реакций гидролиза гипохлорита натрия и диссоциации хлорноватистой кислоты (см. Рис. Изменение форм активного хлора в растворе гипохлорита натрия в зависимости от рН раствора).
Растворяясь в воде, ГПХН диссоциирует на катионы натрия и анионы хлорноватистой кислоты:
NaOCl → Na + + OCl −
Так как хлорноватистая кислота (HOCl) является очень слабой, гипохлорит-ион в водной среде подвергается гидролизу:
OCl − + Н2О ↔ НОСl + ОН −
Так как же происходит разложение ГПХН?
В сильнощелочной среде (pH > 10), когда гидролиз гипохлорит-иона подавлен, разложение происходит следующим образом:
2 OCl − → 2 Cl − + O2
При температурах выше 35°C распад сопровождается реакцией диспропорционирования:
OCl − → ClO3 − + 2 Cl −
В среде со значением рН от 5 до 10, когда концентрация хлорноватистой кислоты в растворе заметно выше, разложение протекает по следующей схеме:
HOCl + 2 ClO − → ClO3 − + 2 Cl − + H +
HOCl + ClO − → O2 + 2 Cl − + H +
При дальнейшем уменьшении рН, когда в растворе уже нет ClO − ионов, разложение идет следующим путем:
3 HClO → ClO3 − + 2 Cl − + 3 H +
2 HClO → O2 + 2 Cl − + 2 H +
В конце концов, когда рН раствора ниже 3, разложение будет сопровождаться выделением молекулярного хлора:
Как резюме, изложенному выше можно сказать, что при рН выше 10 происходит кислородное разложение, при рН 5-10 — кислородное и хлоратное, при рН 3-5 — хлорное и хлоратное, при рН меньше 3 — хлорное разложение растворов гипохлорита натрия.
Таким образом, подкисляя раствор гипохлорита натрия соляной кислотой, можно получить хлор:
NaOCl + 2HCl → NaCl + Cl2 + H2O.
Окислительные свойства ГПХН
Водный раствор гипохлорита натрия, являющийся сильным окислителем, вступает в многочисленные реакции с разнообразными восстановителями, независимо от кислотно-щелочного характера среды.
Основные варианты развития окислительно-восстановительного процесса в водной среде мы уже рассмотрели:
в кислой среде:
NaOCl + H + → Na + + HOCl
2 HOCl + 2 H + + 2e − → Cl2↑ + 2 H2O
HOCl + H + + 2e − → Cl − + H2O
в нейтральной и щелочной среде:
NaOCl → Na + + OCl −
2 OCl − + 2H2O + 2e − → Cl2↑ + 4OH −
OCl − + H2O + 2e − → Cl − + 2 OH −
Ниже приведены основные окислительно-восстановительные реакции с участием гипохлорита натрия.
Так в слабокислой среде иодиды щелочных металлов окисляются до йода:
NaClO + 2 NaI + H2O → NaCl + I2 + 2 NaOH, (1)
в нейтральной среде до иодата:
3 NaClO + NaI → 3 NaCl + NaIO3,
в щелочной среде до периодата:
4 NaClO + NaI → 4 NaCl + NaIO4
Надо упомянуть, что на реакции (1) основан принцип колориметрического определения хлора в воде.
Под воздействием гипохлорита натрия сульфиты окисляются до сульфатов:
нитриты до нитратов:
оксалаты и формиаты до карбонатов:
NaClO + NaOH + CHOONa → NaCl + Na2CO3 + H2O
и т.д.
Фосфор и мышьяк растворяются в щелочном растворе гипохлорита натрия, образуя соли фосфорной и мышьяковой кислот.
Аммиак под действием гипохлорита натрия через стадию образования хлорамина, превращается в гидразин (аналогично реагирует и мочевина). Мы уже рассматривали этот процесс в своей статье «Хлорирование питьевой воды», поэтому здесь приведем только суммарные химические реакции этого взаимодействия:
Приведенные окислительно-восстановительные реакции очень важны, т.к. влияют на потребление активного хлора и переход его в связанное состояние при хлорировании воды. Расчет дозы потребления активного хлора при использовании в качестве хлорагента аналогичен тому, что мы приводили в статье «Хлорирование питьевой воды».
2.2. Бактерицидные свойства ГПХН
Наличие хлорноватистой кислоты в водных растворах гипохлорита натрия объясняет его сильные дезинфицирующие и отбеливающие свойства.
Гипохлорит натрия (NaOCl) на сегодняшний момент одно из лучших известных средств, проявляющих благодаря гипохлорит-аниону сильную антибактериальную активность. Это средство убивает микроорганизмы очень быстро и при достаточно низких концентрациях, поскольку разложение гипохлорита сопровождается образованием ряда активных частиц (радикалов) и, в частности, синглетного кислорода, обладающего высоким биоцидным действием. (подробнее см. в статье «Хлорирование питьевой воды». Образующиеся при распаде ГПХН частицы (радикалы) способствуют в уничтожении микроорганизмов (способных к окислению), разрушая окружающую их биопленку, что приводит к «гибели» микроорганизмов.
Примечание: Исследованиями установлено, описанный выше процесс аналогичен тому, что происходит естественным образом во всех высших организмах. Так, некоторые клетки человека (нейтрофилы, гепатоциты и др.) синтезируют хлорноватистую кислоту и сопутствующие ей высокоактивные радикалы для борьбы с микроорганизмами и чужеродными субстанциями.
Наивысшая бактерицидная активность гипохлорита натрия проявляется в нейтральной среде, когда концентрации HClO и гипохлорит-анионов ClO − в процессе гидролиза и диссоциации ГПХН приблизительно равны.
Что касается бактерицидных свойств ГПХН, то можно привести несколько примеров:
- грибки, вызывающие кандидоз, Candida albicans, погибают in vitro в течение 30 секунд при действии 5,0 ± 0,5%-го раствора NaOCl (при концентрации действующего вещества ниже 0,05 % они проявляют устойчивость только спустя 24 часа после воздействия на них ГПХН);
- более резистентные к действию гипохлорита натрия энтерококки. Так, например, патогенный Enterococcus faecalis погибает через 30 секунд после обработки 5,25% -ым раствором или через 30 минут после обработки 0,5%-ым раствором;
- грамотрицательные анаэробные бактерии, такие как Porphyromonas gingivalis, Porphyromonas endodontalis и Prevotella intermedia, погибают в течение 15 секунд после обработки 5,0 ± 0,5%-м раствором NaOCl.
Количественная оценка эффективности химических бактерицидов и их квалификация приведена в Таблице 2.2.
Спектральная активность дезинфицирующих средств по отношению к определенным видам микроорганизмов приведена в Таблице 2.3.
Высокие окислительные свойства гипохлорита натрия позволяют его успешно использовать для обезвреживания различных токсинов (см. Таблицу 2.4).
2.3. Коррозионная активность ГПХН
Гипохлорит натрия оказывает довольно сильное коррозионное воздействие на различные материалы. Это обусловлено его высокими окислительными свойствами, которые были рассмотрены нами ранее. Поэтому при подборе конструкционных материалов для изготовления установок очистки воды это необходимо учитывать. В таблице, которая приводится ниже, представлены данные по скорости коррозии некоторых материалов при воздействии на них растворов гипохлорита натрия различной концентрации и при различной температуре. Более подробную информацию по коррозионной устойчивости различных материалов по отношению к растворам ГПХН можно найти в Таблице химической совместимости (в формате rar-архива), размещенной на нашем сайте.
Не менее важно учитывать и то обстоятельство, что фильтрующие загрузки, которые используются для скорых насыпных фильтров, могут изменять свои фильтрующие свойства при воздействии на них ГПХН, точнее активного хлора, например, при подборе фильтрующей среды для процесса каталитического обезжелезивания – катализаторов обезжелезивания.
Не следует забывать, что активный хлор оказывает негативное влияние на мембранные процессы, в частности он вызывает деструкцию мембран обратного осмоса (об этом мы рассказывали в нашей статье «Обратный осмос. Теория и практика применения.»), а при высоком содержании (более 1 мг/л) отрицательно влияет на процессы ионного обмена.
Что касается материалов, из которых следует изготавливать собственно систему дозирования ГПХН, то здесь надо ориентироваться на концентрации активного хлора в рабочих растворах ГПХН, которые, естественно, существенно выше концентраций в обрабатываемой воде. Об этом мы поговорим немного позже.
Скорость коррозии некоторых материалов при воздействии на них растворов ГПХН
| Материал | Концентрация NaClO, % масс. | Температура, °C | Скорость коррозии, мм/год | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Алюминий | 10 при pH > 7 | 25 | > 10 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Медь | 2 | 20 | 10 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Сталь Ст.3 | 0,1 при pH > 10 | 20 | 0,1 | 25 | > 10,0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Сталь 12Х17, 12Х18Н10Т | 5 | 20 | > 10,0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Сталь 10Х17Н13М2Т | 7 | 25 | 0,1 | 25 | > 10,0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Чугун СЧ15, СЧ17 | о С); И вот в этих «адских» для ГПХН условиях от него нужно добиться максимальной отдачи. Ну а теперь опишем алгоритм выполнения операций при эксплуатации бассейна:
Как мы убедились, процесс дезинфекции воды в бассейне достаточно сложен и включает в себя несколько стадий. Поэтому для полной автоматизации этого процесса и исключения из него «человеческого» фактора были разработаны системы дозирования, состоящие из одного, двух или даже трех насосов-дозаторов, контроллеров, датчиков, электрохимических ячеек и т.д. Их описание можно найти на этой страничке. 3.2. Обработка бытовых и промышленных сточных водОчистка сточных вод заключается в их обезвреживании и обеззараживании. Хлорирование сточных вод. 3.3. Использование гипохлорита натрия в пищевой промышленностиВысокий риск для здоровья потребителя всегда вызывается испорченными пищевыми продуктами, что ни в коей мере нельзя недооценивать. Чаще всего порча пищевых продуктов вызывается микроорганизмами, которые во время технологического процесса изготовления пищевого продукта попадают на него с плохо очищенных и некачественно продезинфицированных поверхностей технологического оборудования, из плохо подготовленных воды, воздуха, из некачественного сырья, из некорректно отведенных промывных вод, и, наконец, от производственного персонала.
Помимо своих специфических критериев и соответствующего случаю применения дезинфектанта необходимой эффективности и селективности, химические дезинфицирующие средства в пищевой промышленности выбираются исходя из того, как будут они применяться «открытым» или «закрытым» способом.
Принятые в таблице обозначения: С – силикаты; П – поверхностно-активные вещества, О – отдушки; Ф – фосфаты; А – альдегиды; И – ингибиторы коррозии; СЖ – стабилизаторы жесткости; К – комплексообразователи. Нам хорошо известно, что решающим фактором при приобретении какого-либо пищевого продукта являются его вкусовые характеристики. Поэтому технологи пищевой промышленности неохотно используют средства дезинфекции с хлорсодержащими агентами, поскольку активный хлор уж очень «активно влияет» на вкус и запах продукции. Исключение составляет наружная дезинфекция технологического оборудования, ввиду того, что хлор обладает замечательным пролонгирующим действием. Гипохлорит натрия относится к числу таких средств. Обычно для дезинфекции технологического оборудования применяют раствор ГПХН, содержащий 30-40 мг/л активного хлора. Бактерицидное действие гипохлорита натрия проявляется после нанесения раствора при 20-25оС и его экспозиции в течение 3-5 минут. Правда, в этом случае надо учитывать коррозионную активность растворов ГПХН, поэтому для снижения коррозирующего действия используют смесь гипохлорита натрия, каустической соды и метасиликата натрия (препарат «Гипохлор»). Коррозионная активность этого препарата в 10-15 раз меньше, чем обычного гипохлорита натрия. 3.4. Использование гипохлорита в рыбоводствеРыбоводные пруды, орудия лова, живорыбная тара, рыбоводный инвентарь, а также спецодежда и обувь лиц, участвующих в проведении рыбоводных и ветеринарно-санитарных мероприятий, подлежат периодической очистке и дезинфекции (дезинвазии). Чаще всего для этого используется хлорная известь. Однако в последнее время для этой цели стали использовать гипохлорит натрия в виде разбавленных растворов. 3.5. Использование гипохлорита в здравоохраненииУже первой мировой войне гипохлорит натрия как антисептик с успехом применяли для перевязок при лечении ран и ожогов. Однако в то время чисто технические трудности массового производства, да и не очень хорошее качество препарата способствовали подписанию ему чуть ли не обвинительного приговора. Кроме того «подоспели» новые, как тогда казалось, более эффективные лекарства, и вскоре о гипохлорите забыли. и вспомнили в 60-е годы ХХ века во время войны во Вьетнаме. Там в обстановке, когда требовалось использовать наиболее действенные средства борьбы с инфекцией, отдавали предпочтение гипохлориту натрия, а не новейшим антибиотикам. Такая симпатия объяснялась не только высокой эффективностью ГПХН, но и универсальностью препарата. Ведь во фронтовых условиях вместо дюжины упаковок лучше иметь под рукой один флакон с раствором, которым можно и рану промыть, и кожу перед операцией продезинфицировать, и инструменты обработать. 3.6. Использование ГПХН для отбеливания белья в фабриках-прачечныхСчитается, что отбеливание белья при промышленной стирке – самая потенциально опасная операция из всех операций, применяемых в стирке белья, а отбеливатель, соответственно, – самое опасное вещество для ткани. Большинство отбеливателей, применяемых при промышленной стирке, являются сильными окислителями, под воздействием которых большинство окрашенных веществ после их окисления становятся или бесцветными, или растворимыми в воде. И как любой окислитель, отбеливатель одновременно «атакует» как пятна, так и волокна ткани. Поэтому всегда при отбеливании побочным процессом будет разрушение волокна ткани. Отбеливатели, применяемые при промышленной стирке, бывают трех типов: пероксидные (перекисные или кислородосодержащие), хлорные и серосодержащие. В рамках данной публикации мы остановимся только на одном из хлорсодержащих отбеливателей тканей – гипохлорите натрия. NaOCl → NaCl + [O]. Поэтому без гипохлорита натрия не обойтись при отбелке больничного белья или белья, пораженного плесенью. 40°С). При повышении температуры (вплоть до 60°С) активность отбеливателя на основе ГПНХ растет линейно, а при более высокой температуре наблюдается экспоненциальная зависимость роста активности отбеливателя.
Как утверждают специалисты BLRA, если следовать этим рекомендациям, то в процессе отбеливания при использовании ГПХН удаляется большинство обычных пятен, а ткань получает минимальные повреждения. 3.7. Дезинфекция питьевой водыДозу хлора устанавливают технологическим анализом из расчета, чтобы в 1 л воды, поступающей к потребителю, оставалось 0,3…0,5 мг хлора, не вступившего в реакцию (остаточного хлора), который является показателем достаточности принятой дозы хлора. За расчетную следует принимать ту дозу хлора, которая обеспечивает указанное количество остаточного хлора. Расчетная доза назначается в результате пробного хлорирования. Для осветленной речной воды доза хлора обычно колеблется в пределах 1,5 – 3 мг/л; при хлорировании подземных вод доза хлора чаще всего не превышает 1– 1,5 мг/л; в отдельных случаях может потребоваться увеличение дозы хлора из-за наличия в воде закисного железа. При повышенном содержании в воде гуминовых веществ требуемая доза хлора возрастает. Обеззараживание хлором. Итак, налицо основные преимущества применения хлора для хлорирования воды:
Именно поэтому в течение многих десятилетий сжиженный хлор являлся наиболее надежным и универсальным средством обеззараживания воды в системах централизованного водоснабжения населенных мест. Казалось бы – почему же не продолжать использовать хлор для обеззараживания воды? Давайте разберемся вместе…
Не оставляет сомнения, что оборудование, необходимое для дозирования столь смертоносного реагента (об этом почти регулярно свидетельствует статистика) должно обладать целым рядом степеней безопасности.
а при потреблении газообразного хлора из баллонов более 2 кг/час или более 7 кг/час при потреблении хлора из контейнера – испарители хлора, к которым предъявляются особые требования. Они должны быть оснащены автоматическими системами, предотвращающими:
Испаритель должен быть снабжен специальным отсекающим электромагнитным вентилем на входе, манометром и термометром. То есть степень опасности хлора минимизируется наличием целого комплекса мер по организации его хранения и использования, в том числе за счет организации санитарно-защитных зон (СЗЗ) складов реагента, радиус которых достигает 1000 м для наиболее крупных сооружений. Обеззараживание гипохлоритом натрия
Таким образом, в отличие от хлора растворы ГПХН имеют щелочной характер и могут применяться для повышения уровня рН обрабатываемой воды.
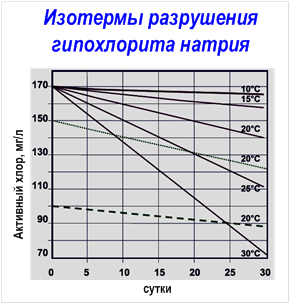
Потерю активности растворов ГПХН со временем наглядно иллюстрирует следующая таблица:
Ввод рабочего раствора ГПХН в обрабатываемую воду осуществляют методом пропорционального дозирования с помощью насосов-дозаторов. При этом пропорциональное дозирование ( управление насосом-дозатором ) может производиться как с использованием импульсных счетчиков воды, так и по сигналу датчика хлора, установленного либо непосредственно в трубопроводе, либо после контактной емкости. После узла ввода ГПХН или на входе в контактную емкость обычно устанавливают динамический смеситель для тщательного перемешивания обрабатываемой воды с рабочим раствором ГПХН. Таким образом, казалось бы, преимущества применения гипохлорита натрия перед хлором при хлорировании воды, достаточно явные: он значительно безопаснее – не горюч и не взрывоопасен; нет необходимости в дополнительном оборудовании, обеспечивающего безопасность процесса хлорирования, кроме наличия: 6-кратной вентиляции, резервуара для сбора вытекшего гипохлорита натрия и емкости с нейтрализующим раствором (тиосульфат натрия). Применяемое при использовании ГПХН оборудование для обеспечения процесса обеззараживания на станциях водоподготовки не относится к категории промышленно опасного и не поднадзорно Федеральной службе по экологическому, технологическому и атомному надзору. Это облегчает жизнь эксплуатационникам. Мы уже неоднократно говорили о том, что растворы ГПХН неустойчивы и подвержены разложению. Так вот по данным Мосводоканала выяснено, что гипохлорит натрия марки «А» теряет до 30% от первоначального содержания активной части в результате хранения по истечении 10 суток. К этому добавляется и то обстоятельство, что он замерзает в зимнее время при температуре -25°С, а в летнее время наблюдается выпадение осадка, что приводит к необходимости использования железнодорожных цистерн с термоизоляцией для перевозки реагента. Вывод: 3.8. Обеззараживание ГПХН оборудования для очистки водыПри обеспечении населения питьевой водой безупречно чистой в микробиологическом отношении не только сама вода должна быть очищена от патогенных бактерий, вирусов и паразитов, но и оборудование, используемое для водоснабжения: трубопроводы, емкости (резервуары), арматура, фильтры и насосы, которые используются при обработке воды и находятся в непосредственном контакте с ней.
Во избежание повышенного расхода дезинфектанта в емкость устанавливают специальные моющие головки (форсунки), которые позволяют при распылении дезинфицирующего раствора обработать всю поверхность емкости. При этом резко снижается расход дезинфектанта, и появляется возможность работы в режиме рециркуляции дезраствора через систему CIP (от англ. Clean In Place – очистка на месте) – безразборной автоматической мойки. При этом содержание активного хлора в растворе может составлять от 50 до 200 мг/л. ПОСЛЕДНИЕ НОВОСТИ: 08.02.2018 Компания «Мировые Водные Технологии» создала новый раздел Реагентная обработка воды, процессы которой осуществляют путем внесения того или иного химического вещества (реагента) в обрабатываемую воду с целью изменения того или иного показателя качества воды до требуемой величины. 08.02.2018 Компания «Мировые Водные Технологии» создала новый раздел Реагентная обработка воды, процессы которой осуществляют путем внесения того или иного химического вещества (реагента) в обрабатываемую воду с целью изменения того или иного показателя качества воды до требуемой величины. Источник | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||