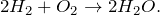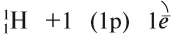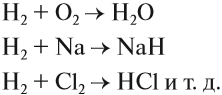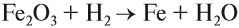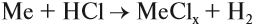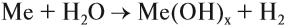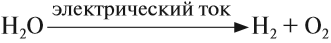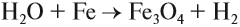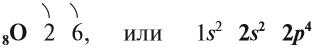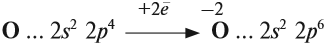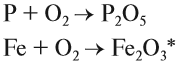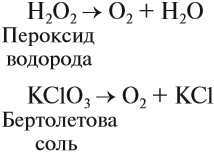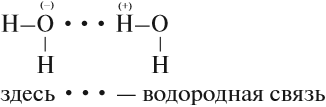Водород + кислород = вода
Запишите уравнение реакции по схеме водород + кислород = вода. Расставьте стехиометрические коэффициенты. Объясните, чем обусловлена кристаллизация полимеров? Какие факторы определяют этот процесс?
Химическое уравнение реакции, описывающейся схемой водород + кислород = вода имеет следующий вид:
Кристаллизация связана со встраиванием фрагментов макроцепей в трехмерную кристаллическую решетку, характеризующуюся высокой плотностью упаковки. Для полимеров возможность протекания подобных процессов определяется их химической структурой, а также конфигурационной и конформационной изомерией.
Во-первых, упорядоченные кристаллические структуры могут образовывать только полимеры регулярного строения с четко заданной конфигурацией, напрмер изо- и синдиотактические. Атактические полимеры, как правило, не кристаллизуются ни при каких условиях.
Во-вторых, для встраивания в кристаллическую решетку фрагменты макромолекул должны принять определенную конформацию, обеспечивающую наибольшее упорядочение и реализацию максимально возможной плотности упаковки. Например, кристаллизация с образованием ламелей протекает за счет складывания макромолекул. Образование таких складок требует высокой гибкости цепи и широкого набора разрешенных конформаций.
В-третьих, объемные боковые заместители затрудняют плотную упаковку макромолекул, препятствуя тем самым кристаллизации полимера. Напротив, наличие полярных атомных групп способствует кристаллизации вследствие образования прочных межмолекулярных взаимодействий, стабилизирующих образующуюся кристаллическую фазу.
Источник
Реакция водорода с кислородом
Реакция взаимодействия водорода с кислородом.
Уравнение реакции взаимодействия водорода с кислородом:
Водород взаимодействует с кислородом. Реакция взаимодействия водорода с кислородом представляет собой сгорание водорода на воздухе.
Реакция водорода с кислородом протекает при условии: при температуре 510 °C. Температура 510 °C является температурой самовоспламенения водорода.
В результате реакции водорода с кислородом происходит образование воды .
В ходе реакции водорода с кислородом при стандартных условиях выделяется тепловая энергия (теплота) 483,64 кДж (агрегатное состояние воды – газ) или 571,66 кДж (агрегатное состояние воды – жидкость).
Термохимическое уравнение этой реакции имеет следующий вид:
2Н 2 (г) + О 2 (г) = 2Н 2 О(г) + 483,64 кДж; ΔH = -241,82 кДж/моль,
2Н 2 (г) + О 2 (г) = 2Н 2 О(ж) + 571,66 кДж; ΔH = -285,83 кДж/моль.
Таким образом, реакция водорода с кислородом носит экзотермический характер.
Удельная теплота сгорания водорода составляет примерно 140 МДж/кг (верхняя) или 120 МДж/кг (нижняя), что в несколько раз превышает удельную теплоту сгорания углеводородных топлив (например, метана – 50,1 МДж/кг).
Источник
Как создать воду из водорода и кислорода
Вода — это общее название монооксида диоксида водорода или H2O .
Молекула образуется в результате многочисленных химических реакций, включая реакцию синтеза ее элементов, водорода и кислорода.
Сбалансированное химическое уравнение для реакции таково :
2 H2 + O2 + O2 → 2 H2O
Как сделать воду
Теоретически, легко сделать воду из водорода и кислорода.
Нужно смешать два вещества вместе, добавить достаточное количество тепла, чтобы обеспечить энергию активации для начала реакции.
Простое же смешивание двух газов при комнатной температуре, однако, ничего не даст, так как молекулы водорода и кислорода в воздухе не образуют спонтанно реакцию.
Для разрыва ковалентных связей, удерживающих молекулы H2 и O2 вместе, необходима энергия.
Затем катионы водорода и анионы кислорода свободно вступают в реакцию друг с другом, делают они это из-за различий в их электроотрицательности.
Когда химические связи восстанавливаются, образуя воду, высвобождается дополнительная энергия, которая распространяет реакцию. Чистая реакция является высоко экзотермической, т.е. реакцией, сопровождающейся выделением тепла.
Две демонстрации
Одной из распространенных химических демонстраций является наполнение небольшого воздушного шарика водородом и кислородом и прикосновение к воздушному шару — с расстояния и за щитом безопасности — горящей шиной.
Более безопасным вариантом является наполнение воздушного шара газом водорода и зажигание воздушного шара в воздухе.
Ограниченный кислород в воздухе реагирует на образование воды, но в более контролируемой реакции.
Еще одна простая демонстрация заключается в пузырьке водорода добавленного в мыльную воду.
Пузырьки плавают, потому что они легче воздуха.
Зажигалка с длинной рукояткой или горящая шина может быть использована для зажигания и образования воды.
Можно использовать водород из баллона со сжатым газом или в результате нескольких химических реакций ( например, реакции кислоты с металлом ).
Источник
Урок 12. Водород и кислород
Водород
Водород — самый распространённый химический элемент во Вселенной. Именно он составляет основу горючего вещества Звёзд.
Водород — первый химический элемент Периодической системы Менделеева. Его атом имеет простейшее строение: вокруг элементарной частицы «протон» (ядро атома) вращается один-единственный электрон:
Природный водород состоит из трех изотопов: протий 1 Н, дейтерий 2 Н и тритий 3 Н.
Задание 12.1. Укажите строение ядер атомов этих изотопов.
Имея на внешнем уровне один электрон, атом водорода может проявлять единственно возможную для него валентность I:
Вопрос. Образуется ли завершённый внешний уровень при приёме атомом водорода электронов?
Таким образом, атом водорода может и принимать, и отдавать один электрон, т. е. является типичным неметаллом. В любых соединениях атом водорода одновалентен.
Простое вещество «водород» Н2 — газ без цвета и запаха, очень лёгкий. Он плохо растворим в воде, но хорошо растворим во многих металлах. Так, один объём палладия Рd поглощает до 900 объёмов водорода.
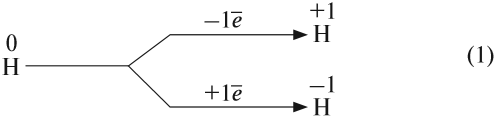
Схема (1) показывает, что водород может быть и окислителем, и восстановителем, реагируя с активными металлами и многими неметаллами:
Задание 12.2. Определите, в каких реакциях водород является окислителем, а в каких — восстановителем. Обратите внимание, что молекула водорода состоит из двух атомов.
Смесь водорода и кислорода является «гремучим газом», поскольку при поджигании её происходит сильнейший взрыв, который унёс многие жизни. Поэтому опыты, в которых выделяется водород, нужно выполнять подальше от огня.
Чаще всего водород проявляет восстановительные свойства, что используется при получении чистых металлов из их оксидов*:
* Аналогичные свойства проявляет алюминий (см. урок 10 — алюминотермия).
Разнообразные реакции происходят между водородом и органическими соединениями. Так, за счёт присоединения водорода (гидрирование) жидкие жиры превращаются в твёрдые (подробнее урок 25).
Водород можно получить разными способами:
- Взаимодействием металлов с кислотами:
Задание 12.3. Составьте уравнения таких реакций для алюминия, меди и цинка с соляной кислотой. В каких случаях реакция не идет? Почему? В случае затруднения см. уроки 2.2 и 8.3;
- Взаимодействие активных металлов с водой:
Задание 12.4. Составьте уравнения таких реакций для натрия, бария, алюминия, железа, свинца. В каких случаях реакция не идёт? Почему? В случае затруднений см. урок 8.3.
В промышленных масштабах водород получают электролизом воды:
а также при пропускании паров воды через раскалённые железные опилки:
Водород — самый распространённый элемент Вселенной. Он составляет бОльшую часть массы звёзд и участвует в термоядерном синтезе — источнике энергии, которую эти звёзды излучают.
Кислород
Кислород — самый распространённый химический элемент нашей планеты: более половины атомов Земной коры приходится на кислород. Вещество кислород О2 составляет около 1/5 нашей атмосферы, а химический элемент кислород — 8/9 гидросферы (Мирового океана).
В Периодической системе Менделеева кислород имеет порядковый номер 8 и находится в VI группе второго периода. Поэтому строение атома кислорода следующее:
Имея на внешнем уровне 6 электронов, кислород является типичным неметаллом, т. е. присоединяет два электрона до завершения внешнего уровня:
Поэтому кислород в своих соединениях проявляет валентность II и степень окисления –2 (за исключением пероксидов).
Принимая электроны, атом кислорода проявляет свойства окислителя. Это свойство кислорода исключительно важно: процессы окисления происходят при дыхании, обмене веществ; процессы окисления происходят при горении простых и сложных веществ.
Горение — окисление простых и сложных веществ, которое сопровождается выделением света и теплоты. В атмосфере кислорода горят или окисляются почти все металлы и неметаллы. При этом образуются оксиды:
При горении в кислороде сложных веществ образуются оксиды химических элементов, входящих в состав исходного вещества. Только азот и галогены выделяются в виде простых веществ:
Вторая из этих реакций используется как источник тепла и энергии в быту и промышленности, так как метан CH4 входит в состав природного газа.
Кислород позволяет интенсифицировать многие промышленные и биологические процессы. В больших количествах кислород получают из воздуха, а также электролизом воды (как и водород). В небольших количествах его можно получить разложением сложных веществ:
Задание 12.5. Расставьте коэффициенты в приведенных здесь уравнениях реакций.
Воду нельзя ничем заменить — этим она отличается практически от всех других веществ, которые встречаются на нашей планете. Воду может заменить только сама вода. Без воды нет жизни: ведь жизнь на Земле возникла тогда, когда на ней появилась вода. Жизнь зародилась в воде, поскольку она является естественным универсальным растворителем. Она растворяет, а значит, измельчает все необходимые питательные вещества и обеспечивает ими клетки живых организмов. А в результате измельчения резко возрастает скорость химических и биохимических реакций. Более того, без предварительного растворения невозможно протекание 99,5 % (199 из каждых 200) реакций! (См. также урок 5.1.)
Известно, что взрослый человек в сутки должен получать 2,5–3 л воды, столько же выводится из организма: т. е. в организме человека существует водный баланс. Если он нарушается, человек может просто погибнуть. Например, потеря человеком всего 1–2 % воды вызывает жажду, а 5 % — повышает температуру тела вследствие нарушения терморегуляции: возникает сердцебиение, возникают галлюцинации. При потере 10 % и более воды в организме возникают такие изменения, которые уже могут быть необратимы. Человек погибнет от обезвоживания.
Вода — уникальное вещество. Её температура кипения должна составлять –80 °C (!), однако равна +100 °C. Почему? Потому что между полярными молекулами воды образуются водородные связи:
Поэтому и лёд, и снег — рыхлые, занимают больший объём, чем жидкая вода. В результате лёд поднимается на поверхность воды и предохраняет обитателей водоёмов от вымерзания. Свежевыпавший снег содержит много воздуха и является прекрасным теплоизолятором. Если снег покрыл землю толстым слоем, то и животные и растения спасены от самых суровых морозов.
Кроме того, вода имеет высокую теплоёмкость и является своеобразным аккумулятором тепла. Поэтому на побережьях морей и океанов климат мягкий, а хорошо политые растения меньше страдают от заморозков, чем сухие.
Без воды в принципе невозможен гидролиз, химическая реакция, которая обязательно сопровождает усвоение белков, жиров и углеводов, которые являются обязательными компонентами нашей пищи. В результате гидролиза эти сложные органические вещества распадаются до низкомолекулярных веществ, которые, собственно, и усваиваются живым организмом (подробнее см. уроки 25–27). Процессы гидролиза были нами рассмотрены в уроке 6. Вода реагирует со многими металлами и неметаллами, оксидами, солями.
Задание 12.6. Составьте уравнения реакций:
- натрий + вода →
- хлор + вода →
- оксид кальция + вода →
- оксид серы (IV) + вода →
- хлорид цинка + вода →
- силикат натрия + вода →
Изменяется ли при этом реакция среды (рН)?
Вода является продуктом многих реакций. Например, в реакции нейтрализации и во многих ОВР обязательно образуется вода.
Задание 12.7. Составьте уравнения таких реакций.
Выводы
Водород — самый распространённый химический элемент во Вселенной, а кислород — самый распространённый химический элемент на Земле. Эти вещества проявляют противоположные свойства: водород — восстановитель, а кислород — окислитель. Поэтому они легко реагируют друг с другом, образуя самое удивительное и самое распространённое на Земле вещество — воду.
Источник