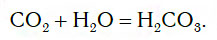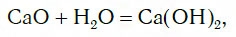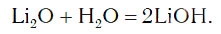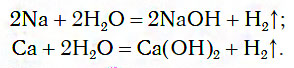- Вода: строение и свойства
- Физические свойства
- Химические свойства
- Составление химических реакций с водой
- Урок 28. Химические свойства воды
- Взаимодействие с оксидами неметаллов
- Взаимодействие с оксидами металлов
- Взаимодействие с металлами
- Химические свойства воды
- Химические свойства воды
- Урок химии. Химические свойства воды.
Вода: строение и свойства
Вода — строение молекулы, химические и физические свойства. Взаимодействие с простыми веществами (металлами и неметаллами), и со сложными веществами.
Физические свойства
Молекулы воды связаны водородными связями: nH2O = (Н2O)n, поэтому вода жидкая в отличие от ее газообразных аналогов H2S, H2Se и Н2Те.
Химические свойства
1. Вода реагирует с металлами и неметаллами .
1.1. С активными металлами вода реагирует при комнатной температуре с образованием щелочей и водорода :
2Na + 2H2O → 2NaOH + H2
- с магнием реагирует при кипячении:
- алюминий не реагирует с водой, так как покрыт оксидной плёнкой. Алюминий, очищенный от оксидной плёнки, взаимодействует с водой, образуя гидроксид:
- металлы, расположенные в ряду активности от Al до Н , реагируют с водяным паром при высокой температуре, образуя оксиды и водород:
- металлы, расположенные в ряду активности от после Н , не реагируют с водой:
Ag + Н2O ≠
2. Вода реагирует с оксидами щелочных и щелочноземельных металлов , образуя щелочи (с оксидом магния – при кипячении):
3. Вода взаимодействует с кислотными оксидами (кроме SiO2):
4. Некоторые соли реагируют с с водой. Как правило, в таблице растворимости такие соли отмечены прочерком :
Например , сульфид алюминия разлагается водой:
5. Бинарные соединения металлов и неметаллов , которые не являются кислотами и основаниями, разлагаются водой.
Например , фосфид кальция разлагается водой:
6. Бинарные соединения неметаллов также гидролизуются водой.
Например , фосфид хлора (V) разлагается водой:
6. Некоторые органические вещества гидролизуются водой или вступают в реакции присоединения с водой (алкены, алкины, алкадиены, сложные эфиры и др.).
Источник
Составление химических реакций с водой
Вода является очень реакционноспособным веществом вследствие наличия в ее молекуле двух неподеленных пар электронов.
Химические реакции с участием воды можно разделить на 3 группы:
1. Реакции, в которых вода проявляет окислительные свойства.
2. Реакции, в которых вода является восстановителем.
3. Реакции обмена и присоединения.
1. При комнатной температуре вода окисляет щелочные и щелочноземельные металлы (кроме магния):
Аналогично окисляются водой и гидриды щелочных и щелочноземельных металлов:
Магний и цинк в виде пыли окисляются водой при 

2. Вода окисляется атомарным кислородом и фтором при обычной температуре
В этой реакции образуются 


При взаимодействии хлора с водой протекает реакция с образованием хлорноватистой и соляной кислот
Аналогично протекают реакции при растворении в воде брома и иода с той лишь разницей, что равновесие сильно сдвинуто (в особенности для 
Следует также иметь в виду, что хлор при температуре выше 100° или на холоду при действии света, а бром при 550° и выше окисляют воду с выделением кислорода
3. Многие вещества (соли, галогенангидриды и др.) вступают с водой в реакции обмена и присоединения:
При растворении в воде солей, кислот, оснований и других веществ происходит их гидратация, т. е. присоединение молекул воды к молекуле растворенного вещества.
Большое значение имеет каталитическое действие воды. Многие реакции протекают только в присутствии следов воды и совсем не идут без нее. Так, например, хлор при полном отсутствии влаги не действует на железо, гремучая смесь без следов влаги не взрывает, в сухом виде 

В некоторых случаях вода является каталитическим ядом, например, для железа при синтезе аммиака.
Источник
Урок 28. Химические свойства воды
В уроке 28 «Химические свойства воды» из курса «Химия для чайников» узнаем о взаимодействии воды с различными веществами.
При обычных условиях вода является достаточно активным веществом по отношению к другим веществам. Это означает, что со многими из них она вступает в химические реакции.
Взаимодействие с оксидами неметаллов
Если струю газообразного оксида углерода(IV) CO2 (углекислого газа) направить в воду, то часть его растворится в ней (рис. 109).
При этом в растворе протекает химическая реакция соединения, в результате которой образуется новое вещество — угольная кислота H2CO3:
На заметку: Собирая углекислый газ над водой, Дж. Пристли обнаружил, что часть газа растворяется в воде и придает ей приятный терпкий вкус. По сути дела, Пристли впервые получил напиток типа газированной, или содовой, воды.
Реакция соединения происходит также, если к воде прибавить твердый оксид фосфора(V) P2O5. При этом протекает химическая реакция с образованием фосфорной кислоты H3PO4 (рис. 110):
Испытаем растворы, полученные при взаимодействии CO2 и P2O5 с водой, индикатором метиловым оранжевым. Для этого прибавим по 1—2 капли раствора индикатора к полученным растворам. Цвет индикатора изменится с оранжевого на красный, что говорит о присутствии кислот в растворах. Значит, при взаимодействии CO2 и P2O5 с водой действительно образовались кислоты H2CO3 и H3PO4.
Оксиды, подобные CO2 и P2O5, которые при взаимодействии с водой образуют кислоты, относят к кислотным оксидам.
Кислотные оксиды — это оксиды, которым соответствуют кислоты.
Некоторые из кислотных оксидов и соответствующих им кислот приведены в таблице 11. Обратите внимание, что это оксиды элементов неметаллов. Как правило, оксиды неметаллов являются кислотными оксидами.
Взаимодействие с оксидами металлов
С оксидами металлов вода реагирует иначе, чем с оксидами неметаллов.
Исследуем взаимодействие оксида кальция CaO с водой. Для этого поместим в стакан с водой небольшое количество CaO и тщательно перемешаем. При этом протекает химическая реакция:
в результате которой образуется новое вещество Ca(OH)2, относящееся к классу оснований. Таким же образом реагируют с водой оксиды лития, натрия. При этом также образуются основания, например:
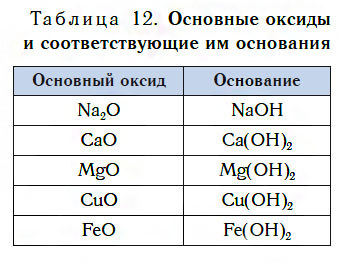
Подробнее с основаниями вы познакомитесь в следующем уроке. Оксиды металлов, которым соответствуют основания, называют основными оксидами.
Основные оксиды — это оксиды, которым соответствуют основания.
В таблице 12 приведены формулы некоторых основных оксидов и соответствующих им оснований. Заметьте, что, в отличие от кислотных оксидов, в состав основных оксидов входят атомы металлов. Большинство оксидов металлов — это основные оксиды.
Несмотря на то что каждому основному оксиду соответствует основание, не все основные оксиды взаимодействуют с водой, подобно CaO, образуя основания.
Взаимодействие с металлами
При обычных условиях активные металлы (K, Na, Ca, Ba и др.) бурно реагируют с водой:
В этих реакциях выделяется водород и образуются растворимые в воде основания.
Как химически активное вещество вода вступает в реакции со многими другими веществами, но об этом вы узнаете при дальнейшем изучении химии.
Краткие выводы урока:
- Вода — химически активное вещество. Она вступает в реакции с кислотными и основными оксидами, активными металлами.
- При взаимодействии воды с большинством кислотных оксидов образуются соответствующие кислоты.
- Некоторые основные оксиды при реакции с водой образуют растворимые основания.
- При обычных условиях вода реагирует с наиболее активными металлами. При этом образуются растворимые основания и водород.
Надеюсь урок 28 «Химические свойства воды» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Источник
Химические свойства воды
Вода окружает нас повсюду, без неё человек не может жить. Мы на каждом шагу встречаемся с собственно водой и с водными растворами (например, морской водой или даже водопроводной). А может ли вода вступать в химические реакции и в каких случаях это происходит? Сейчас мы это и узнаем.
Химические свойства воды
1. Вода при высокой температуре или пропускании тока разлагается на газообразные водород кислород:
2. Вода взаимодействует с активными металлами с образованием гидроксидов и газообразного водорода. К активным металлам относятся металлы первой и второй групп таблицы Менделеева. С щелочными металлами (металлы первой группы) реакции идут довольно активно, поскольку газообразный водород выделяется бурно, поэтому проводить их нужно очень аккуратно. Уравнение реакции между щелочным металлом калием и водой выглядит так:
2К + 2Н2О = 2КОН + Н2
Аналогично протекают и реакции между щелочно-земельными металлами (металлами второй группы) и водой.
3. Вода взаимодействует с менее активными металлами с образованием оксидов и газообразного водорода. Например, цинк при взаимодействии с водой даёт оксид цинка и водород:
Zn + O2 = ZnO + H2
С инертными металлами (в ряду напряжений они стоят после водорода) вода не взаимодействует.
4. Вода взаимодействует с основными оксидами с образованием гидроксидов :
МgO + H2O = Mg(OH)2
5. Вода взаимодействует с кислотными оксидами с образованием кислот:
SO3 + H2O = H2SO4
А ещё воды является чуть ли не главным растворителем. В ней растворяются и газы, и жидкости и твёрдые вещества, причём в зависимости от условий можно получать самые разные растворы. С образованием растворов связано понятие массовой доли растворённого вещества . Понимать, как рассчитывать массовую долю растворённого вещества, очень важно, поскольку в неорганической химии много задач связано именно с этим.
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
Источник
Урок химии. Химические свойства воды.
8 класс. Урок № 35.
Тема. Химические свойства воды.
Цель урока: изучить с обучающимися химические свойства воды. Научить записывать уравнения реакций воды с активными металлами, оксидами металлов и неметаллов.
Планируемые результаты обучения
1) личностные. Ф ормировать ответственное отношение к обучению, готовность и способность к саморазвитию и самообразованию на основе мотивации к обучению и познанию.
2) метапредметные. Развивать умение применять знаки и символы для решения учебных и познавательных задач.
3) предметные. Уметь составлять уравнения реакций воды с активными металлами, а также оксидами металлов и неметаллов.
Демонстрационный опыт №12. Взаимодействие воды с металлами (натрием, магнием).
Демонстрационный опыт №13. Взаимодействие воды с оксидами кальция, фосфора, углекислым газом. Испытание полученных растворов индикаторами.
Оборудование: периодическая система химических элементов Д.И. Менделеева, таблица растворимости кислот, оснований, солей, мультимедиа доска, комплект реактивов и химической посуды для выполнения демонстрационных опытов, учебник «Х имия. 8 класс. / Г.Е. Рудзитис, Ф.Г. Фельдман. — М.: Просвещение, 2014».
1. Организация начала урока.
Проверяю готовность класса к уроку, отмечаю отсутствующих, записываем число и « Классная работа» .
Просмотр наличия выполнения домашнего задания, один обучающийся на доске записывает ответы домашнего задания для самопроверки правильности.
2. Актуализация опорных знаний обучающихся. Подготовка к усвоению нового материала.
2.1. На рабочих местах фронтальная беседа по вопросам (демонстрация вопросов на мультимедиа доске).
1. Какие простые вещества мы изучили?
2. Назовите формулы простых веществ кислорода и водорода.
3. Приведите примеры соединений, содержащих атомы водорода и запишите их формулы.
4. В результате каких реакций можно получить водород?
5. Что называют химической реакцией?
6. Какие типы реакций Вы знаете?
2.2. Объявляются (и комментируются) оценки за практическую работу.
3. Формулирование темы урока при участии обучающихся.
— На предыдущем уроке мы выполняли практическую работу по приготовлению растворов солей.
— Вы заметили главную особенность растворов — свойства воды и свойства соли в растворе сохраняются.
— То есть, приготовление растворов — это физическое явление.
— А возможно ли такое взаимодействие с водой, при котором образуются новые вещества, то есть будет протекать химическая реакция между водой и веществом?
— Как можно сформулировать тему урока в этом случае?
Обучающиеся формулируют возможную тему урока.
— Запишите тему нынешнего урока: Химические свойства воды.
4. Формулирование целей и задач урока при помощи обучающихся. Мотивация учебной деятельности.
— изучить взаимодействие воды с другими веществами, в результате которого образуются новые химические вещества;
— научиться составлять уравнения химических реакций воды с различными простыми и сложными веществами;
— повторить алгоритм составления уравнений химических реакций;
— ф ормировать ответственное отношение к обучению, готовность и способность к саморазвитию.
5. Изучение нового материала. Химические реакции.
5.1. Разложение под действием электрического тока или сильного нагревания (около 2000 о С).
В результате реакции образуются прозрачные газообразные вещества — водород и кислород
Демонстрационный опыт №12. Взаимодействие воды с металлами (натрием, магнием).
Вода при комнатной температуре легко вступает в реакцию с активными металлами. При этом атом металла замещает один из атомов водорода, вытесняя его из воды с последующим образованием газообразного водорода. Также образуются хорошо растворимые в воде гидроксиды металлов.
2 Na + 2 HOH = 2 NaOH + H 2
С a + 2 HOH = С a ( OH ) 2 + H 2
5.3. Взаимодействие с металлами средней активными ( Mg , Zn , Fe ).
Вода при повышенной температуре (500 – 600 о С) вступает в реакцию с металлами средней активности. При этом атом металла замещает атомы водорода, вытесняя их из воды в виде газообразного водорода. Также образуются оксиды металлов.
М g + HOH = MgO + H 2
Zn + HOH = ZnO + H 2
Ф И З К У Л Ь Т М И Н У Т К А
Демонстрационный опыт №13. Взаимодействие воды с оксидами кальция, фосфора, углекислым газом. Испытание полученных растворов индикаторами.
Вода при комнатной температуре легко вступает в реакцию со сложными веществами — оксидами активных металлов:
С aO + H 2 O = С a ( OH ) 2
При добавлении к образующемуся раствору гидроксида металла (щелочи) раствора красного лакмус а весь объём раствора становится синим , а прозрачный раствор фенолфталеин а становится малиновым.
Вода при комнатной температуре легко вступает в реакцию со сложными веществами — оксидами неметаллов:
Вода вступает в реакцию с оксидом фосфора ( V ) при комнатной температуре:
При нагревании или с горячей водой реакция протекает по-другому:
При добавлении к образующемуся раствору кислоты раствора синего лакмус а весь объём раствора становится красным , а прозрачный раствор фенолфталеин а не изменяет свой цвет.
5.6. Взаимодействие с некоторыми неметаллами при нагревании.
Водяной пар при температуре свыше 1000°C взаимодействует с раскаленным коксом (углём) с образованием водяного газа (смесь водорода и оксида углерода (II) – угарного газа).
6. Первичное закрепление изученного материала.
6.1. Игра «Найди пару». К формуле простого или сложного вещества найдите соответствующую формулу продукта реакции его с водой.
Г) Na 4) С a ( OH ) 2
7. Закрепление, обсуждение и коррекция изученного материала.
Обсуждение правильности выполнения заданий игры, повторение химических свойств воды.
8. Подведение итогов занятия.
Подводится итог-обобщение изученного на уроке материала.
Объявление оценок, полученных обучающимися за урок.
9. Задаётся и объясняется домашнее задание.
— Ребята! Запишите, пожалуйста, домашнее задание к следующему уроку (задание появляется на мультимедиа доске или записано на обороте обычной доски):
Учить §32 (с.107, 108) (химические свойства воды),
Источник