- Способ перекрывания орбиталей вода
- Глава 10. Метод валентных связей
- Перекрывание атомных орбиталей
- Механизмы образования ковалентных связей
- Гибридизация атомных орбиталей
- Дипольные моменты молекул
- Строение молекулы воды
- МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ В АНАЛИЗЕ СТРОЕНИЯ МОЛЕКУЛЫ ВОДЫ
- Из этих данных и умозаключений можно сделать следующие выводы.
Способ перекрывания орбиталей вода
Основы строения вещества
Глава 10. Метод валентных связей
Метод валентных связей основывается на положении, что каждая пара атомов в химической частице удерживается вместе при помощи одной или нескольких электронных пар. Эти пары электронов принадлежат двум связываемым атомам и локализованы в пространстве между ними. За счет притяжения ядер связываемых атомов к этим электронам и возникает химическая связь.
Перекрывание атомных орбиталей
При описании электронного строения химической частицы электроны, в том числе и обобществленные, относят к отдельным атомам и их состояния описывают атомными орбиталями. При решении уравнения Шредингера приближенную волновую функцию выбирают так, чтобы она давала минимальную электронную энергию системы, то есть наибольшее значение энергии связи. Это условие достигается при наибольшем перекрывании орбиталей, принадлежащей одной связи. Таким образом, пара электронов, связывающих два атома, находится в области перекрывания их атомных орбиталей.
Перекрываемые орбитали должны иметь одинаковую симметрию относительно межъядерной оси.
Перекрывание атомных орбиталей вдоль линии, связывающей ядра атомов, приводит к образованию σ-связей. Между двумя атомами в химической частице возможна только одна σ-связь. Все σ-связи обладают осевой симметрией относительно межъядерной оси. Фрагменты химических частиц могут вращаться вокруг межъядерной оси без нарушения степени перекрывания атомных орбиталей, образующих σ-связи. Совокупность направленных, строго ориентированных в пространстве σ-связей создает структуру химической частицы.
При дополнительном перекрывании атомных орбиталей, перпендикулярных линии связи, образуются π-связи.
В результате этого между атомами возникают кратные связи:
| Одинарная (σ) | Двойная (σ +π) | Тройная (σ + π + π) |
| F−F | O=O | N≡N |
С появлением π-связи, не имеющей осевой симметрии, свободное вращение фрагментов химической частицы вокруг σ-связи становится невозможным, так как оно должно привести к разрыву π-связи. Помимо σ- и π-связей, возможно образование еще одного вида связи — δ-связи:
Обычно такая связь образуется после образования атомами σ- и π-связей при наличии у атомов d— и f-орбиталей путем перекрывания их «лепестков» сразу в четырех местах. В результате кратность связи может возрасти до 4-5.
Например, в октахлородиренат(III)-ионе [Re2Cl8] 2- между атомами рения образуются четыре связи.
Механизмы образования ковалентных связей
Различают несколько механизмов образования ковалентной связи: обменный (равноценный), донорно-акцепторный, дативный.
При использовании обменного механизма образование связи рассматривается как результат спаривания спинов свободных электронов атомов. При этом осуществляется перекрывание двух атомных орбиталей соседних атомов, каждая из которых занята одним электроном. Таким образом, каждый из связываемых атомов выделяет для обобществления пары по электрону, как бы обмениваясь ими. например, при образовании молекулы трифторида бора из атомов три атомные орбитали бора, на каждой из которых имеется по одному электрону, перекрываются с тремя атомными орбиталями трех атомов фтора (на каждой из них также находится по одному неспаренному электрону). В результате спаривания электронов в областях перекрывания соответствующих атомных орбиталей появляется три пары электронов, связывающих атомы в молекулу.
По донорно-акцепторному механизму перекрывается орбиталь с парой электронов одного атома и свободная орбиталь другого атома. В этом случае в области перекрывания также оказывается пара электронов. По донорно-акцепторному механизму происходит, например, присоединение фторид-иона к молекуле трифторида бора. Вакантная р-орбиталь бора (акцептора электронной пары) в молекуле BF3 перекрывается с р-орбиталью иона F − , выступающего в роли донора электронной пары. В образовавшемся ионе [BF4] − все четыре ковалентные связи бор−фтор равноценны по длине и энергии, несмотря на различие в механизме их образования.
Атомы, внешняя электронная оболочка которых состоит только из s— и р-орбиталей, могут быть либо донорами, либо акцепторами электронной пары. Атомы, у которых внешняя электронная оболочка включает d-орбитали, могут выступать в роли и донора, и акцептора пар электронов. В этом случае рассматривается дативный механизм образования связи. Примером проявления дативного механизма при образования связи служит взаимодействие двух атомов хлора. Два атома хлора в молекуле Cl2 образуют ковалентную связь по обменному механизму, объединяя свои неспаренные 3р-электроны. Кроме того, происходит перекрывание 3р-орбитали атом Cl-1, на которой имеется пара электронов, и вакантной 3d-орбитали атома Cl-2, а также перекрывание 3р-орбитали атом Cl-2, на которой имеется пара электронов, и вакантной 3d-орбитали атома Cl-1. Действие дативного механизма приводит к увеличению прочности связи. Поэтому молекула Cl2 является более прочной, чем молекула F2, в которой ковалентная связь образуются только по обменному механизму:
| Молекулы | F2 | Cl2 | Br2 | I2 |
| Энергия связи, кДж/моль | 155 | 240 | 190 | 149 |
Гибридизация атомных орбиталей
При определении геометрической формы химической частицы следует учитывать, что пары внешних электронов центрального атома, в том числе и не образующие химическую связь, располагаются в пространстве как можно дальше друг от друга.
При рассмотрении ковалентных химических связей нередко используют понятие о гибридизации орбиталей центрального атома — выравнивание их энергии и формы. Гибридизация является формальным приемом, применяемым для квантово-химического описания перестройки орбиталей в химических частицах по сравнению со свободными атомами. Сущность гибридизации атомных орбиталей состоит в том, что электрон вблизи ядра связанного атома характеризуется не отдельной атомной орбиталью, а комбинацией атомных орбиталей с одинаковым главным квантовым числом. Такая комбинация называется гибридной (гибридизованной) орбиталью. Как правило, гибридизация затрагивает лишь высшие и близкие по энергии атомные орбитали, занятые электронами.
В результате гибридизации появляются новые гибридные орбитали (рис.24), которые ориентируются в пространстве таким образом, чтобы расположенные на них электронные пары (или неспаренные электроны) оказались максимально удаленными друг от друга, что соответствует минимуму энергии межэлектронного отталкивания. Поэтому тип гибридизации определяет геометрию молекулы или иона.
| Тип гибридизации | Геометрическая форма | Угол между связями | Примеры |
| sp | линейная | 180 o | BeCl2 |
| sp 2 | треугольная | 120 o | BCl3 |
| sp 3 | тетраэдрическая | 109,5 o | CH4 |
| sp 3 d | тригонально-бипирамидальная | 90 o ; 120 o | PCl5 |
| sp 3 d 2 | октаэдрическая | 90 o | SF6 |
В гибридизации участвуют не только связывающие электроны, но и неподеленные электронные пары. Например, молекула воды содержит две ковалентные химические связи между атомом кислорода и двумя атомами водорода.
Помимо двух пар электронов, общих с атомами водорода, у атома кислорода имеются две пары внешних электронов, не участвующих в образовании связи (неподеленные электронные пары). Все четыре пары электронов занимают определенные области в пространстве вокруг атома кислорода.
Поскольку электроны отталкиваются друг от друга, электронные облака располагаются на возможно большем расстоянии друг от друга. При этом в результате гибридизации меняется форма атомных орбиталей, они вытянуты и направлены к вершинам тетраэдра. Поэтому молекула воды имеет угловую форму, а угол между связями кислород-водород равен 104,5 o .
Для предсказания типа гибридизации удобно использовать донорно-акцепторный механизм образования связи: происходит перекрывание пустых орбиталей менее электроотрицательного элемента и орбиталей более электроотрицательного элемента с находящимися на них парами электронов. При составлении электронных конфигураций атомов учитывают их степени окисления − условное число, характеризующее заряд атома в соединении, рассчитанный исходя из предположения ионного строения вещества.
Чтобы определить тип гибридизации и форму химической частицы, поступают следующим образом:
Наличие π-связей не влияет на тип гибридизации. Однако наличие дополнительного связывания может привести к изменению валентных углов, поскольку электроны кратных связей сильнее отталкиваются друг от друга. По этой причине, например, валентный угол в молекуле NO2 (sp 2 -гибридизация) увеличивается от 120 o до 134 o .
Кратность связи азот−кислород в этой молекуле равна 1,5, где единица отвечает одной σ-связи, а 0,5 равно отношению числа орбиталей атома азота, не участвующих в гибридизации (1) к числу оставшихся активных электронных пар у атома кислорода, образующих π-связи (2). Таким образом, наблюдается делокализация π-связей (делокализованные связи − ковалентные связи, кратность которых не может быть выражена целым числом).
В случае sp, sp 2 , sp 3 , sp 3 d 2 гибридизации вершины в многограннике, описывающем геометрию химической частицы, равноценны, и поэтому кратные связи и неподеленные пары электронов могут занимать любые из них. Однако sp 3 d-гибридизации отвечает тригональная бипирамида, в которой валентные углы для атомов, расположенных в основании пирамиды (экваториальной плоскости), равны 120 o , а валентные углы с участием атомов, расположенных в вершинах бипирамиды, равны 90 o . Эксперимент показывает, что неподеленные электронные пары всегда располагаются в экваториальной плоскости тригональной бипирамиды. На этом основании делается вывод, что они требуют больше свободного пространства, чем пары электронов, участвующие в образовании связи. Примером частицы с таким расположением неподеленной электронной пары является тетрафторид серы (рис. 27). Если центральный атом одновременно имеет неподеленные пары электронов и образует кратные связи (например, в молекуле XeOF2), то в случае sp 3 d-гибридизации именно они располагаются в экваториальной плоскости тригональной бипирамиды (рис. 28).
Дипольные моменты молекул
Идеальная ковалентная связь существует лишь в частицах, состоящих из одинаковых атомов (Н2, N2 и т.д.). Если образуется связь между различными атомами, то электронная плотность смещается к одному из ядер атомов, то есть происходит поляризация связи. Характеристикой полярности связи служит ее дипольный момент.
Дипольный момент молекулы равен векторной сумме дипольных моментов ее химических связей (с учетом наличия неподеленных пар электронов). Если полярные связи расположены в молекуле симметрично, то положительные и отрицательные заряды компенсируют друг друга, и молекула в целом является неполярной. Так происходит, например, с молекулой диоксида углерода. Многоатомные молекулы с несимметричным расположением полярных связей (и, следовательно, электронной плотности) являются в целом полярными. Это относится, в частности, к молекуле воды.
На результирующее значение дипольного момента молекулы может повлиять неподеленная пара электронов. Так, молекулы NH3 и NF3 имеют тетраэдрическую геометрию (с учетом неподеленной пары электронов). Степени ионности связей азот−водород и азот−фтор составляют 15 и 19%, соответственно, а их длины — 101 и 137 пм, соответственно. Исходя из этого, можно было бы сделать вывод о большем дипольном моменте NF3. Однако эксперимент показывает обратное. При более точном предсказании дипольного момента следует учитывать направление дипольного момента неподеленной пары (рис. 29).
Источник
Строение молекулы воды
МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ В АНАЛИЗЕ СТРОЕНИЯ МОЛЕКУЛЫ ВОДЫ
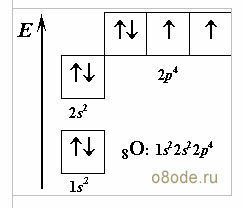
Если нам захочется посмотреть, как устроена молекула воды, то придется в первую очередь вспомнить ее состав. Молекула воды состоит из одного атома кислорода, связанного ковалентной связью с двумя атомами водорода H2O (формула воды). В молекуле воды главное действующее лицо — атом кислорода. Вспомним его энергетическую диаграмму (рисунок слева):
Два неспаренных р-электрона атома кислорода О очень реакционноспособны. Они всегда готовы образовать химические связи с двумя s-электронами атомов водорода.
Рис. Так выглядит перекрывание р-орбиталей кислорода с s-орбиталями двух атомов водорода (рисунок справа):
Таким образом, из двух атомов водорода и одного атома кислорода получается угловая молекула воды которую можно условно изобразить еще так:
Рис. Молекула воды имеет угловую форму (ниже слева)
Поскольку атомы водорода друг от друга заметно отталкиваются, угол между химическими связями (линиями, соединяющими ядра атомов) водород — кислород не прямой (90°), а немного больше — 104,5°. Химические связи эти полярные: кислород гораздо электроотрицательнее водорода и подтягивает к себе электронные облака, образующие химические связи. Вблизи атома кислорода скапливается избыточный отрицательный заряд, а у атомов водорода — положительный. Поэтому и вся молекула воды тоже попадает в отряд «химических полярников» — веществ, молекулы которых представляют собой электрические диполи.
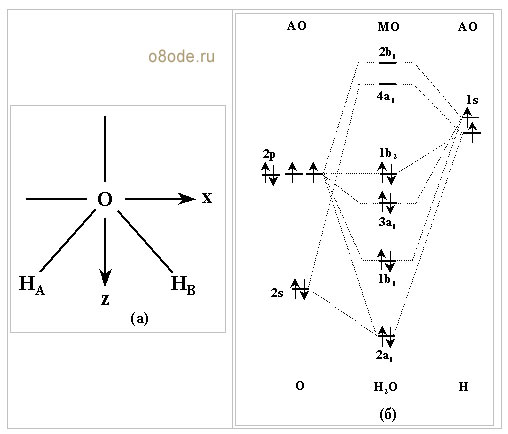
Строение молекулы воды Н2О можно проанализировать с помощью метода молекулярных орбиталей (МО). Схема молекулярных орбиталей молекулы воды приведена ниже.
Рис. Схема расположения координатных осей (а) и энергетическая диаграмма орбиталей молекулы Н2О (б).
Для построения схемы молекулярной орбитали молекулы воды Н2О совместим начало координат с атомом кислорода, а атомы водорода расположим в плоскости xz (Подробнее см. Г.Грей «Электроны и химическая связь»,М., изд-во «Мир», 1967, с.155-62 и G.L.Miessier, D.A.Tarr, «Inorganic Chemistry», Prantice Hall Int.Inc., 1991, p.153-57).
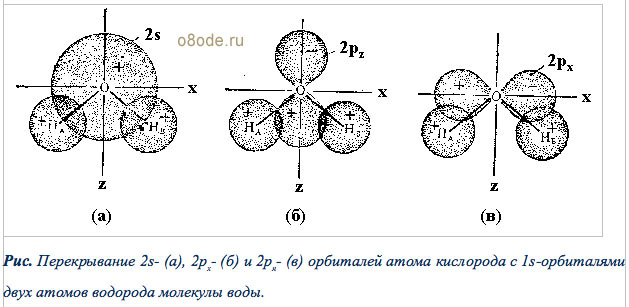
В формировании суммарной молекулярной орбитали воды принимают участие отдельные атомные орбитали водорода и кислорода, обладающие одинаковой симметрией и близкими энергиями. Однако вклад атомных орбиталей атомов водорода и кислорода в образование общей молекулярной орбитали молекулы воды разный, что отражается в разных величинах коэффициентов в соответствующих линейных комбинациях атомных орбиталей. Взаимодействие (перекрывание) 1sатомной орбитали водорода, 2sи 2рzатомной орбитали кислорода приводит к образованию 2a1-связывающей и 4a1-разрыхляющей молекулярной орбиталей.
Рис. Перекрывание 2s(а), 2px- (б) и 2pя(в) орбиталей атома кислорода с 1s-орбиталями двух атомов водорода молекулы воды.
Из этих данных и умозаключений можно сделать следующие выводы.
1. Молекула Н2О диамагнитна.
2. Электроны на связывающих 2а1 и 1b1 орбиталях обеспечивают связи ОН, а на несвязывающих (3а1 и 1b2) орбиталях соответствуют свободным электронным парам в молекуле Н2О, как это описывается в рамках метода валентных связей.
3. Принципиальным отличием метода молекулярных орбиталей от метода валентных связей является разная энергия ионизации занятых молекулярных орбиталей, составляющая (в эВ) 27.3 (2а1), 16.2 (1b1), 14.5 (3а1) и 12.6 (1b2), соответственно.
4. Метод молекулярных связей (в отличие от метода валентных связей) позволяет оценить разницу в энергиях молекулярных орбиталей. В частности, существенным является различие в энергии двух несвязывающих орбиталей 3а1 и 1b2. Это связано с различной природой орбиталей — 1b2 локализована на атоме кислорода, тогда как 3а1 образована с участием атомной орбитали водорода и кислорода и не является локализованной. Локализация электронов на 1b2 молекулярной орбитали приводит к тому, что отрицательный заряд в молекуле Н2О сосредоточен вблизи атома кислорода, а положительный — вблизи атомов водорода. Таким образом, молекула Н2О оказывается полярной (дипольный момент μ = l. q = 1.84D). Это соответствует и простым соображениям электроотрицательности: связывающие электроны смещаются к более электроотрицательному атому.
Так как у молекулы Н2О в образовании связей принимают в основном участие 2р-орбитали кислорода и 1s-орбитали водорода, то можно ожидать, что угол НО- Н должен быть близким к 90о. Однако из эксперимента следует, что этот угол равен 104.5о. Причина такого различия заключается в том, что этот угол соответствует минимуму энергии. Согласно квантово-механическим расчетам, энергия молекулы зависит не только от энергии молекулярных орбиталей и числа электронов на них, но и от валентного угла НО- Н. В приближении метода валентных связей увеличение угла НО- Н от 90о (характерного для взаимодействия р-орбиталей) до 104.5о связано с взаимным отталкиванием положительно заряженных атомов водорода.
При переходе от Н2О к другим двухатомным молекулам Н2S, H2Se и H2Te диаграммы молекулярных орбиталей изменяются, что обусловлено увеличением энергий исходных АО халькогенов: Е3s = -20.7 эВ; Е3р = -12.0 эВ; Е4s = 20.8 эВ; Е4р = 11.9 эВ. Поэтому растет участие ns-атомных орбиталей халькогена в образовании молекулярных орбиталей. При этом несвязывающий характер орбиталей nb2 сохраняется, а связывающий характер орбиталей 2а1 усиливается. В целом, по мере увеличения энергии атомных орбиталей nsи nруменьшается разность сумм энергий молекулярных и атомных орбиталей, которые характеризуют прочность молекул Н2Э. Вклады nратомных орбиталей атомов халькогенов в энергию молекулярной орбитали уменьшаются, и соответственно понижается локализация электронов на атомах и полярность молекул. Вероятно, благодаря этому уменьшаются валентные углы НЭ- Н в молекулах халькогенов. Именно так, с точки зрения теории молекулярных орбиталей, объясняется понижение устойчивости молекул H2S, H2Sе, H2Te по сравнению с молекулой Н2О.
Источник