Взаимодействие вода — растворенное вещество



При добавлении различных веществ к воде изменяются свойства как самого вещества, так и воды. Гидрофильные вещества взаимодействуют с водой путем ион-дипольного или диполь-дипольного механизма, вызывая изменения в структуре воды, ее подвижности, а также в структуре и реакционной способности гидрофильных веществ. Гидрофобные группы добавленных веществ взаимодействуют с близлежащей водой слабо, предпочитая неводное окружение. Молекулы около гидрофобных групп становятся более упорядоченными, что приводит к уменьшению энтропии. Чтобы уменьшить контакт с водой, гидрофобные группы агрегируются. Как уже говорилось, этот процесс известен как гидрофобное взаимодействие.
Взаимодействие воды с ионами и ионными группами.Вода, взаимодействующая с ионами и ионными группами, является наиболее прочно связанной в пищевых продуктах. Нормальная структура чистой воды (основанная на водородных связях тетраэдрическая конфигурация) нарушается при добавлении диссоциирующих веществ. Для простых неорганических ионов, которые не обладают донорными или акцепторными местами для образования водородных связей, связь просто полярна. Простейший пример — гидратированные ионы хлорида натрия. Вода в мультислое существует в структурно разрушенном состоянии из-за конкурирующего влияния, с одной стороны, монослоя, с другой — внешней массы воды.
Способность ионов изменять структуру воды тесно связана с силой электрического поля иона. Малые и (или) многовалентные (главным образом, положительные) ионы, такие как Li + , Na + , Н3О + , Ca 2+ , Ba 2+ , Mg 2+ , А1 3+ , F — , OH — , имеют сильное электрическое поле и являются образова-телями сетчатой структуры. Около каждого из этих ионов расположено от 4 до 6 молекул воды. Связанная вода менее лабильна и обладает более
плотной структурой по сравнению с чистой водой (см. рис. 10.4).
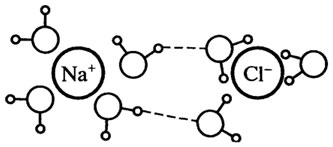
Рис. 10.4.Структура связанной воды
Большие и моновалентные ионы (главным образом, отрицательно заряженные ионы и большие положительные ионы), такие как К + , Cs + , NH4 + , C1 — , Br — , I — , NO
, имеют относительно слабое электрическое поле и являются разрушителями сетчатой структуры, хотя для К + этот эффект очень слаб.
Благодаря различной способности ионов гидратироваться, изменять водную структуру, влиять на диэлектрическую постоянную водной среды и толщину двойного электрического слоя около коллоидов, они сильно воздействуют на суспендированные и другие растворенные вещества в среде. Поэтому, например, конформация белков и стабильность коллоидов сильно зависят от вида и количества присутствующих ионов.
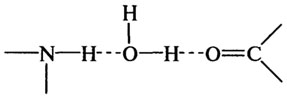
Взаимодействие воды с нейтральными группами, обладающими способностью образовывать водородные связи.Водородные связи вода — растворенное вещество являются более слабыми, чем при вода — ион взаимодействиях. Тем не менее, вода, связанная посредством водородных связей с растворенным веществом, может быть классифицирована как «органически связанная» или «близлежащая» и должна проявлять пониженную подвижность по сравнению с водой в массе раствора (водной фазы).
Можно ожидать, что вещества, способные к образованию водородных связей, не повышают или, по крайней мере, не разрушают нормальную структуру чистой воды. Однако в ряде случаев отмечается ориентация водородных связей, отличная от нормальной воды.
Водородные связи воды образуются с различными группами (гидроксил-, амино-, карбонил-, амид- или имино-). Например, вода образует водородные связи с двумя видами функциональных групп белков. Эти связи могут быть как в одной макромолекуле между различными группами, так и между разными макромолекулами:
Взаимодействие вода — неполярное вещество.В системе вода — неполярное вещество важны два аспекта структурных образований: образование клатратных гидратов и гидрофобные взаимодействия в белках.
Клатратные гидраты являются соединениями включения, то есть это соединения, имеющие молекулу-«хозяина», образующуюся за счет водородных связей, и молекулу-«гостя». Образования такого типа имеют место в биологических материалах.
«Гости» в клатратных гидратах являются низкомолекулярными соединениями, а «хозяин» представляет собой «сетку» из 20—74 водных молекул.

Типичные «гости» — это низкомолекулярные углеводороды, галогенуглеводороды, диоксид углерода, этиленоксид, этиловый спирт, короткоцепочные первичные, вторичные и третичные амины, алкил-аммоний. Взаимодействие между водой и «гостем» часто обусловлено слабыми ван-дер-ваальсовыми силами, но может иметь место и электростатическое взаимодействие.
Клатратные гидраты имеют важное значение, т. к. влияют на конфор-мацию, реакционноспособность и стабильность таких молекул, как белки.
Гидрофобные взаимодействия в водном окружении также важны, т. к. примерно 40% общих аминокислот в большинстве белков имеют неполярные группы. Неполярные группы других компонентов, таких как спирты, жирные кислоты, свободные аминокислоты, также могут участвовать в гидрофобных взаимодействиях. Эти взаимодействия являются слабыми, по силе они примерно такие же, как силы Ван-дер-Ваальса. Гидрофобные взаимодействия важны для четвертичной структуры многих белков, поэтому вода (и водная структура) играет важную роль в конформации белка.
Источник
Взаимодействие вода — растворенное вещество
При добавлении различных веществ к воде изменяются свойства как самого вещества, так и воды. Гидрофильные вещества взаимодействуют с водой путем ион-дипольного или диполь-дипольного механизма, вызывая изменения в структуре воды, ее подвижности, а также в структуре и реакционной способности гидрофильных веществ. Гидрофобные группы добавленных веществ взаимодействуют с близлежащей водой слабо, предпочитая неводное окружение. Молекулы около гидрофобных групп становятся более упорядоченными, что приводит к уменьшению энтропии. Чтобы уменьшить контакт с водой, гидрофобные группы агрегируются. Как уже говорилось, этот процесс известен как гидрофобное взаимодействие.
Взаимодействие воды с ионами и ионными группами.Вода, взаимодействующая с ионами и ионными группами, является наиболее прочно связанной в пищевых продуктах. Нормальная структура чистой воды (основанная на водородных связях тетраэдрическая конфигурация) нарушается при добавлении диссоциирующих веществ. Для простых неорганических ионов, которые не обладают донорными или акцепторными местами для образования водородных связей, связь просто полярна. Простейший пример — гидратированные ионы хлорида натрия. Вода в мультислое существует в структурно разрушенном состоянии из-за конкурирующего влияния, с одной стороны, монослоя, с другой — внешней массы воды.
Способность ионов изменять структуру воды тесно связана с силой электрического поля иона. Малые и (или) многовалентные (главным образом, положительные) ионы, такие как Li + , Na + , Н3О + , Ca 2+ , Ba 2+ , Mg 2+ , А1 3+ , F — , OH — , имеют сильное электрическое поле и являются образова-телями сетчатой структуры. Около каждого из этих ионов расположено от 4 до 6 молекул воды. Связанная вода менее лабильна и обладает более
плотной структурой по сравнению с чистой водой (см. рис. 10.4).
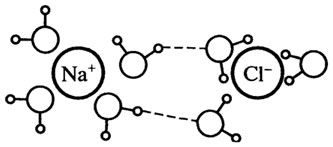
Рис. 10.4.Структура связанной воды
Большие и моновалентные ионы (главным образом, отрицательно заряженные ионы и большие положительные ионы), такие как К + , Cs + , NH4 + , C1 — , Br — , I — , NO
, имеют относительно слабое электрическое поле и являются разрушителями сетчатой структуры, хотя для К + этот эффект очень слаб.
Благодаря различной способности ионов гидратироваться, изменять водную структуру, влиять на диэлектрическую постоянную водной среды и толщину двойного электрического слоя около коллоидов, они сильно воздействуют на суспендированные и другие растворенные вещества в среде. Поэтому, например, конформация белков и стабильность коллоидов сильно зависят от вида и количества присутствующих ионов.
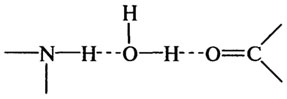
Взаимодействие воды с нейтральными группами, обладающими способностью образовывать водородные связи.Водородные связи вода — растворенное вещество являются более слабыми, чем при вода — ион взаимодействиях. Тем не менее, вода, связанная посредством водородных связей с растворенным веществом, может быть классифицирована как «органически связанная» или «близлежащая» и должна проявлять пониженную подвижность по сравнению с водой в массе раствора (водной фазы).
Можно ожидать, что вещества, способные к образованию водородных связей, не повышают или, по крайней мере, не разрушают нормальную структуру чистой воды. Однако в ряде случаев отмечается ориентация водородных связей, отличная от нормальной воды.
Водородные связи воды образуются с различными группами (гидроксил-, амино-, карбонил-, амид- или имино-). Например, вода образует водородные связи с двумя видами функциональных групп белков. Эти связи могут быть как в одной макромолекуле между различными группами, так и между разными макромолекулами:
Взаимодействие вода — неполярное вещество.В системе вода — неполярное вещество важны два аспекта структурных образований: образование клатратных гидратов и гидрофобные взаимодействия в белках.
Клатратные гидраты являются соединениями включения, то есть это соединения, имеющие молекулу-«хозяина», образующуюся за счет водородных связей, и молекулу-«гостя». Образования такого типа имеют место в биологических материалах.
«Гости» в клатратных гидратах являются низкомолекулярными соединениями, а «хозяин» представляет собой «сетку» из 20—74 водных молекул.
Типичные «гости» — это низкомолекулярные углеводороды, галогенуглеводороды, диоксид углерода, этиленоксид, этиловый спирт, короткоцепочные первичные, вторичные и третичные амины, алкил-аммоний. Взаимодействие между водой и «гостем» часто обусловлено слабыми ван-дер-ваальсовыми силами, но может иметь место и электростатическое взаимодействие.
Клатратные гидраты имеют важное значение, т. к. влияют на конфор-мацию, реакционноспособность и стабильность таких молекул, как белки.
Гидрофобные взаимодействия в водном окружении также важны, т. к. примерно 40% общих аминокислот в большинстве белков имеют неполярные группы. Неполярные группы других компонентов, таких как спирты, жирные кислоты, свободные аминокислоты, также могут участвовать в гидрофобных взаимодействиях. Эти взаимодействия являются слабыми, по силе они примерно такие же, как силы Ван-дер-Ваальса. Гидрофобные взаимодействия важны для четвертичной структуры многих белков, поэтому вода (и водная структура) играет важную роль в конформации белка.
Источник
Способность взаимодействовать с ионами вода
Электрические дипольные моменты воды обусловливают ее высокую диэлектрическую проницаемость 
Первая попытка расчета потенциальной энергии поляризации среды вокруг иона была предпринята Борном [85] в 1920 г.
Для расчета он использовал весьма простую модель растворителя в виде непрерывной изотропной среды с диэлектрической проницаемостью 

Это поле поляризует среду. Поляризация характеризуется вектором диэлектрической поляризации
Потенциальная энергия поляризации среды тогда определяется выражением [37]
В биологических системах все процессы происходят при постоянных температуре и давлении, поэтому при отличной от нуля температуре Т энергия гидратации Е определяется изменением свободной энергии Гиббса в результате поляризации среды:
где 


Формула Борна (7.1), полученная на основе электростатической теории, может быть использована для грубой оценки величины энергии гидратации. Делались многократные попытки ее улучшения в рамках континуальной модели. При сравнении теории Борна с экспериментом следует учитывать весьма большую неопределенность в выборе эффективных радиусов ионов. Обычно исходят из предположения, что размеры иона в твердой кристаллической решетке и в растворе примерно одинаковы. В этом приближении, следуя Полингу, радиус иона вычисляется делением пополам расстояния между ближайшими ионами в
кристалле. Полученные радиусы называются кристаллографическими (табл. 5).
В связи с тем что молекула воды имеет конечные размеры 
Сравнительно простой электростатический расчет энергии гидратации на основе учета взаимодействия иона с жесткими диполями молекул воды предложили Мищенко и Сухотин. Для энергии гидратации они получили выражение
где 

Все электростатические теории являются феноменологическими. В них используются феноменологические пойятия диэлектрической проницаемости, ее изменения вблизи иона и значение эффективного радиуса иона. Путем соответствующего подбора этих параметров можно получить удовлетворительное совпадение с экспериментальными данными об энергии гидратации.
Понятие радиуса свободного атома является весьма условным, так как распределение плотности электрического заряда спадает от центра атома экспоненциально и в некоторых состояниях атома не имеет сферической симметрии. В случае же иона в растворе вследствие взаимодействия с молекулами растворителя должно происходить перераспределение электронной плотности между ними и изменение структуры растворителя вблизи иона. Такие изменения обнаруживаются при спектральном, рентгеноструктурном и других исследованиях физических свойств электролитов. Естественно, что выяснение деталей взаимодействия иона с растворителем возможно только на языке квантовой теории.
Начиная с классической работы Бернала и Фаулера [93 делались многочисленные попытки расчета энергии гидратации с учетом структуры воды в ближайшем к иону окружении. Энергия
гидратации представлялась в виде суммы энергии взаимодействия иона с диполями молекул воды первой гидратной оболочки, имеющей тетраэдрическую структуру, и энергии взаимодействия этого комплекса радиуса 
С другими попытками учета структуры воды при гидратации можно познакомиться в монографиях К. П. Мищенко и Г. М. Пол торатского [48] и Н. А. Измайлова 129]. Кроме учета структуры воды последовательная теория гидратации должна учитывать электронную структуру ионов. Учет влияния электронной структуры ионов рассматривался Ю. А. Кругляком [35 ], Н. А. Измайловым [29, 30] и др. Такие расчеты требуют привлечения квантовой теории. Предполагается, что на основании донорно-акцепторного механизма ион образует с первой гидратной оболочкой квазимолекулярную структуру.
В работе Д. А. Щеголева, Б. X. Бунатяна и Ю. А. Кругляка [246] проведен квантовый расчет комплексов, образуемых ионами 






Развитие более строгих методов учета структуры воды и электронной структуры ионов, по-видимому, особенно существенно при исследовании процессов перехода ионов из одной водной среды в другую через двойные липидные слои клеточных мембран. При этом могут проявиться интересные качественные закономерности, важные для понимания биологических процессов на молекулярном уровне.
Источник