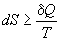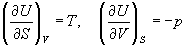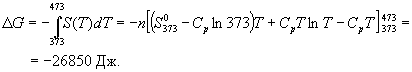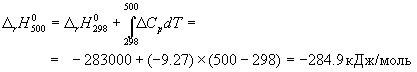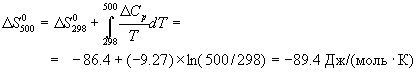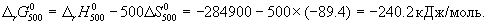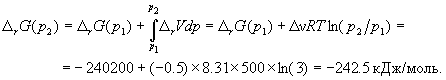Стандартная энергия гиббса вода
Термодинамическими потенциалами, или характеристическими функциями, называют термодинамические функции, которые содержат в себе всю термодинамическую информацию о системе. Наибольшее значение имеют четыре основных термодинамических потенциала:
В скобках указаны термодинамические параметры, которые получили название естественных переменных для термодинамических потенциалов. Все эти потенциалы имеют размерность энергии и все они не имеют абсолютного значения, поскольку определены с точностью до постоянной, которая равна внутренней энергии при абсолютном нуле.
Зависимость термодинамических потенциалов от их естественных переменных описывается основным уравнением термодинамики, которое объединяет первое и второе начала. Это уравнение можно записать в четырех эквивалентных формах:
Эти уравнения записаны в упрощенном виде — только для закрытых систем, в которых совершается только механическая работа.
Зная любой из четырех потенциалов как функцию естественных переменных, можно с помощью основного уравнения термодинамики найти все другие термодинамические функции и параметры системы (см. пример 5-1).
Другой важный смысл термодинамических потенциалов состоит в том, что они позволяют предсказывать направление термодинамических процессов. Так, например, если процесс происходит при постоянных температуре и давлении, то неравенство, выражающее второй закон термодинамики:
эквивалентно неравенству dGp,T 0 (мы учли, что при постоянном давлении Qp = dH), где знак равенства относится к обратимым процессам, а неравенства — к необратимым. Таким образом, при необратимых процессах, протекающих при постоянных температуре и давлении, энергия Гиббса всегда уменьшается. Минимум энергии Гиббса достигается при равновесии.
Аналогично, любой термодинамический потенциал в необратимых процессах при постоянстве естественных переменных уменьшается и достигает минимума при равновесии:
Потенциал
Естественные
переменные
Условие само-произвольности
Условия
равновесия
S = const, V = const
dU 2 U > 0
S = const, p = const
dH 2 H > 0
T = const, V = const
dF 2 F > 0
T = const, p = const
dG 2 G > 0
Наибольшее значение в конкретных термодинамических расчетах имеют два последние потенциала — энергия Гельмгольца F и энергия Гиббса G , т.к. их естественные переменные наиболее удобны для химии. Другое (устаревшее) название этих функций — изохорно-изотермический и изобарно-изотермический потенциалы. Они имеют дополнительный физико-химический смысл. Уменьшение энергии Гельмгольца в каком-либо процессе при T = const, V = const равно максимальной механической работе, которую может совершить система в этом процессе:
Таким образом, энергия F равна той части внутренней энергии (U = F + TS), которая может превратиться в работу.
Аналогично, уменьшение энергии Гиббса в каком-либо процессе при T = const, p = const равно максимальной полезной (т.е., немеханической) работе, которую может совершить система в этом процессе:
Зависимость энергии Гельмгольца (Гиббса) от объема (давления) вытекает из основного уравнения термодинамики (5.3), (5.4):
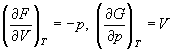
Зависимость этих функций от температуры можно описать с помощью основного уравнения термодинамики:
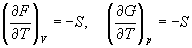
или с помощью уравнения Гиббса-Гельмгольца:
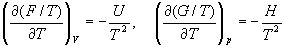
Расчет изменения функций F и G в химических реакциях можно проводить разными способами. Рассмотрим два из них на примере энергии Гиббса.
1) По определению, G = H — TS. Если продукты реакции и исходные вещества находятся при одинаковой температуре, то стандартное изменение энергии Гиббса в химической реакции равно:
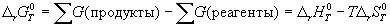
где тепловой эффект можно рассчитать с помощью стандартных энтальпий образования, а стандартное изменение энтропии — по абсолютным энтропиям участников реакции.
2) Аналогично тепловому эффекту реакции, изменение энергии Гиббса можно рассчитать, используя энергии Гиббса образования веществ:

В термодинамических таблицах обычно приводят абсолютные энтропии и значения термодинамических функций образования соединений из простых веществ при температуре 298 К и давлении 1 бар (стандартное состояние). Для расчета rG и rF при других условиях используют соотношения (5.5) — (5.7).
Все термодинамические потенциалы являются функциями состояния. Это свойство позволяет найти некоторые полезные соотношения между частными производными, которые называют соотношениями Максвелла.
Рассмотрим выражение (5.1) для внутренней энергии. Т.к. dU — полный дифференциал, частные производные внутренней энергии по естественным переменным равны:
Если продифференцировать первое тождество по объему, а второе — по энтропии, то получатся перекрестные вторые частные производные внутренней энергии, которые равны друг другу:
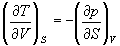
Три другие соотношения получаются при перекрестном дифференцировании уравнений (5.2) — (5.4).
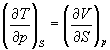
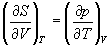
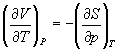
ПРИМЕРЫ
Пример 5-1. Внутренняя энергия некоторой системы известна как функция энтропии и объема, U(S,V). Найдите температуру и теплоемкость этой системы.
Решение. Из основного уравнения термодинамики (5.1) следует, что температура — это частная производная внутренней энергии по энтропии:
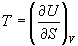
Изохорная теплоемкость определяет скорость изменения энтропии с температурой:
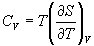
Воспользовавшись свойствами частных производных, можно выразить производную энтропии по температуре через вторую производную внутренней энергии:
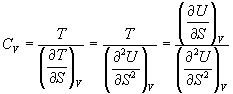
Пример 5-2. Используя основное уравнение термодинамики, найдите зависимость энтальпии от давления при постоянной температуре: а) для произвольной системы; б) для идеального газа.
Решение. а) Если основное уравнение в форме (5.2) поделить на dp при постоянной температуре, получим:
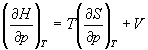
Производную энтропии по давлению можно выразить с помощью соотношения Максвелла для энергии Гиббса (5.13):
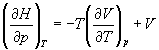
б) Для идеального газа V(T) = nRT / p. Подставляя эту функцию в последнее тождество, получим:
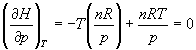
Энтальпия идеального газа не зависит от давления.
Пример 5-3. Выразите производные 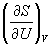
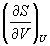
Решение. Основное уравнение термодинамики (5.1) можно переписать в виде:
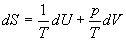
представив энтропию как функцию внутренней энергии и объема. Коэффициенты при dU и dV равны соответствующим частным производным:
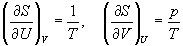
Пример 5-4. Два моля гелия (идеальный газ, мольная теплоемкость Cp = 5/2 R) нагревают от 100 о С до 200 о С при p = 1 атм. Вычислите изменение энергии Гиббса в этом процессе, если известно значение энтропии гелия, 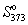
Решение. Изменение энергии Гиббса при нагревании от 373 до 473 К можно найти, проинтегрировав частную производную по температуре (5.6):
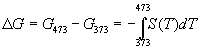
Зависимость энтропии от температуры при постоянном давлении определяется изобарной темлоемкостью:
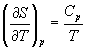
Интегрирование этого выражения от 373 К до T дает:
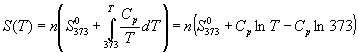
Подставляя это выражение в интеграл от энтропии, находим:
Процесс нагревания не обязан быть самопроизвольным, т.к. уменьшение энергии Гиббса служит критерием самопроизвольного протекания процесса только при T = const и p = const.
Ответ. G = -26850 Дж.
Пример 5-5. Рассчитайте изменение энергии Гиббса в реакции
при температуре 500 K и парциальных давлениях 3 бар. Будет ли эта реакция самопроизвольной при данных условиях? Газы считать идеальными. Необходимые данные возьмите из справочника.
Решение. Термодинамические данные при температуре 298 К и стандартном давлении 1 бар сведем в таблицу:
Вещество
Энтальпия образования 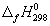
Энтропия 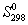
Теплоемкость 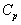
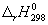
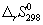
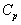
CO + ЅO2 =
= CO2
Примем, что Cp = const. Изменения термодинамических функций в результате реакции рассчитаны как разность функций реагентов и продуктов:
f = f(CO2) — f(CO) — Ѕ f(O2).
Стандартный тепловой эффект реакции при 500 К можно рассчитать по уравнению Кирхгофа в интегральной форме (3.8):
Стандартное изменение энтропии в реакции при 500 К можно рассчитать по формуле (4.9):
Стандартное изменение энергии Гиббса при 500 К:
Для расчета изменения энергии Гиббса при парциальных давлениях 3 атм необходимо проинтегрировать формулу (5.5) и использовать условие идеальности газов ( V = n RT / p, n — изменение числа молей газов в реакции):
Эта реакция может протекать самопроизвольно при данных условиях.
Ответ. G = -242.5 кДж/моль.
ЗАДАЧИ
5-1. Выразите внутреннюю энергию как функцию переменных G, T, p.
5-2. Используя основное уравнение термодинамики, найдите зависимость внутренней энергии от объема при постоянной температуре: а) для произвольной системы; б) для идеального газа.
5-3. Известно, что внутренняя энергия некоторого вещества не зависит от его объема. Как зависит давление вещества от температуры? Ответ обоснуйте.
5-4. Выразите производные 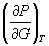
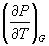
5-5. Напишите выражение для бесконечно малого изменения энтропии как функции внутренней энергии и объема. Найдите частные производные энтропии по этим переменным и составьте соответствующее уравнение Максвелла.
5-6. Для некоторого вещества известно уравнение состояния p(V, T). Как изменяется теплоемкость Cv с изменением объема? Решите задачу: а) в общем виде; б) для какого-либо конкретного уравнения состояния (кроме идеального газа).
5-7. Докажите тождество: 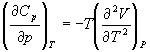
5-8. Энергия Гельмгольца одного моля некоторого вещества записывается следующим образом:
где a, b, c, d — константы. Найдите давление, энтропию и теплоемкость CV этого тела. Дайте физическую интерпретацию константам a, b, d.
5-9. Нарисуйте график зависимости энергии Гиббса индивидуального вещества от температуры в интервале от 0 до T > Tкип.
5-10. Для некоторой системы известна энергия Гиббса:
5-11. Зависимость мольной энергии Гельмгольца некоторой системы от температуры и объема имеет вид:
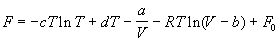
где a, b, c, d — константы. Выведите уравнение состояния p(V,T) для этой системы. Найдите зависимость внутренней энергии от объема и температуры U(V,T). Каков физический смысл постоянных a, b, c?
5-12. Найдите зависимость мольной внутренней энергии от объема для термодинамической системы, которая описывается уравнением состояния (для одного моля)
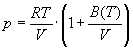
где B(T) — известная функция температуры.
5-13. Для некоторого вещества зависимость теплоемкости от температуры имеет вид: CV = aT 3 при температуре 0 — 10 К. Найдите зависимость энергии Гельмгольца, энтропии и внутренней энергии от температуры в этом диапазоне.
5-14. Для некоторого вещества зависимость внутренней энергии от температуры имеет вид: U = aT 4 + U0 при температуре 0 — 10 К. Найдите зависимость энергии Гельмгольца, энтропии и теплоемкости CV от температуры в этом диапазоне.
5-15. Выведите соотношение между теплоемкостями:
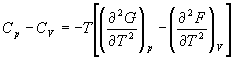
5-16. Исходя из тождества 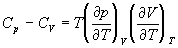
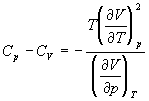
5-17. Один моль газа Ван-дер-Ваальса изотермически расширяется от объема V1 до объема V2 при температуре T. Найдите U, H, S, F и G для этого процесса.
5-18. Вычислите изменение H, U, F, G, S при одновременном охлаждении от 2000 К до 200 К и расширении от 0.5 м 3 до 1.35 м 3 0.7 молей азота (CV = 5/2 R). Энтропия газа в исходном состоянии равна 150 Дж/(моль . К), газ можно считать идеальным.
5-19. Вычислите изменение энергии Гиббса при сжатии от 1 атм до 3 атм при 298 К: а) одного моля жидкой воды; б) одного моля водяного пара (идеальный газ).
5-20. Изменение энергии Гиббса в результате испарения воды при 95 о С и 1 атм равно 546 Дж/моль. Рассчитайте энтропию паров воды при 100 о С, если энтропия жидкой воды равна 87.0 Дж/(моль . К). При каком давлении изменение энергии Гиббса в результате испарения воды будет равно 0 при 95 о С?
5-21*. Давление над одним молем твердой меди при температуре 25 о С увеличили от 1 до 1000 атм. Найти U, H, S, F. Медь считать несжимаемой, плотность 8.96 г/см 3 , изобарический коэффициент теплового расширения 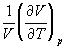
5-22. Вычислите стандартную энергию Гиббса образования (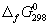
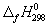
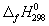
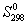
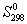
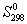
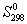
5-23. Рассчитайте G o при 25 о С для химической реакции:
Стандартные значения энтальпии образования и абсолютной энтропии при 25 о С равны: fH o (HСl) = -22.1 ккал/моль, fH o (H2O(ж)) = -68.3 ккал/моль; S o (HCl) = 44.6 кал/(моль . K), S o (O2) = 49.0 кал/(моль . K), S o (Сl2) = 53.3 кал/(моль . K), S o (H2O(ж)) = 16.7 кал/(моль . K).
5-24. Рассчитайте G o при 25 о С для химической реакции:
Стандартные значения энтальпии образования и абсолютной энтропии при 25 о С равны: fH o (СO2) = -94.1 ккал/моль, fH o (СH4) = -17.9 ккал/моль, fH o (H2O(ж)) = -68.3 ккал/моль; S o (СO2) = 51.1 кал/(моль . K), S o (H2) = 31.2 кал/(моль . K), S o (СH4) = 44.5 кал/(моль . K), S o (H2O(ж)) = 16.7 кал/(моль . K).
5-25. Рассчитайте стандартные энергии Гиббса и Гельмгольца G o и F o при 300 о С для химической реакции:
Может ли эта реакция протекать самопроизвольно при данной температуре? Теплоемкости веществ считать постоянными.
5-26. Найдите энергию Гиббса образования NH3 при температурах 298 и 400 K, если известны следующие данные: 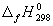
NH3
35.7
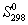 , Дж/(моль . К)
, Дж/(моль . К)Считать, что теплоемкости в указанном интервале температур постоянны.
5-27. Рассчитайте стандартные энергии Гиббса и Гельмгольца G o и F o при 60 о С для химической реакции:
Может ли эта реакция протекать самопроизвольно при данной температуре? Теплоемкости веществ считать постоянными.
5-28. Рассчитайте стандартные энергии Гиббса и Гельмгольца G o и F o при 700 о С для химической реакции:
Может ли эта реакция протекать самопроизвольно при данной температуре? Теплоемкости веществ считать постоянными.


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
Источник