- Сульфат калия: способы получения и химические свойства
- Способ получения
- Качественная реакция
- Химические свойства
- Гидросульфат калия: способы получения и химические свойства
- Способ получения
- Химические свойства
- K2SO4 + H2O = ? уравнение реакции
- Формула сульфата калия, способы применения и состав
- Применение сернокислого калия
- Использование для огорода
- Внесение удобрения в почву
- Использование для обработки растений
- Способы внесения K₂SO₄
- Обработка отдельных видов растений
- Меры безопасности при работе с удобрениями
Сульфат калия: способы получения и химические свойства
Сульфат калия K2SO4 — соль щелочного металла калия и серной кислоты. Белый, термически устойчивый. Хорошо растворяется в воде (гидролиза нет).
Относительная молекулярная масса Mr = 174,26; относительная плотность для тв. и ж. состояния d = 2,662; tпл = 1074º C; tкип > 2000º C
Способ получения
1. В результате взаимодействия при надпероксида калия и серы образуется сульфат калия:
2. Оксид калия реагирует с оксидом серы. В результате реакции образуется сульфат калия:
K2O + SO3 = K2SO4
3. В результате реакции между гидроксидом калия и серной кислотой происходит образование сульфата калия и воды:
4. Гидросульфат калия при 240 ºС разлагается с образованием сульфата калия и серной кислоты:
5. При взаимодействии концентрированного гидроксида калия и гидросульфата калия образуется сульфат калия и вода:
6. Сульфат калия взаимодействует с хлоридом калия при 450–700º C с образованием сульфата калия и соляной кислоты:
7. Твердый хлорид калия реагирует с концентрированной серной кислотой в состоянии кипения. В результате реакции образуется сульфат калия и газ хлороводород:
8. При температуре выше 500º С твердый сульфид калия взаимодействует с кислородом, образуя сульфат калия:
Качественная реакция
Качественная реакция на сульфат калия — взаимодействие его с хлоридом бария, в результате реакции происходит образование белого осадка , который не растворим в азотной кислоте:
1. При взаимодействии с хлоридом бария , сульфат калия образует сульфат бария и хлорид калия:
Химические свойства
1. Сульфат калия может реагировать с простыми веществами :
1.1. Сульфат калия реагирует с углеродом при температуре 900º C. При этом образуются сульфид калия и угарный газ:
1.2. С водородом сульфат калия реагирует при температуре 600º C, в присутствии катализатора Fe2O3 с образованием сульфида калия и воды:
2. Сульфат калия вступает в реакцию со многими сложными веществами :
2.1. Сульфат калия взаимодействует с гидроксидами :
2.1.1. Сульфат калия реагирует с гидроксидом бария с образованием гидроксида калия и сульфата бария:
2.2. Сульфат калия может реагировать с кислотами :
2.2.1. При взаимодействии с концентрированной серной кислотой твердый сульфат калия образует гидросульфат калия:
2.3. Сульфат калия может взаимодействовать с оксидами :
2.3.1. Сульфат калия реагирует с оксидом серы (VI) . Взаимодействие сульфата калия с оксидом серы (VI) приводит к образованию пиросульфата калия:
2.4. Сульфат калия реагирует с солями :
2.4.1. Сульфат калия взаимодействует с хлоридом бария . При этом образуются хлорид калия и осадок сульфат бария:
Источник
Гидросульфат калия: способы получения и химические свойства
Гидросульфат калия KHSO4 — кислая соль щелочного металла калия и серной кислоты. Белое кристаллическое вещество. Плавится без разложения, при дальнейшем нагревании разлагается.
Относительная молекулярная масса Mr = 136,17; относительная плотность для тв. и ж. состояния d = 2,322; tпл = 218,6º C
Способ получения
1. В результате взаимодействия холодной и концентрированной серной кислоты и гидроксида калия, образуется гидросульфат калия и вода:
2. Твердый сульфат калия реагирует с концентрированной серной кислотой. В результате реакции образуется гидросульфат калия:
3. При температуре кипения в результате реакции между твердым хлоридом калия и концентрированной серной кислотой происходит образование гидросульфата калия и газа хлороводорода:
Химические свойства
1. Гидросульфат калия разлагается при температуре 320–340º C с образованием пиросульфата калия и воды :
а при температуре 240º С разлагается на сульфат калия и серную кислоту:
2. Гидросульфат калия может взаимодействовать со сложными веществами :
2.1. Гидросульфат калия вступает в реакцию с гидроксидами :
2.1. Г идросульфат калия реагирует с концентрированным раствором гидроксида калия . При этом образуются сульфат калия и вода:
2.2. Гидросульфат калия может реагировать с солями :
2.2.1. С хлоридом калия гидросульфат калия реагирует при температуре 450–700º C с образованием сульфата калия и хлороводородной кислоты:
2.3. Гидросульфат калия может взаимодействовать с оксидами и пероксидами :
2.3.1. При взаимодействии при 0 ºС гидросульфата калия и концентрированного пероксида водорода образуется гидроперомоносульфат калия и вода:
2.3.2. В результате реакции между гидросульфатом калия и оксидом алюминия при 300 — 500º С образуется сульфат алюминия, сульфат калия и вода:
2.3.4. Гидросульфат калия взаимодействует с оксидом хрома при 300 — 500º С, образуя сульфат хрома, сульфат калия и воду:
Источник
K2SO4 + H2O = ? уравнение реакции
Что происходит при растворении сульфата калия в воде (K2SO4 + H2O = ?)? Подвергается ли данная соль гидролизу? Дайте определение понятию «гидролиз». Расскажите о том, какие соли подвергаются гидролизу, а какие – не подвергаются.
Сульфат калия – средняя соль, образованная сильной кислотой – серной (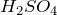
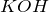
Гидролизом называется взаимодействие вещества с водой, при котором составные части вещества соединяются с составными частями воды. Примером гидролиза может служить взаимодействие хлорида фосфора (III) 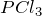
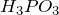
Гидролизу подвержены соединения различных классов.
В реакции гидролиза вступают соли, образованные слабой кислотой и слабым основанием, или слабой кислотой и сильным основанием, или слабым основанием и сильной кислотой. Соли. Образованные сильной кислотой и сильным основанием, гидролизу не подвергаются; нейтрализация в этом случае сводится к процессу:
а обратная реакция – диссоциация молекулы воды на ионы – протекает в ничтожно малой степени.
Источник
Формула сульфата калия, способы применения и состав

Применение сернокислого калия
Формула калия сернокислого (сульфата калия) — K₂SO₄. Хорошо усваивается растениями, растворим в воде, достаточно долго хранится, не слёживаясь. Представляет собой белый или сероватый мелкокристаллический порошок. Согласно ГОСТ 4145–74 , в составе порошка, кроме сульфата калия (50%), содержатся и другие элементы: магний — 3%, серы- 18%, кальция — 0.4%. Молярная масса K₂SO₄ — 174.2592 г/моль.
K₂SO₄ в промышленных условиях получают из природных минералов — лангбейнита и шенита.
РH (кислотность) K₂SO₄ составляет 5,5−8,0 единиц, поэтому удобрение можно применять на кислых почвах.
Использование для огорода
Применение удобрения «сернокислый калий» позволяет решить множество проблем на участке. Руководствуясь инструкцией по применению калия сернокислого, можно в короткие сроки добиться положительных результатов:
Увеличить уровень сахаров и витаминов в мякоти плодов и зелёной массе.
- Повысить устойчивость растений к заболеваниям.
- Улучшить зимостойкость растений (в случае осенней подкормки).
- Удобрение не содержит хлора, поэтому подходит для подкормки картофеля, капусты, винограда, а также бобовых культур.
- Подкормка, особенно жидким раствором, положительно влияет на развитие растений.
Внесение удобрения в почву
В зависимости от вида почвы на участке, состояния растений, определяются способы внесения удобрения. Применение удобрения сульфата калия наиболее полезно на торфяных почвах, меньше — на глинистых:
- Внесение удобрений в песчаные и торфяные почвы (бедные по составу) — способствует росту растений. На лёгких почвах K₂SO₄ рекомендуется использовать весной во время обработки. В период роста растения подкармливают повторно.
При внесении питания в чернозёмы и суглинки с нормальной влажностью земли калий способствует росту культур. В такие почвы его полезно вносить под подсолнечник, свёклу, деревья.
- На кислых почвах внесение K₂SO₄ совмещают с известью.
- Тяжёлую почву лучше подкармливать осенью, стараясь удобрение заделывать в землю.
- На солонцовых почвах, перенасыщенных солями, калийное удобрение обычно не используется.
- Цветы удобряют в период цветения, а кустарники и деревья — во время плодоношения.
- Для газона добавки вносят осенью в сентябре — октябре.
Использование для обработки растений
Важно помнить, что в разумных дозах K₂SO₄ не опасен для организма человека. Однако повышенное содержание его в плодах может дать побочный эффект в виде аллергической реакции или нарушения пищеварения у человека.
Способы внесения K₂SO₄
Порошок K ₂ SO ₄ выпускается в упаковках по 1 кг или 3 кг. Подкормки проводят различными способами:
Сухой порошок вносят на обработанную землю во время посадки или во время подготовки к зиме. Для деревьев порошок насыпают в приствольный круг в объёме 150−200 г, и заглубляют в почву.
- Порошок разводят в воде (дозировка — согласно нормам для каждого растения), полученным раствором поливают. Этот простой метод обеспечивает лёгкий доступ питания к корням.
- Поверхностное опрыскивание питательным раствором. Подходит для обработки на глинистых почвах способом подкормки по листу. На 10 литров воды нужно взять 35−40 г K₂SO₄.
- На кислых почвах можно совместить K₂SO₄ с известью (для раскисления).
Обработка отдельных видов растений
При обработке растений обязательно нужно соблюдать инструкцию по применению удобрения. Подкормка проводится согласно нормам расхода для различных видов растений:
- Для томатов K₂SO₄ вносят по 20 г на 1 метр квадратный. Допускается сочетание с другими удобрениями.
- Огурцы обрабатывают: первый раз — перед посевом (1 г/м²), второй раз — через 10−14 дней после посадки (2 г/м²), третий раз — в период цветения (4 г/м²).
Для корнеплодов берётся норма — 30 г/м².
- Для капусты рассыпают 25−30 г /м² порошка при перекопке.
- Для кустарников в период цветения вносят в грунт — 20 г/м².
- Для корневой подкормки винограда — добавляют 20 г порошка на 1 м². Удобрение растворяют в 10 литрах воды. Подкормку таким образом проводят ежегодно, так как виноград особенно нуждается в калии.
- Для плодовых деревьев сухой порошок насыпают в яму при посадке или в приствольный круг в объёме 200−250 г на дерево.
- Клубнику и землянику удобряют в период цветения до 20г/м².
- Для картофеля порошок насыпают при перекопке по 30−35 г/м².
- Калийные удобрения полезны для цветов, особенно для роз. Вносить 1 раз в неделю по 15 г/м².
Меры безопасности при работе с удобрениями
Удобрение — химическое средство. Поэтому очень важно соблюдать необходимые меры безопасности при работе с ними:
Перед началом использования прочитать инструкцию о правилах использования и мерах безопасности.
- Во время работы использовать перчатки и маску во избежание попадания раствора на кожу.
- После окончания работы вымыть лицо и руки водой с мылом.
- Обработку растений проводить не позднее двух недель до сбора урожая.
Калия сульфат очень важен для растений во время роста. Помимо этого, используя его как удобрение в открытом грунте и в теплице, можно повысить устойчивость к различным вредителям и болезням.
Originally posted 2018-03-11 12:28:12.
Источник
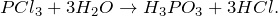
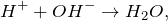
 Увеличить уровень сахаров и витаминов в мякоти плодов и зелёной массе.
Увеличить уровень сахаров и витаминов в мякоти плодов и зелёной массе. При внесении питания в чернозёмы и суглинки с нормальной влажностью земли калий способствует росту культур. В такие почвы его полезно вносить под подсолнечник, свёклу, деревья.
При внесении питания в чернозёмы и суглинки с нормальной влажностью земли калий способствует росту культур. В такие почвы его полезно вносить под подсолнечник, свёклу, деревья. Сухой порошок вносят на обработанную землю во время посадки или во время подготовки к зиме. Для деревьев порошок насыпают в приствольный круг в объёме 150−200 г, и заглубляют в почву.
Сухой порошок вносят на обработанную землю во время посадки или во время подготовки к зиме. Для деревьев порошок насыпают в приствольный круг в объёме 150−200 г, и заглубляют в почву. Для корнеплодов берётся норма — 30 г/м².
Для корнеплодов берётся норма — 30 г/м². Перед началом использования прочитать инструкцию о правилах использования и мерах безопасности.
Перед началом использования прочитать инструкцию о правилах использования и мерах безопасности.


