- Сульфид калия: способы получения и химические свойства
- Способ получения
- Качественная реакция
- Химические свойства
- Гидролиз сульфида калия
- Общие сведения о сульфиде калия
- Гидролиз сульфида калия
- Примеры решения задач
- K2S + H2O = ? уравнение реакции
- Сульфид калия
- Содержание
- Физические свойства
- Получение
- Химические свойства
- Применение
- В пиротехническом деле
- Acetyl
Сульфид калия: способы получения и химические свойства
Сульфид калия K2S — белое вещество, плавится без разложения. Термически устойчивый. Хорошо растворяется в воде.
Относительная молекулярная масса Mr = 110,26; относительная плотность для тв. и ж. состояния d = 1,74; tпл = 912º C.
Способ получения
1. Сульфид калия можно получить путем взаимодействия калия и серы при температуре 100 — 200º C:
2K + S = K2S
2. При взаимодействии с углеродом (коксом) сульфат калия при температуре 900º C образует сульфид калия и угарный газ:
3. При температуре 600º C в присутствии оксида железа (III) сульфат калия реагирует с водородом . Взаимодействие сульфата калия с водородом приводит к образованию сульфида калия и воды:
Качественная реакция
Качественная реакция на сульфид калия — взаимодействие его с хлоридом меди, в результате реакции происходит образование черного осадка:
1. При взаимодействии с хлоридом меди , сульфид калия образует осадок сульфид меди и хлорид калия:
CuCl2 + K2S = CuS↓ + 2KCl
Химические свойства
1. Сульфид калия может реагировать с простыми веществами :
Твердый сульфид калия реагирует с кислородом при температуре выше 500º C. При этом образуется сульфат калия:
2. Сульфид калия вступает в реакцию со многими сложными веществами :
2.1. Сульфид калия способен реагировать со многими кислотами :
2.1.1. Сульфид калия реагирует с разбавленной хлороводородной кислотой . Взаимодействие сульфида калия с хлороводородной кислотой приводит к образованию хлорида калия и газа сероводорода:
K2S + 2HCl = 2KCl + H2S↑
2.1.2. Сульфид калия взаимодействует с концентрированной серной кислотой . При этом образуются гидросульфат калия, газ оксид серы, осадок сера и вода:
2.1.3. При взаимодействии сульфида калия с концентрированной азотной кислотой выделяются нитрат калия, газ оксид азота, сера и вода:
2.1.4 . Взаимодействуя с насыщенной сероводородной кислотой холодный сульфид калия образует гидросульфид калия:
Источник
Гидролиз сульфида калия
Общие сведения о сульфиде калия
Молярная масса – 110г/моль. Представляет собой бесцветные кристаллы кубической формы.
Гидролиз сульфида калия
Гидролизуется по аниону. Характер среды – щелочной. Уравнение гидролиза выглядит следующим образом:
K2S ↔ 2K + + S 2- (диссоциация соли);
S 2- + HOH ↔ HS — + OH — (гидролиз по аниону);
2K + + S 2- + HOH ↔ HS — + 2K + + OH — (уравнение в ионной форме);
K2S +H2O ↔ KHS + KOH (уравнение в молекулярной форме).
KHS ↔ K + +HS — (диссоциация соли);
HS — + HOH ↔H2S↑ + OH — (гидролиз по аниону);
K + + 2HS — + HOH ↔ H2S↑ + K + + OH — (уравнение в ионной форме);
KHS + H2O ↔ H2S↑ + KOH (уравнение в молекулярной форме).
Примеры решения задач
| Задание | Сульфид калия получают нагреванием смеси, состоящей из калия и серы, при температуре 100-200 o С. Какая масса продукта реакции образуется, если взаимодействуют 11 г калия и 16 г серы? |
| Решение | Запишем уравнение реакции взаимодействия серы и калия: |
Найдем количество молей исходных веществ используя данные, указанные в условии задачи. Молярная масса калия равна –39 г/моль, серы – 32 г/моль.
υ(K) = m(K)/ M(K) = 11/39 = 0,28 моль;
υ(S) = m(S)/ M(S) = 16/32 = 0,5 моль.
Калий в недостатке (υ(K) ПРИМЕР 2
| Задание | При сжигании 28 г сульфида калия в кислороде был получен сульфат калия. Определите его массу. |
| Решение | Запишем уравнение реакции: |
Найдем количество вещества сульфида калия (молярная масса – 110 г/моль):
Согласно уравнению реакции υ(K2S) = υ(K2SO4) =0,25 моль. Тогда масса сульфата калия (молярная масса – 174г/моль) будет равна:
Источник
K2S + H2O = ? уравнение реакции
Запишите уравнение реакции взаимодействия сульфида калия с водой (K2S + H2O = ?). Возможно ли это? Расскажите о сульфидах: укажите физические и химические свойства солей этого типа, а также способы их получения
Сульфид калия представляет собой бесцветные кристаллы, хорошо растворимые в воде (K2S + H2O = ?), этиловом спирте и глицерине. В водном растворе, данная соль, образованная сильным основанием – гидроксидом калия и слабой кислотой – сероводородной, гидролизуется по аниону.
Наличие гидроксид-ионов свидетельствует о щелочном характере среды.
Средние соли сероводорода называются сульфидами. Их можно получать различными способами, в том числе непосредственным соединением металлов с серой. Смешав, например, железные опилки с порошком серы и нагрев смесь в одном месте, можно легко вызвать реакцию железа с серой, которая дальше идет сама и сопровождается выделением большого количества теплоты:
Многие сульфиды можно получить, действуя сероводородом на растворимые в воде соли соответствующих металлов. Например, при пропускании сероводорода через раствор какой-нибудь соли меди (II) появляется черный осадок сульфида меди (II):
Источник
Сульфид калия
| Сульфид калия | |
|---|---|
 | |
| Систематическое наименование | калия сульфид |
| Традиционные названия | калий сернистый, сульфид калия, калия моносульфид |
| Хим. формула | K2S |
| Состояние | бесцветный порошок с запахом тухлых яиц |
| Молярная масса | 110,262 г/моль |
| Плотность | 1,805 г/см³ |
| Температура | |
| • плавления | 471; 948 °C |
| Мол. теплоёмк. | 76,15 Дж/(моль·К) |
| Энтальпия | |
| • образования | −387,3 кДж/моль |
| Растворимость | |
| • в воде | растворяется с образованием KSH, KOH |
| • в остальных веществах | растворяется в этаноле и глицерине |
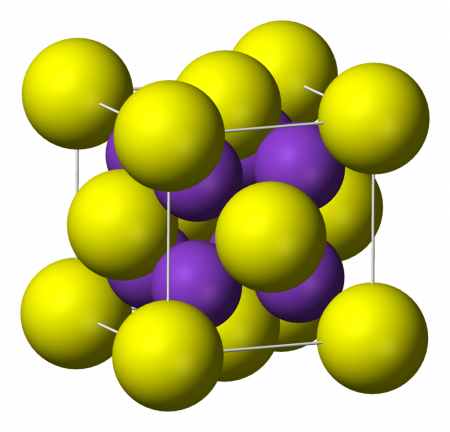
| Кристаллическая структура | кубическая сингония |
| Рег. номер CAS | 1312-73-8 |
| PubChem | 14800 |
| Рег. номер EINECS | 215-197-0 |
| SMILES | |
| RTECS | TT6000000 |
| ChemSpider | 14116 |
| Пиктограммы ECB |   |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Калия сульфид — бинарное неорганическое химическое соединение калия с серой. Представляет собой соединение с формулой K2S.
Содержание
Физические свойства
Сульфид калия K2S — бесцветные кубические кристаллы (a = 0,739 нм, Z=4; пространственная группа Fm3m). Хорошо растворимы в воде (с гидролизом). Растворим в спирте и глицерине. Гигроскопичен, образует ди- и пентагидраты.
Получение
Прямой синтез из элементов:
2K + S → 100−200oC K2S
Восстановление сульфата калия водородом:
или углеродом (в промышленности — кокс):
Сульфит калия при нагревании диспропорционирует:
Химические свойства
На воздухе медленно окисляется:
в зависимости от условий проведения этой реакции образуются побочные продукты: коллоидная сера, полисульфиды калия.
Сульфид калия при поджигании сгорает:
Так как сероводород является слабой кислотой, то сульфид калия разлагается кислотами:
Концентрированные кислоты могут окислять выделяемый сероводород:
При кипячении раствора сульфида калия с серой или сплавления его с серой образуются полисульфиды:
для калия выделены полисульфиды вплоть до n = 6.
При пропускании через раствор сульфида калия избытка сероводорода образуются гидросульфид калия:
Реагирует, образовывая соединения с сульфидами Ag, Sn и другими.
Применение
Калия сульфид компонент светочувствительных эмульсий в фотографии, аналитический реагент для разделения сульфидов металлов, является компонентом входящим в состав для удаления наружного слоя шкур.
В пиротехническом деле
Сульфид калия образуется при сжигании пороха.
Источник
Acetyl
Это пилотный ролик из серии об органических реакциях.
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Источник |











