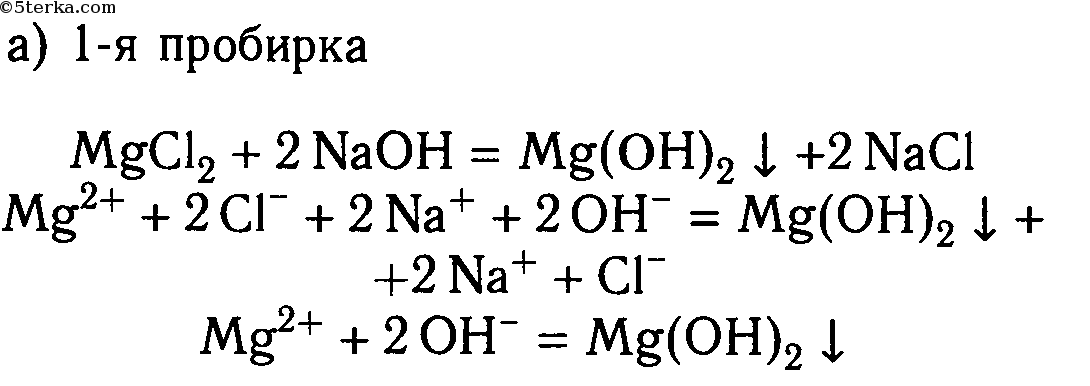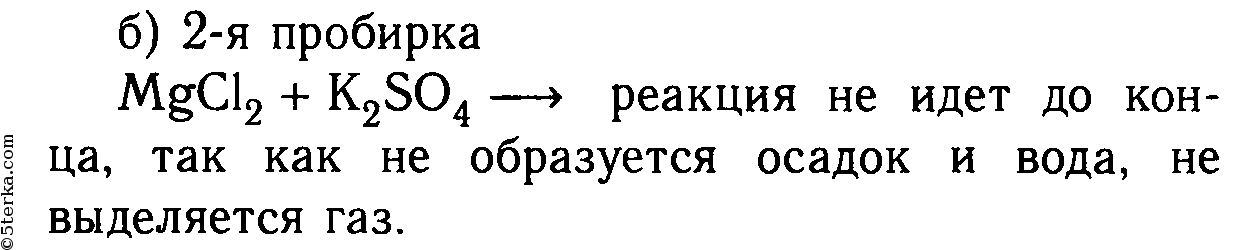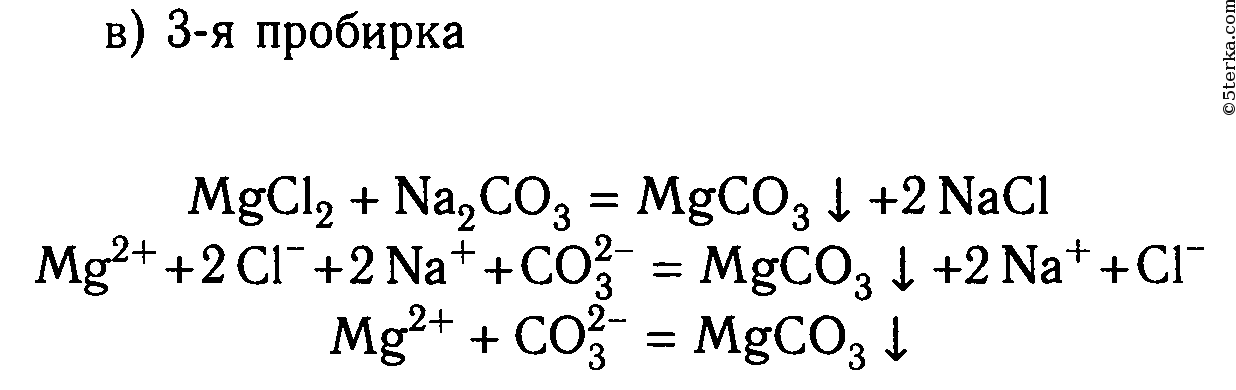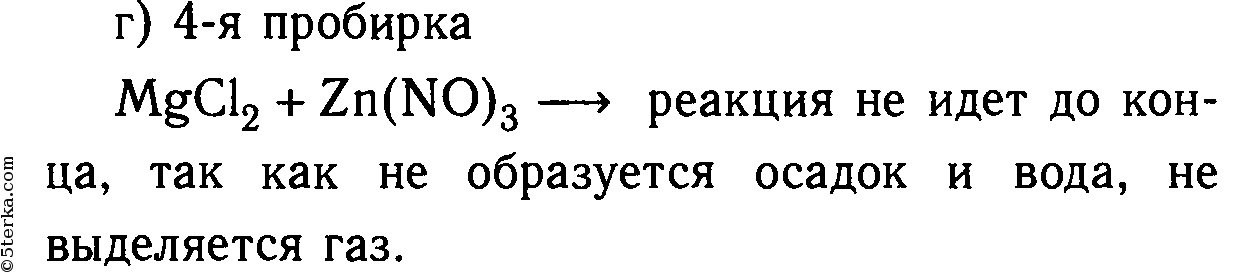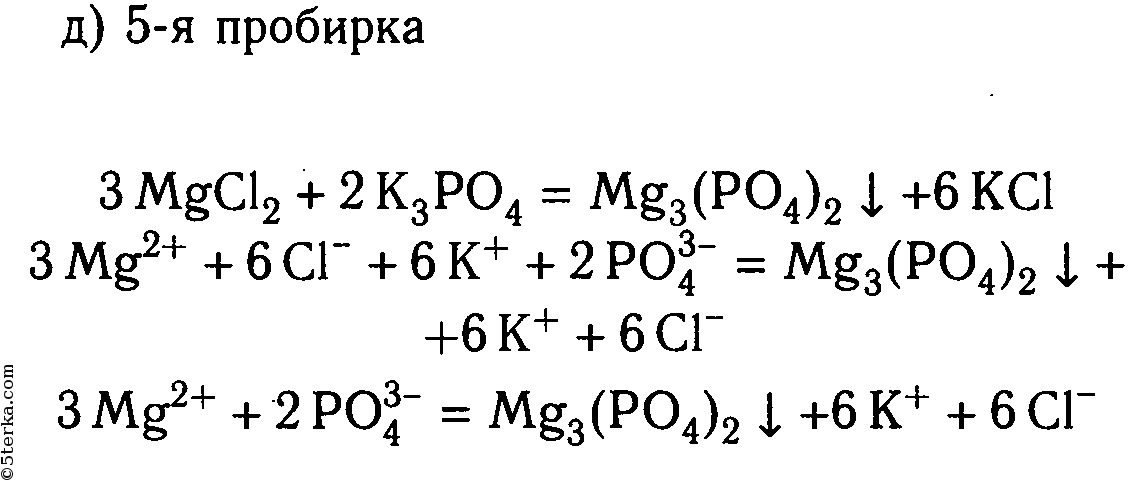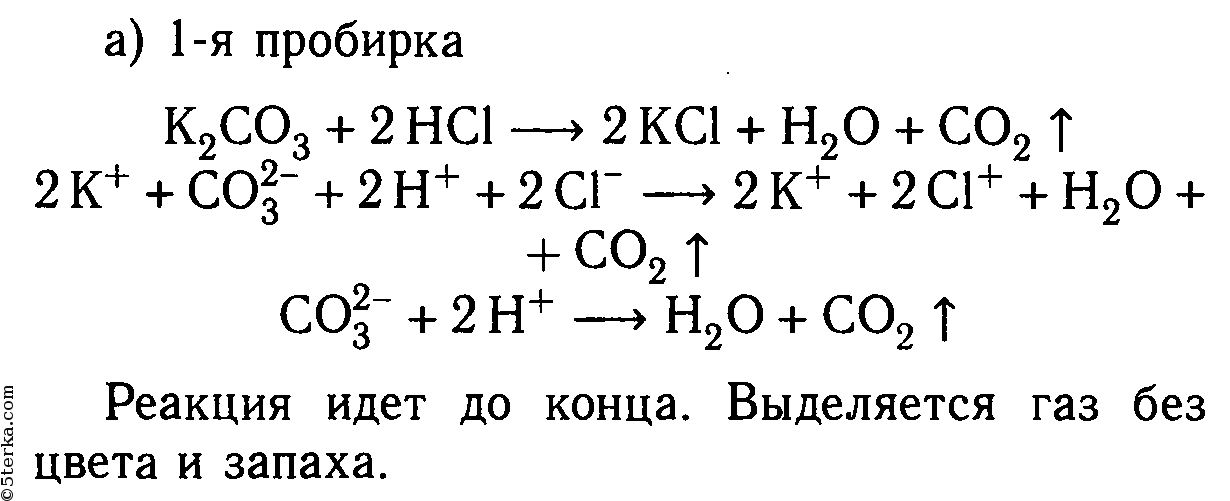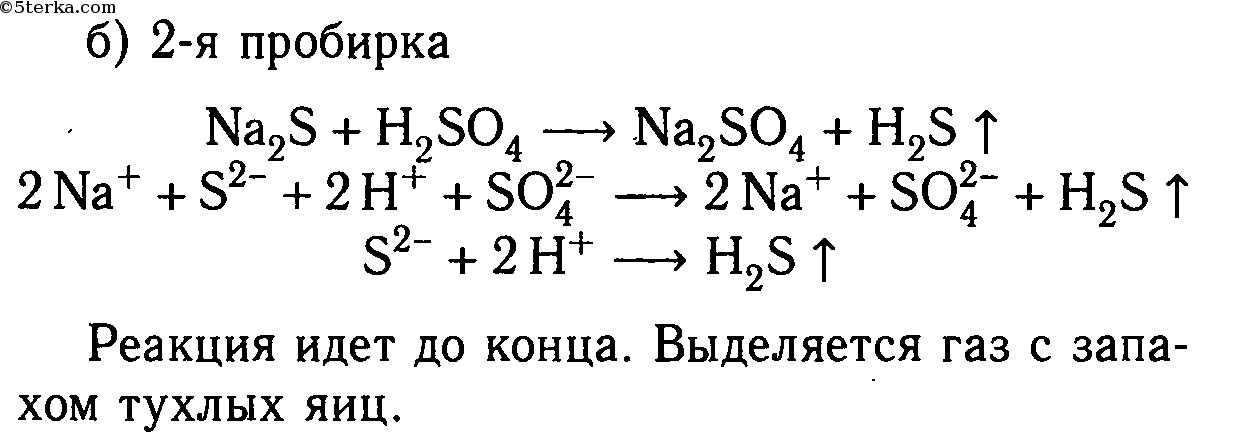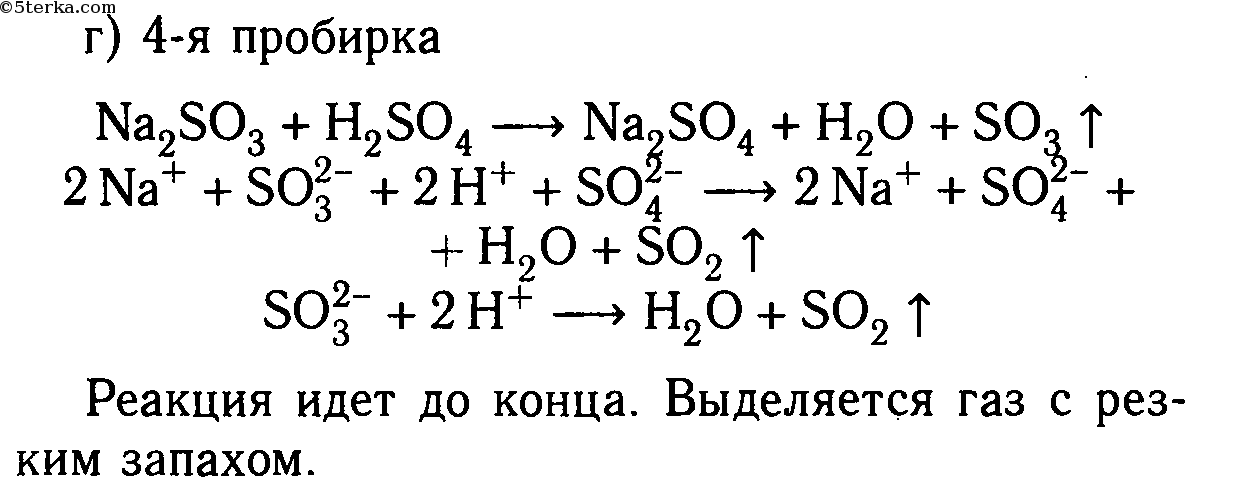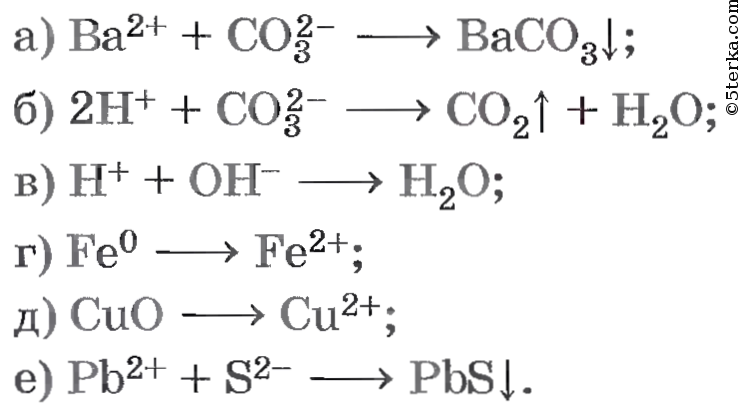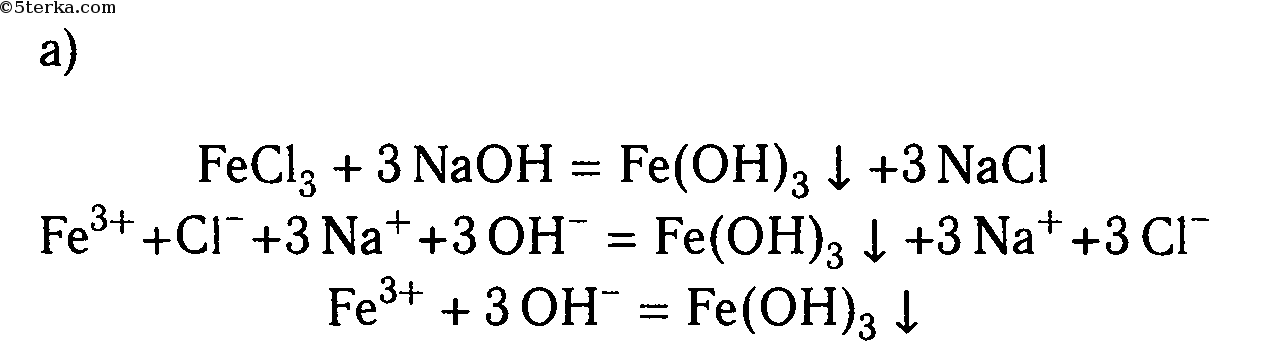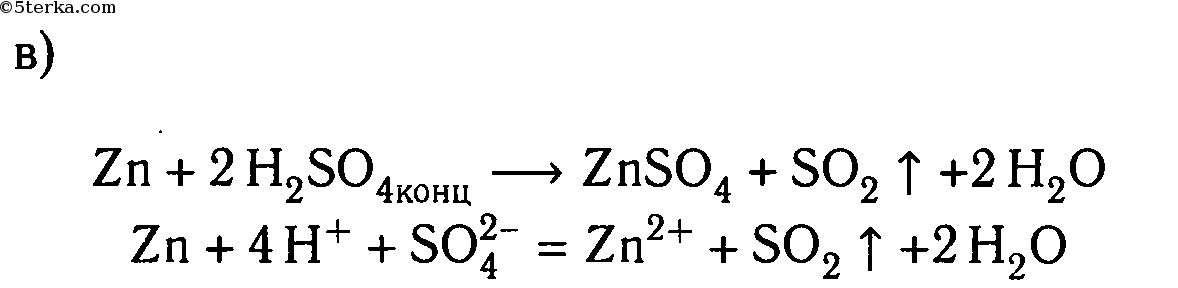- Практическая работа №4. Экспериментальные задачи по теме «Подгруппа кислорода».
- Задача 1
- Задача 2
- Задача 3
- Задача 4
- Задача 5
- Задача 6
- Задача 7
- Задача 8
- Задача 1
- Задача 2
- Задача 3
- Задача 4
- Задача 5
- Задача 6
- Задача 7
- Задача 8
- Практическая работа №9. Решение экспериментальных задач.
- Практическая работа № 9. Решение экспериментальных задач
Практическая работа №4. Экспериментальные задачи по теме «Подгруппа кислорода».
Задача 1
Проведите реакции, подтверждающие качественный состав серной кислоты. Напишите уравнения реакций.
Задача 2
В пробирку поместите 1-2 гранулы цинка и прилейте в неё около 1 мл разбавленной серной кислоты. Что вы наблюдаете? Напишите уравнение реакции и рассмотрите окислительно-восстановительные процессы.
Задача 3
Налейте в две пробирки по 1-2 мл раствора сульфида натрия. Прилейте в одну из них такой же объём хлорной воды, а в другую – бромной воды. Что вы наблюдаете? Объясните свои наблюдения. Напишите уравнения соответствующих реакций в молекулярном и ионном виде.
Задача 4
Вам даны три пробирки с растворами. Определите, в какой из них находится соляная кислота, серная кислота и гидроксид натрия. Напишите уравнения соответствующих реакций в молекулярном и ионном виде.
Задача 5
Определите, содержит ли поваренная соль примесь сульфатов. Напишите уравнения реакций в молекулярном и ионном виде.
Задача 6
С помощью характерных реакций установите, является выданная вам соль сульфатом, иодидом или хлоридом. Напишите уравнения соответствующих реакций в молекулярном и ионном виде.
Задача 7
Исходя из оксида меди (II), получите раствор сульфата меди (II) и выделите из него кристаллический медный купорос. Напишите уравнения соответствующих реакций в молекулярном и ионном виде.
Задача 8
Вам даны три пробирки с растворами сульфата, сульфита и сульфида натрия. Определите с помощью только одного реактива, в какой пробирке находится каждое из веществ. Напишите уравнения соответствующих реакций в молекулярном и ионном виде.
Задача 1
Чтобы доказать, что в серной кислоте имеются катионы водорода, прильём в раствор кислоты раствор лакмуса, он окрасит раствор в красный цвет.
Чтобы доказать, что в серной кислоте имеются сульфат-анионы, прильём раствор кислоты в раствор хлорида бария, в результате реакции выпадет осадок белого цвета:
H2SO4 + BaCl2 ⟶ 2HCl + BaSO4↓
Задача 2
| Zn + H2SO4 ⟶ ZnSO4 + H2↑ | ||
| 2H + + 2ē ⟶ H2 0 | 1 | окислитель (восстановление) |
| Zn 0 — 2ē ⟶ Zn +2 | 1 | восстановитель (окисление) |
Задача 3
При добавлении хлорной воды к раствору сульфида натрия наблюдается обесцвечивание хлорной воды и выпадение светло-желтого осадка потому, что хлор вытесняет серу из сульфида натрия, т. к. хлор является более электроотрицательным элементом, чем сера:
Na2S + Cl2 ⟶ 2NaCl + S↓
2Na + + S 2- + Cl2 ⟶ 2Na + + 2Cl — + S↓
S 2- + Cl2 ⟶ 2Cl — + S↓
При добавлении бромной воды к раствору сульфида натрия наблюдается обесцвечивание бромной воды и выпадение светло-желтого осадка потому, что бромной вытесняет серу из сульфида натрия, т. к. бром является более электроотрицательным элементом, чем сера:
Na2S + Br2 ⟶ 2NaBr + S↓
2Na + + S 2- + Br2 ⟶ 2Na + + 2Br — + S↓
S 2- + Br2 ⟶ 2Br — + S↓
Задача 4
Определить в какой пробирке находится раствор гидроксида натрия можно с помощью индикатора, например, фенолфталеина, он окрасится в малиновый цвет. Для подтверждения можно добавит сульфат меди, в результате реакции выпадет голубой осадок:
2NaOH + CuSO4 ⟶ Na2SO4 + Cu(OH)2↓
2Na + + 2OH — + Cu 2+ + SO4 2- ⟶ 2Na + + SO4 2- + Cu(OH)2↓
Cu 2+ + 2OH — ⟶ Cu(OH)2↓
Для определения соляной и серной кислот добавим раствор хлорида бария, в пробирке с серной кислотой выпадет осадок белого цвета:
H2SO4 + BaCl2 ⟶ 2HCl + BaSO4↓
2H + + SO4 2- + Ba 2+ + 2Cl — ⟶ 2H + + 2Cl — + BaSO4↓
Ba 2+ + SO4 2- ⟶ BaSO4↓
Задача 5
Определить, что поваренная соль содержит примесь сульфатов, можно с помощью раствора хлорида бария. Для это растворим поваренную соль, и добавим раствор хлорида бария, в результате реакции выпадет осадок белого цвета:
Na2SO4 + BaCl2 ⟶ 2NaCl + BaSO4↓
2Na + + SO4 2- + Ba 2+ + 2Cl — ⟶ 2Na + + 2Cl — + BaSO4↓
Ba 2+ + SO4 2- ⟶ BaSO4↓
Задача 6
NaI + AgNO3 ⟶ NaNO3 + AgI↓
Na + + I — + Ag + + NO3 — ⟶ Na + + NO3 — + AgI↓
Ag + + I — ⟶ AgI↓
NaCl + AgNO3 ⟶ NaNO3 + AgCl↓
Na + + Cl — + Ag + + NO3 — ⟶ Na + + NO3 — + AgCl↓
Ag + + Cl — ⟶ AgCl↓
Задача 7
Из оксида меди (II), получим раствор сульфата меди (II), для этого добавим раствор серной кислоты:
CuO + H2SO4 ⟶ CuSO4 + H2O
CuO + 2H + + SO4 2- ⟶ Cu 2+ + SO4 2- + H2O
CuO + 2H + ⟶ Cu 2+ + H2O
Далее выпарим большую часть воды, и остудим полученный раствор, в результате этого образуются кристаллы медного купороса CuSO4∙5H2O.
Задача 8
Определить в каких пробирках находятся растворы сульфата, сульфита и сульфида натрия можно с помощью сильной кислоты. Прильём в каждую пробирку соляной кислоты.
В пробирке с сульфатом натрия запах отсутствует:
Na2SO4 + 2HCl ⇸
В пробирке с сульфитом натрия появился резкий запах:
Na2SO3 + 2HCl ⟶ 2NaCl + H2O + SO2↑
В пробирке с сульфидом натрия появился запах тухлых яиц:
Na2S + 2HCl ⟶ 2NaCl + H2S↑
Источник
Практическая работа №9. Решение экспериментальных задач.
Налейте в пробирку 1-2 мл концентрированного раствора серной кислоты и опустите в неё гранулу цинка. Составьте уравнение реакции в молекулярном и ионном видах, покажите переход электронов. Что в этой реакции является окислителем?
В шести пробирках находятся растворы хлорида магния. В каждую из пробирок последовательно прилейте следующие растворы: а) гидроксид натрия; б) сульфат калия; в) карбонат натрия; г) нитрат цинка; д) фосфат калия; е) сульфид натрия.
Составьте уравнения реакций, протекающих до конца, в молекулярном и ионном видах.
Даны растворы: а) карбоната калия и соляной кислоты; б) сульфида натрия и серной кислоты; в) хлорида цинка и азотной кислоты; г) сульфита натрия и серной кислоты; д) сульфата меди (II) и азотной кислоты.
Слейте попарно эти растворы, немного нагрейте и осторожно определите по запаху, в каких случаях реакции протекают до конца и почему. Составьте уравнения со ответствующих реакций в молекулярном и ионном видах.
Осуществите реакции, схемы которых:
а) Ba 2+ + CO3 2- ⟶ BaCO3↓;
б) 2H + + CO3 2- ⟶ CO2↑ + H2O;
в) H + + OH — ⟶ H2O;
г) Fe 0 ⟶ Fe 2+ ;
д) CuO ⟶ Cu 2+ ;
е) Pb 2+ + S 2- ⟶ PbS↓.
Проделайте реакции между следующими веществами:
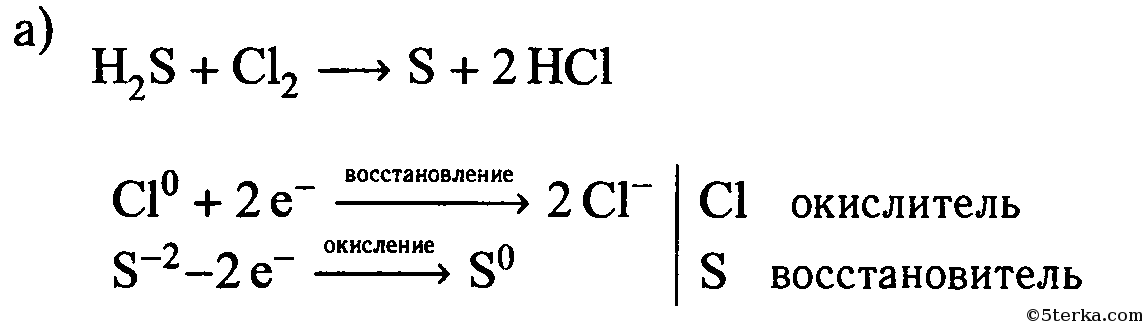
а) сероводородной и хлорной водой;
б) раствором иодида калия и хлорной водой;
в) соляной кислотой и алюминием;
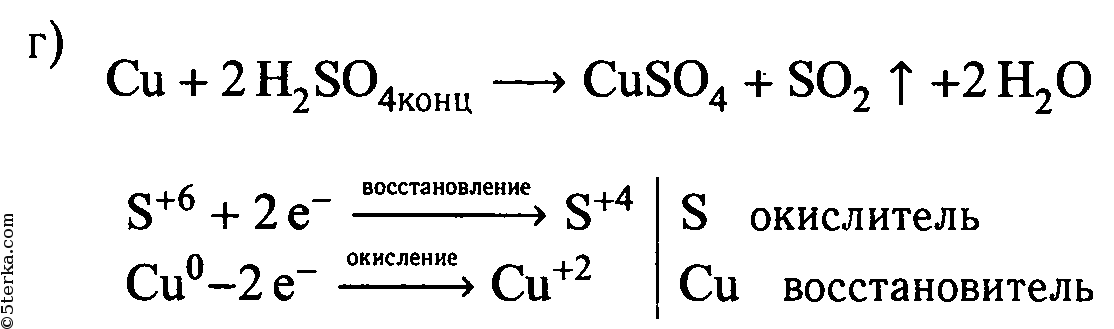
г) концентрированной серной кислотой и медью (при нагревании).
Составьте уравнения реакций, покажите переход электронов. Что является окислителем и что – восстановителем?
Пользуясь растворами и веществами, находящимися на столе, получите:
а) гидроксид железа (III);
б) сульфид меди (II);
в) оксид серы (IV);
г) карбонат магния;
д) свинец.
Составьте молекулярные и ионные уравнения соответствующих реакций.
| Zn + H2SO4 ⟶ ZnSO4 + H2↑ Zn + 2H + + SO4 2- ⟶ Zn 2+ + SO4 2- + H2↑ Zn + 2H + ⟶ Zn 2+ + H2↑ | ||
| 2H + + 2ē ⟶ H2 0 | 1 | окислитель (восстановление) |
| Zn 0 — 2ē ⟶ Zn +2 | 1 | восстановитель (окисление) |
MgCl2 + 2NaOH ⟶ 2NaCl + Mg(OH)2↓
Mg 2+ + 2Cl — + 2Na + + 2OH — ⟶ 2Na + + 2Cl — + Mg(OH)2↓
Mg 2+ + 2OH — ⟶ Mg(OH)2↓
MgCl2 + K2SO4 ⇸ реакция не идет, т. к. не образуется осадок или газ.
MgCl2 + Zn(NO3)2 ⇸ реакция не идет, т. к. не образуется осадок или газ.
MgCl2 + Na2S ⟶ 2NaCl + MgS↓
Mg 2+ + 2Cl — + 2Na + + S 2- ⟶ 2Na + + 2Cl — + MgS↓
Mg 2+ + S 2- ⟶ MgS↓
K2CO3 + 2HCl ⟶ 2KCl + H2O + CO2↑
2K + + CO3 2- + 2H + + 2Cl — ⟶ 2K + + 2Cl — + H2O + CO2↑
2H + + CO3 2- ⟶ H2O + CO2↑
Реакция идет до конца, т. к. выделяется газ, не имеющий запаха.
Na2S + H2SO4 ⟶ Na2SO4 + H2S↑
2Na + + S 2- + 2H + + SO4 2- ⟶ 2Na + + SO4 2- + H2S↑
2H + + S 2- ⟶ H2S↑
Реакция идет до конца, т. к. выделяется газ, имеющий запах тухлых яиц.
ZnCl2 + HNO3 ⇸ реакция не идет, т. к. не образуется осадок или газ.
CuSO4 + 2HNO3 ⇸ реакция не идет, т. к. не образуется осадок или газ.
| а) H2S + Cl2 ⟶ S + 2HCl | ||
| Cl2 0 + 2ē ⟶ 2Cl — | 1 | окислитель (восстановление) |
| S -2 — 2ē ⟶ S 0 | 1 | восстановитель (окисление) |
| 2KI + Cl2 ⟶ 2KCl + I2 | ||
| Cl2 0 + 2ē ⟶ 2Cl — | 1 | окислитель (восстановление) |
| 2I — — 2ē ⟶ I2 0 | 1 | восстановитель (окисление) |
| 2Al + 6HCl ⟶ 2AlCl3 + 3H2↑ | ||
| 2H + + 2ē ⟶ H2 0 | 3 | окислитель (восстановление) |
| Al 0 — 3ē ⟶ Al +3 | 2 | восстановитель (окисление) |
| Cu + 2H2SO4(конц.) ⟶ CuSO4 + SO2↑ + 2H2O | ||
| S +6 + 2ē ⟶ S +4 | 1 | окислитель (восстановление) |
| Cu 0 — 2ē ⟶ Cu +2 | 1 | восстановитель (окисление) |
а) FeCl3 + 3NaOH ⟶ 3NaCl + Fe(OH)3↓
Fe 3+ + 3Cl — + 3Na + + 3OH — ⟶ 3Na + + 3Cl — + Fe(OH)3↓
Fe 3+ + 3OH — ⟶ Fe(OH)3↓
б) CuSO4 + Na2S ⟶ Na2SO4 + CuS↓
Cu 2+ + SO4 2- + 2Na + + S 2- ⟶ 2Na + + SO4 2- + CuS↓
Cu 2+ + S 2- ⟶ CuS↓
д) Zn + Pb(NO3)2 ⟶ Zn(NO3)2 + Pb↓
Zn 0 + Pb 2+ + 2NO3 — ⟶ Zn 2+ + 2NO3 — + Pb↓
Zn 0 + Pb 2+ ⟶ Zn 2+ + Pb↓
Источник
Практическая работа № 9. Решение экспериментальных задач
1. Налейте в пробирку 1—2 мл концентрированного раствора серной кислоты и опустите в нее гранулу цинка. Составьте уравнение реакции в молекулярном и ионном видах, покажите переход электронов. Что в этой реакции является окислителем?
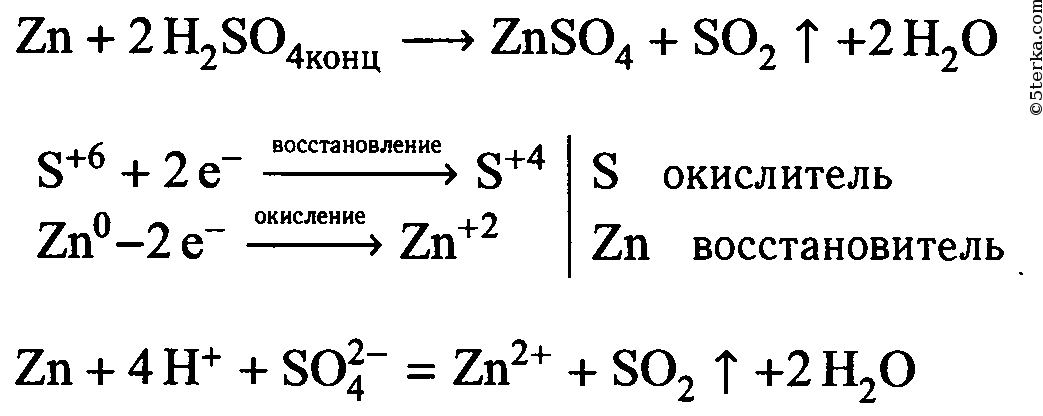
2. В шести пробирках находятся растворы хлорида магния. В каждую из пробирок последовательно прилейте следующие растворы: а) гидроксид натрия; б) сульфат калия; в) карбонат натрия; г) нитрат цинка; д) фосфат калия; е) сульфид натрия.
Составьте уравнения реакций, протекающих до конца, в молекулярном и ионном видах.
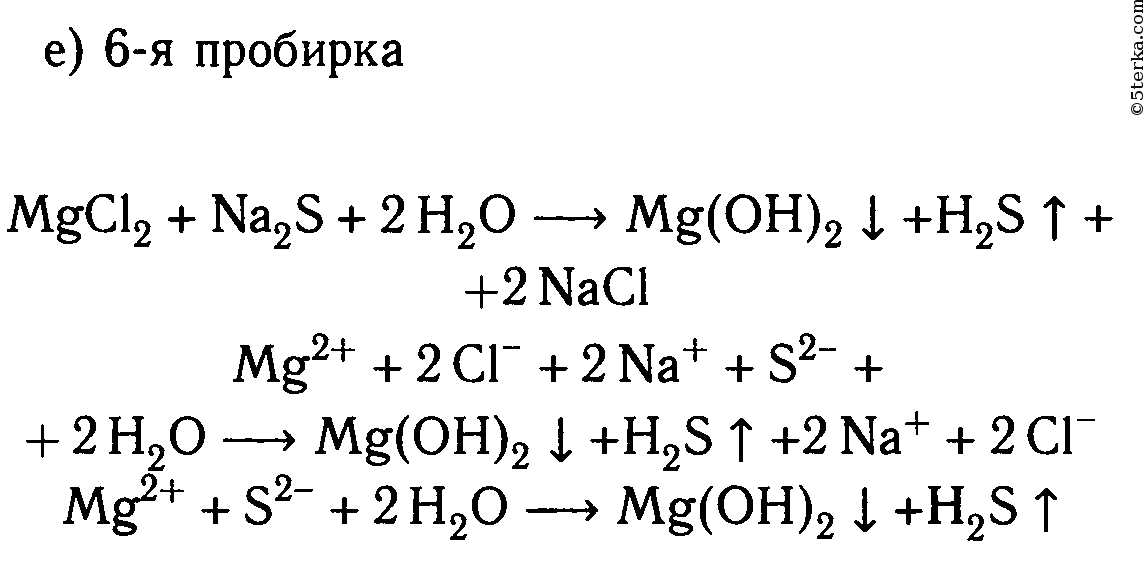
3. Даны растворы: а) карбонат калия и соляная кислота; б) сульфид натрия и серная кислота; в) хлорид цинка и азотная кислота; г) сульфит натрия и серная кислота; д) сульфат меди (II) и азотная кислота.
Слейте попарно эти растворы, немного нагрейте и осторожно определите по запаху, в каких случаях реакции протекают до конца и почему. Составьте уравнения соответствующих реакций в молекулярном и ионном видах.

4. Осуществите реакции, схемы которых:

5. Проделайте реакции между следующими веществами:а) сероводородной и хлорной водой;б) раствором иодида калия и хлорной водой;в) соляной кислотой и алюминием;г) концентрированной серной кислотой и медью (при нагревании).
Составьте уравнения реакций, покажите переход электронов. Что является окислителем и что — восстановителем?
6. Пользуясь растворами и веществами, находящимися на столе, получите:а) гидроксид железа (III);б) сульфид меди (II);в) оксид серы (IV);г) карбонат магния;д) свинец.
Составьте молекулярные и ионные уравнения соответствующих реакций.
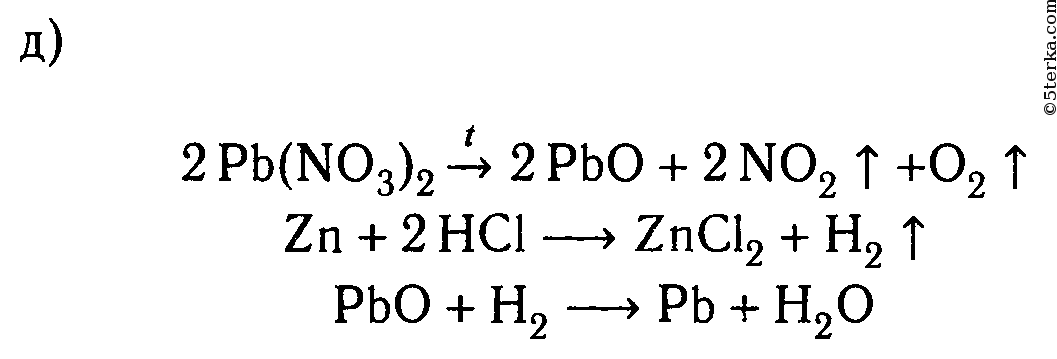

задача №4
к главе «Глава 7. Свойства электролитов».
Источник