- Сульфид лития: способы получения и химические свойства
- Способ получения
- Качественная реакция
- Химические свойства
- Сульфид лития
- Содержание
- Физические свойства
- Химические свойства
- Получение
- Полисульфиды лития
- Применение
- Опасность для здоровья
- Сульфид лития
- Содержание
- Физические свойства
- Химические свойства
- Получение
- Полисульфиды лития
- Применение
- Потенциальная опасность для здоровья
Сульфид лития: способы получения и химические свойства
Сульфид лития Li2S — светло-желтое вещество, плавится без разложения. Хорошо растворяется в воде (сильный гидролиз по аниону). Кристаллогидратов не образует.
Относительная молекулярная масса Mr = 45,95; относительная плотность по тв. и ж. состоянию d = 1,66; tпл = 950º C.
Способ получения
1. Сульфид лития можно получить путем взаимодействия лития и серы при температуре выше 130º C:
2Li + S = Li2S
2. При температуре 300–350º C, в результате взаимодействия гидрида лития и серы , образуется сульфид лития и сероводородная кислота:
2LiH + 2S = Li2S + H2S
3. Оксид лития реагирует с сероводородной кислотой при температуре 900–1000º C. При этом образуются сульфид лития и вода:
4. При взаимодействии с углеродом сульфат лития при температуре 800–900º C образует сульфид лития и угарный газ:
5. При температуре 600–700º C сульфат лития реагирует с водородом . Взаимодействие сульфата лития с водородом приводит к образованию сульфида лития и воды:
Качественная реакция
Качественная реакция на сульфид лития — взаимодействие его с хлоридом меди, в результате реакции происходит образование черного осадка:
1. При взаимодействии с хлоридом меди , сульфид лития образует осадок сульфид меди и хлорид лития:
CuCl2 + Li2S = CuS↓ + 2LiCl
Химические свойства
1. Сульфид лития реагирует с холодной водой и кислородом с образованием осадка серы и гидроксида лития:
2. Сульфид лития может реагировать с простыми веществами :
Сульфид лития реагирует с кислородом при температуре выше 300º C. При этом образуются сульфат лития:
3. Сульфид лития вступает в реакцию со многими сложными веществами :
3.1. Сульфид лития способен реагировать со многими кислотами :
3.1.1. Сульфид лития реагирует с разбавленной хлороводородной кислотой . Взаимодействие сульфида лития с хлороводородной кислотой приводит к образованию хлорида лития и газа сероводорода:
Li2S + 2HCl = 2LiCl + H2S↑
3.1.2. Сульфид лития взаимодействует с концентрированной серной кислотой . При этом образуются гидросульфат лития, газ оксид серы, осадок сера и вода:
3.1.3. При взаимодействии сульфида лития с концентрированной азотной кислотой выделяются нитрат лития, газ оксид азота, осадок сера и вода:
3.1.4 . Взаимодействуя с насыщенной сероводородной кислотой холодный сульфид лития образует гидросульфид лития:
Li2S + H2S = 2LiHS
Источник
Сульфид лития
| Сульфид лития | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Сульфид лития |
| Химическая формула | Li2S |
| Эмпирическая формула | Li2S |
| Физические свойства | |
| Состояние (ст. усл.) | твёрдое |
| Молярная масса | 46,95 г/моль |
| Плотность | 1,66 [1] г/см³ |
| Термические свойства | |
| Температура плавления | 950 [1] °C |
| Температура кипения | 1527 [2] °C |
| Энтальпия образования (ст. усл.) | −447 [3] кДж/моль |
| Классификация | |
| Рег. номер CAS | 12136-58-2 |
| Рег. номер EINECS | 235-228-1 |
| RTECS | OJ6439500 |
Содержание
Физические свойства
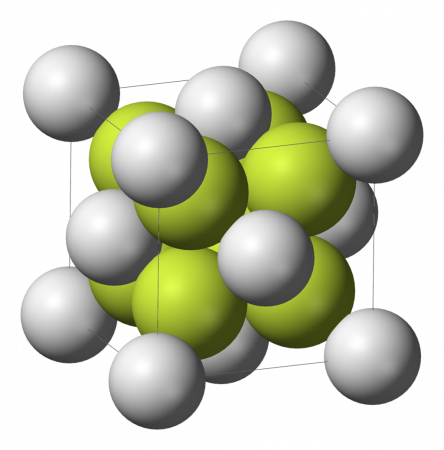
Сульфид лития представляет собой светло-жёлтое [1] или бесцветное кристаллическое вещество [4] , характеризующееся гранецентрированной кубической решёткой типа флюорита [5] (a = 0,571 нм, z = 4, пространственная группа Fm3m [6] ), хорошо растворимое в воде, растворимое в спирте. Не образует кристаллогидратов.
Химические свойства
- Сульфид лития, растворяясь в воде, подвергается гидролизу[1] :


- Водный раствор под действием кислорода воздуха на холоду постепенно окисляется, образуя осадок элементарной серы:

- При действии окислителей (O2, KClO3, PbO2 и пр.) при нагревании свыше 300 °C сульфид лития окисляется до сульфата[1] :
- При нагревании реагирует с хлором (с воспламенением) и бромом[5] :

- С водородом не реагирует даже при высокой температуре [6] .
- Вступает в реакции с разбавленными кислотами с выделением сероводорода:
- Являясь сильным восстановителем, с концентрированными серной и азотной кислотами, сульфид лития вступает в окислительно-восстановительные реакции:
Получение
Одна из потенциальных проблем при получении сульфида лития заключается в легкости его окисления, особенно в присутствии воды. Кроме того, вследствие гидролиза препаративные методы, основанные на реакциях обмена в водных растворах, обычно непригодны.
Так как сульфид лития не встречается в природе в виде минерального сырья, существуют следующие промышленные способы его получения [1] [7] :
- реакция металлического лития с элементарной серой при нагревании выше 130 °C [8] :
- взаимодействие гидрида лития с элементарной серой при температуре 300-350 °C:
- прокаливание оксида или карбоната лития в токе сухого сероводорода при температуре 900-1000 °C:
- восстановление сульфата литиякоксом или водородом при высоких температурах:
Среди прочих возможных методов производства можно отметить [9] :
- взаимодействие гидроксида лития с газообразной серой при температуре до 445 °C:
- взаимодействие гидроксида лития с сероводородом в среде апротонного органического растворителя:
Полисульфиды лития
Для лития, в отличие от других щелочных металлов, полисульфиды не являются характерными соединениями и их получение требует особых условий [10] [5] .
Наиболее изучены [5] :


 |  |
 |  |
Применение
Сульфид лития входит в состав анодов [11] и твёрдого электролита для литиевых элементов питания (батареек и аккумуляторов) [12] . Также используется как депиляционный агент в косметических средствах [13] .
Может использоваться как компонент в производства стёкол с высокой ионной проводимостью [14] .
В современной органической химии сульфид лития иногда используется в качестве сульфидирующего агента, например, в следующей реакции [15] :
Также имеются данные об использовании этого вещества в качестве катализатора при защите гидроксильных групп через получение триметилсилилового эфира [16] .
Опасность для здоровья
Опасность для здоровья сульфида лития определяется как токсичностью ионов лития из-за хорошей растворимости соединения в воде, так и токсичностью сероводорода, образующегося вследствие гидролиза этой соли.
Литий поражает центральную нервную систему, вызывая тремор рук, тошноту, повышенное мочеиспускание, нечленораздельность речи, вялость, сонливость, головокружение, жажду. Эффекты от длительного воздействия — апатия, анорексия, утомляемость, летаргия, мышечная слабость, изменения в ЭКГ. Долговременное токсическое действие вызывает гипотиреоз, лейкоцитоз, отёк и увеличение веса, полидипсию/полиурию, нарушение памяти, конвульсии, почечную недостаточность, шок, гипотонию, сердечные аритмии, кому, смерть [17] .
Сероводород вызывает раздражение слизистых оболочек глаз и дыхательных путей [17] .
Источник
Сульфид лития
| Сульфид лития | |
|---|---|
 | |
| Систематическое наименование | Сульфид лития |
| Хим. формула | Li2S |
| Рац. формула | Li2S |
| Состояние | твёрдое |
| Молярная масса | 46,95 г/моль |
| Плотность | 1,66 |
| Температура | |
| • плавления | 950 |
| • кипения | 1527 °C |
| Энтальпия | |
| • образования | −447 кДж/моль |
| Рег. номер CAS | 12136-58-2 |
| PubChem | 10290727 |
| Рег. номер EINECS | 235-228-1 |
| SMILES | |
| RTECS | OJ6439500 |
| ChemSpider | 8466196 |
| Токсичность | ирритант |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Сульфид лития, сернистый литий — Li2S, неорганическое бинарное соединение, литиевая соль сероводородной кислоты.
Содержание
Физические свойства
Сульфид лития представляет собой светло-жёлтое или бесцветное кристаллическое вещество, характеризующееся гранецентрированной кубической решёткой типа флюорита (a = 0,571 нм, z = 4, пространственная группа Fm3m), хорошо растворимое в воде, растворимое в спирте. Не образует кристаллогидратов.
Основные термодинамические характеристики:
- стандартная энтальпия образования, ΔH o 298 = −447 кДж/моль;
- стандартная энтропия образования, S o 298 = 63 Дж/(моль·K);
- стандартная энергия Гиббса образования, ΔG o 298 = −439 кДж/моль.
Химические свойства
- Сульфид лития, растворяясь в воде, подвергается гидролизу:
Li2S + 8 H2O = 2 [Li(H2O)4] + + S 2− S 2− + H2O ⇆ HS − + HO − Пропуская через водный раствор сероводород, реакцию гидролиза можно сместить вправо: Li2S + H2S = 2 LiHS Образующийся сильно гигроскопичный гидросульфид лития можно выделить в чистом виде.
- Водный раствор под действием кислорода воздуха на холоду постепенно окисляется, образуя осадок элементарной серы:
2 Li2S + 2 H2O + O2 = 2 S↓ + 4 LiOH Во влажном воздухе вещество постепенно окисляется до тиосульфата: 2 Li2S + H2O + 2 O2 = Li2S2O3 + 2 LiOH
- При действии окислителей (O2, KClO3, PbO2 и пр.) при нагревании свыше 300 °C сульфид лития окисляется до сульфата:
Li2S + 2 O2 = Li2SO4
- При нагревании реагирует с хлором (с воспламенением) и бромом:
2 Li2S + 3 Cl2 = 4 LiCl + S2Cl2 Иначе протекает реакция с йодом при температуре около 200 °C: Li2S + I2 = 2 LiI + S
- С водородом не реагирует даже при высокой температуре.
- Вступает в реакции с разбавленными кислотами с выделением сероводорода:
Li2S + 2 HCl = 2 LiCl + H2S↑
- Являясь сильным восстановителем, с концентрированными серной и азотной кислотами, сульфид лития вступает в окислительно-восстановительные реакции:
Li2S + 4 HNO3 = 2 LiNO3 + 2 NO2↑ + S↓ + 2 H2O Li2S + 3 H2SO4 = 2 LiHSO4 + SO2↑ + S↓ + 2 H2O
Получение
Одна из потенциальных проблем при получении сульфида лития заключается в легкости его окисления, особенно в присутствии воды. Кроме того, вследствие гидролиза препаративные методы, основанные на реакциях обмена в водных растворах, обычно непригодны.
Так как сульфид лития не встречается в природе в виде минерального сырья, существуют следующие промышленные способы его получения:
- реакция металлического лития с элементарной серой при нагревании выше 130 °C:
2 Li + S = Li2S
- взаимодействие гидрида лития с элементарной серой при температуре 300-350 °C:
2 LiH + 2 S = Li2S + H2S↑
- прокаливание оксида или карбоната лития в токе сухого сероводорода при температуре 900-1000 °C:
Li2O + H2S = Li2S + H2O↑ Li2CO3 + H2S = Li2S + H2O↑ + CO2↑
- восстановление сульфата лития коксом или водородом при высоких температурах:
Li2SO4 + 4 H2 → 600−700oC Li2S + 4 H2O↑ Li2SO4 + 4 C → 800−900oC Li2S + 4 CO↑
Среди прочих возможных методов производства можно отметить:
- взаимодействие гидроксида лития с газообразной серой при температуре до 445 °C:
2 LiOH + 3 S = Li2S + H2S↑ + SO2↑
- взаимодействие гидроксида лития с сероводородом в среде апротонного органического растворителя:
2 LiOH + H2S = Li2S + 2 H2O
Полисульфиды лития
Для лития, в отличие от других щелочных металлов, полисульфиды не являются характерными соединениями и их получение требует особых условий.
Наиболее изучены:
Li2S2 — дисульфид лития, жёлтый порошок, получаемый кипячением спиртового раствора гидросульфида лития с избытком серы в токе водорода:
Li2S4 — тетрасульфид лития, неустойчивое вещество, получаемое реакцией лития с серой в жидком аммиаке:
| 2 Li + S = Li2S , | Li2S2 + 2 S = Li2S4 |
| Li2S + S = Li2S2 , | Li2S4 + ( x − 4 ) S = Li2Sx |
Применение
Сульфид лития входит в состав анодов и твёрдого электролита для литиевых элементов питания (батареек и аккумуляторов). Также используется как депиляционный агент в косметических средствах.
Может использоваться как компонент в производства стёкол с высокой ионной проводимостью.
В современной органической химии сульфид лития иногда используется в качестве сульфидирующего агента, например, в следующей реакции:
Также имеются данные об использовании этого вещества в качестве катализатора при защите гидроксильных групп через получение триметилсилилового эфира.
Потенциальная опасность для здоровья
Опасность для здоровья сульфида лития Li2S определяется как токсичностью ионов лития (Li + ) из-за хорошей растворимости соединения в воде, так и токсичностью сероводорода, образующегося вследствие гидролиза этой соли.
Литий (в очень больших концентрациях), судя по всему, поражает центральную нервную систему, вызывая тремор рук, тошноту, повышенное мочеиспускание, нечленораздельность речи, вялость, сонливость, головокружение, жажду. Эффекты от длительного воздействия — апатия, анорексия, утомляемость, летаргия, мышечная слабость, изменения в ЭКГ. Долговременное токсическое действие вызывает гипотиреоз, лейкоцитоз, отёк и увеличение веса, полидипсию/полиурию, нарушение памяти, конвульсии, почечную недостаточность, шок, гипотонию, сердечные аритмии, кому, а также — летальный исход.
Сероводород H2S в больших дозах вызывает раздражение слизистых оболочек глаз и дыхательных путей.
Источник



















