- Почему вода полярная молекула? — 2021
- «Ил-2 Штурмовик» нового поколения — «Битва за Сталинград» и «Битва за Москву» #14
- Полярность молекулы воды
- Почему вода является полярным растворителем
- Почему вода не в периодической таблице?
- Почему вода более плотная, чем лед?
- Почему вода в ядерном реакторе светится синим
- Универсальный растворитель – определение и характеристики
- Универсальное определение растворителя
- Характеристики универсального растворителя
- полярность
- Высокая удельная теплоемкость
- Уникальные свойства плотности и температуры
- викторина
- Биологическое значение воды в клетке
- Вода и ее роль в жизнедеятельности клетки
- 6. Биологическая роль воды
- Биологическое значение воды
- Вода. Роль воды в мире. Биологическое значение воды.
- Биологическое значение воды
Почему вода полярная молекула? — 2021
«Ил-2 Штурмовик» нового поколения — «Битва за Сталинград» и «Битва за Москву» #14
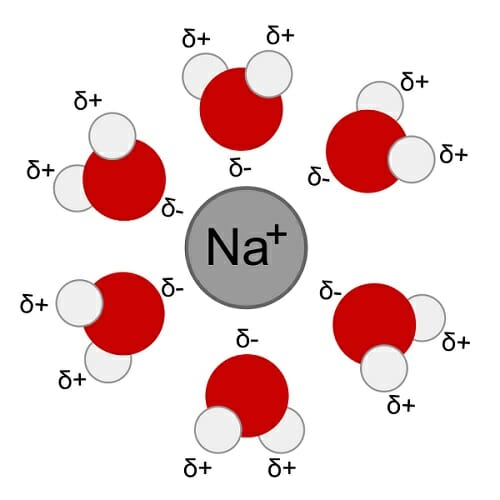
Вода является полярной молекулой, а также действует как полярный растворитель.Когда химическое вещество называется «полярным», это означает, что положительный и отрицательный электрические заряды распределены неравномерно. Положительный заряд исходит от атомного ядра, а электроны поставляют отрицательный заряд. Именно движение электронов определяет полярность. Вот как это работает для воды.
Полярность молекулы воды
Вода (ч2О) является полярным из-за изогнутой формы молекулы. Форма означает большую часть отрицательного заряда от кислорода на стороне молекулы, а положительный заряд атомов водорода находится на другой стороне молекулы. Это пример полярной ковалентной химической связи. Когда растворенные вещества добавляются в воду, они могут зависеть от распределения заряда.
Причина, по которой форма молекулы не является линейной и неполярной (например, как СО2) из-за разницы в электроотрицательности между водородом и кислородом. Значение электроотрицательности водорода равно 2,1, а электроотрицательности кислорода — 3,5. Чем меньше разница между значениями электроотрицательности, тем более вероятно, что атомы образуют ковалентную связь. Большая разница между значениями электроотрицательности наблюдается с ионными связями. Водород и кислород оба действуют как неметаллы в обычных условиях, но кислород несколько более электроотрицателен, чем водород, поэтому два атома образуют ковалентную химическую связь, но она полярна.
Крайне электроотрицательный атом кислорода притягивает к нему электроны или отрицательный заряд, делая область вокруг кислорода более отрицательной, чем области вокруг двух атомов водорода. Электрически положительные части молекулы (атомы водорода) отклоняются от двух заполненных орбиталей кислорода. По сути, оба атома водорода притягиваются к одной и той же стороне атома кислорода, но они настолько далеки друг от друга, насколько могут быть, потому что оба атома водорода несут положительный заряд. Изогнутая конформация — это баланс между притяжением и отталкиванием.
Помните, что хотя ковалентная связь между каждым водородом и кислородом в воде является полярной, молекула воды в целом является электрически нейтральной молекулой. Каждая молекула воды имеет 10 протонов и 10 электронов для суммарного заряда 0.
Почему вода является полярным растворителем
Форма каждой молекулы воды влияет на то, как она взаимодействует с другими молекулами воды и другими веществами. Вода действует как полярный растворитель, потому что она может быть притянута к положительному или отрицательному электрическому заряду растворенного вещества. Небольшой отрицательный заряд вблизи атома кислорода притягивает соседние атомы водорода из воды или положительно заряженных областей других молекул. Слегка положительная водородная сторона каждой молекулы воды притягивает другие атомы кислорода и отрицательно заряженные области других молекул. Водородная связь между водородом одной молекулы воды и кислородом другой удерживает воду вместе и придает ей интересные свойства, однако водородные связи не так прочны, как ковалентные связи. Хотя молекулы воды притягиваются друг к другу посредством водородных связей, около 20% из них в любой момент времени могут свободно взаимодействовать с другими химическими веществами. Это взаимодействие называется гидратацией или растворением.
Почему вода не в периодической таблице?
Вы не найдете воды в периодической таблице элементов. Вот объяснение, почему вода не считается элементом.
Почему вода более плотная, чем лед?
Вода плотнее льда? Вода необычна тем, что ее максимальная плотность проявляется как жидкость, а не как твердое вещество. Это означает, что лед плавает на воде.
Почему вода в ядерном реакторе светится синим
Вода в ядерном реакторе действительно светится синим цветом. Вот объяснение того, как это работает, и определение черенковского излучения.
Источник
Универсальный растворитель – определение и характеристики
Универсальное определение растворителя
Вода это вещество, которое мы называем универсальным растворитель, Растворитель – это просто жидкость, в которой могут растворяться другие вещества, и причина, по которой вода получила ярлык универсального растворителя, заключается в том, что никакой другой растворитель не может растворить столько веществ, сколько может. Это в основном то, что делает его таким важным для жизни на земле. Кроме того, удивительно, что каждый водоем, найденный на земле, включая лед, поддерживает ту или иную форму жизни, которая адаптировалась к температуре и давлению, обнаруженному в этой форме воды.
Тот простой факт, что ученым всегда интересно находить воду, связанную с жизнью, на других планетах, многое говорит об этом, казалось бы, простом веществе. Вода является наиболее распространенным веществом в организмах и клетках. Конечно, есть много очевидных применений для воды, таких как питье, мытье и тушение пожаров, и это благодаря характеристикам, которыми он обладает, которые делают его универсальным растворителем. Вода очень важна для жизни, потому что для многих важных реакций в организме организмов необходима водная среда. Например, вода необходима для переваривания белков в аминокислоты, И в фотосинтез и пищеварение.
Характеристики универсального растворителя
полярность
Это большая часть того, почему вода является универсальным растворителем. Полярность – это неравномерность распределения электронов в молекула, что приводит к одной молекуле, имеющей две противоположные стороны; один отрицательный и один положительный. Теперь вода имеет молекулярную формулу H2O, поэтому каждая молекула воды имеет два атома водорода и один атом кислорода, как вы можете видеть на диаграмме ниже. Атомы водорода не находятся на противоположных сторонах друг друга, и они несут частичный положительный заряд. Это означает, что они создают положительно заряженную часть молекулы, в то время как кислородный конец создает отрицательно заряженную часть. Эта полярность означает, что вода может присоединяться и, следовательно, растворять полярные и ионные (заряженные) вещества.
Высокая удельная теплоемкость
Количество энергии, необходимое для повышения температуры одного грамма воды на 1 градус Цельсия, является ее удельной теплотой, и при одной калории на грамм она намного выше, чем удельная теплоемкость большинства жидкостей. Это хорошая новость для нас, так как мы на 60% состоим из воды, и мы не смогли бы выжить, если бы наши тела сильно и быстро остыли и нагрелись. Это также имеет решающее значение для выживания всех других организмов, в том числе водных организмов. Это означает, что океаны и реки не замерзают постоянно или не испаряются при изменении температуры. Если вода не может стабилизировать свою температуру, энергия, которая выделяется во время обмена веществ в живых организмах, может привести к перегреву и смерти.
Уникальные свойства плотности и температуры
Когда мы помещаем кубик льда в воду, он плавает, и, к счастью, то же самое относится и к айсбергу. Если бы лед был более плотным, чем вода, он бы постоянно замерзал наверху, а затем опускался, пока все водоемы не превратятся в лед, уничтожая всю жизнь. Вода также существует в виде газа, жидкости и твердого вещества в очень небольшом диапазоне температур, что означает, что мы можем найти ее во всех трех формах на Земле в зависимости от того, где мы находимся, и часто в одном и том же месте. Это не часто встречающаяся собственность.
- растворенное вещество – Это вещество, которое растворяется в другом растворителе.
- Ковалентная связь – Распределение электронов между атомами с образованием молекулы.
- Круговорот воды – Процесс циркуляции воды между различными элементами земли – атмосферой, землей и океанами.
- метаболизм – Все химические реакции, происходящие внутри живых организмов.
викторина
1. Вода считается полярной, потому что:A. У этого есть одна отрицательная сторона и другая, которая является положительной.B. Это универсальный растворитель.C. У него два атома водорода.D. Это самый плотный в твердой форме.
Ответ на вопрос № 1
верно. У воды есть сторона, которая немного положительна, и сторона, которая слегка отрицательна.
2. Что из следующего является силой, которая удерживает молекулы воды вместе?A. Ковалентные связи B. Ионные связиC. Полярные связиD. Водородные связи
Ответ на вопрос № 2
D верно. Водородные связи образуются между атомами кислорода и атомами водорода различных молекул воды.
3. Какое свойство относится к слипшимся молекулам воды?A. прилипание B. полярностьC. когезияD. Быть универсальным растворителем
Ответ на вопрос № 3
С верно. Силы сцепления, вызванные водородными связями, делают воду эластичной.
Источник
Биологическое значение воды в клетке
Вода и ее роль в жизнедеятельности клетки
Вода и ее роль в жизнедеятельности клетки
1. Какое строение имеет вода ?
2. Какое количество воды (в %) содержится в различных клетках?
3. Какова роль воды в живых организмах?
Роль воды в клетке.
Вода — одно из самых распространенных веществ на нашей планете. В клетке в количественном отношении она также занимает первое место среди других химических соединений. Чем выше интенсивность обмена веществ в той или иной клетке, тем больше в ней содержится воды.
Вода в клетке находится в двух формах: свободной и связанной. Свободная вода находится в межклеточных пространствах, сосудах, вакуолях, полостях органов. Она служит для переноса веществ из окружающей среды в клетку и наоборот. Связанная вода входит в состав некоторых клеточных структур, находясь между молекулами белка, мембранами, волокнами, и соединена с некоторыми белками .
Вода выполняет различные функции: сохранение объема, упругости клетки . растворение различных веществ. Кроме того, в живых системах большая часть химических реакций протекает в водных растворах.
Вода обладает рядом свойств, имеющих исключительно важное значение для живых организмов.
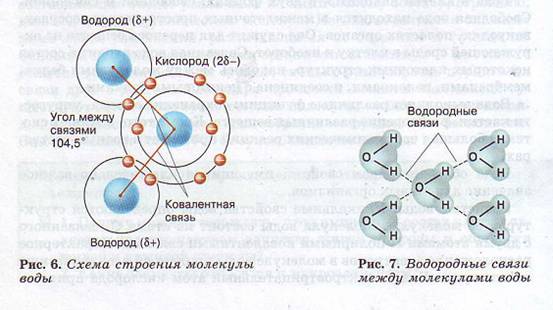
Уникальные свойства воды определяются структурой ее молекулы. Молекула воды состоит из атома О, связанного с двумя атомами Н полярными ковалентными связями. Характерное расположение электронов в молекуле воды придает ей электрическую асимметрию. Более электроотрицательный атом кислорода притягивает электроны атомов водорода сильнее, в результате общие пары электронов смещены в молекуле воды в его сторону.
Поэтому, хотя молекула воды в целом не заряжена, каждый из двух атомов водорода обладает частично положительным зарядом (обозначаемым δ+), а атом кислорода несет частично отрицательный заряд (δ-). Молекула воды поляризована и является диполем (имеет два полюса) (рис. 6).
Частично отрицательный заряд атома кислорода одной молекулы воды притягивается частично положительными атомами водорода других молекул. Таким образом, каждая молекула воды стремится связаться водородной связью с четырьмя соседними молекулами воды (рис. 7).
Вода является хорошим растворителем.
Благодаря полярности молекул и способности образовывать водородные связи вода легко растворяет ионные соединения (соли, кислоты, основания). Хорошо растворяются в воде и некоторые неионные, но полярные соединения, т. е. в молекуле которых присутствуют заряженные (полярные) группы, например сахара, простые спирты, аминокислоты. Вещества, хорошо растворимые в воде, называются гидрофильными (от греч. hygros— влажный и philia — дружба, склонность). Когда вещество переходит в раствор, его молекулы или ионы могут двигаться более свободно и, следовательно, реакционная способность вещества возрастает.
Это объясняет, почему вода является основной средой, в которой протекает большинство химических реакций, а все реакции гидролиза и многочисленные окислительно-восстановительные реакции идут при непосредственном участии воды.
Вещества, плохо или вовсе нерастворимые в воде, называются гидрофобными (от греч.phobos — страх). К ним относятся жиры, нуклеиновые кислоты . некоторые белки. Такие вещества могут образовывать с водой поверхности раздела, на которых протекают многие химические реакции. Следовательно, тот факт, что вода не растворяет неполярные вещества, для живых организмов также очень важен. К числу важных в физиологическом отношении свойств воды относится ее способность растворять газы (О2, С и др.).
Вода обладает высокой теплоемкостью, т. е. способностью поглощать тепловую энергию при минимальном повышении собственной температуры. Большая теплоемкость воды защищает ткани организма от быстрого и сильного повышения температуры. Многие организмы охлаждаются, испаряя воду (транспирация у растений, потоотделение у животных).
Вода обладает также высокой теплопроводностью, обеспечивая равномерное распределение тепла по всему организму. Следовательно, высокая удельная теплоемкость и высокая теплопроводность делают воду идеальной жидкостью для поддержания теплового равновесия клетки и организма.
Вода практически не сжимается, создавая тургорное давление, определяя объем и упругость клеток и тканей. Так, именно гидростатический скелет поддерживает форму у круглых червей, медуз и других организмов.
Вода характеризуется оптимальным для биологических систем значением силы поверхностного натяжения, которое возникает благодаря образованию водородных связей между молекулами воды и молекулами других веществ. Благодаря силе поверхностного натяжения происходит капиллярный кровоток, восходящий и нисходящий токи растворов в растениях.
Гидрофильные и гидрофобные вещества.
1. В чем особенность строения молекулы воды?
2. Каково значение воды как растворителя?
3. Что такое теплопроводность и теплоемкость воды?
4. Почему считают, что вода является идеальной жидкостью для клетки?
5. Какова роль воды в клетке?
6. Какие структурные и физико-химические свойства воды определяют ее биологическую роль в клетке?
Образование кристаллов льда в клетках может приводить к их повреждению и гибели. Известно, что растворы разных веществ замерзают при более низкой температуре, чем чистая вода. Поэтому некоторые организмы накапливают в своих тканях вещества, предотвращающие замерзание и образование кристаллов льда. Так, лягушки способны оживать после вмерзания в лед. Это обеспечивается повышенным содержанием в их клетках глюкозы и некоторых других веществ.
Каменский А. А. Криксунов Е. В. Пасечник В. В. Биология 10 класс
Отправлено читателями с интернет-сайта
Онлайн библиотека с учениками и книгами, плани-конспекти уроковс Биологии 10 класса, книги и учебники согласно календарного плана планирование Биологии 10 класса
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь — Образовательный форум.
6. Биологическая роль воды
Без воды жизнь на нашей планете не могла бы существовать. Вода важна для живых организмов по двум причинам. Во-первых, она является необходимым компонентом живых клеток, и, во-вторых, для многих организмов она служит еще и средой обитания. Именно поэтому следует сказать несколько слов о ее химических и физических свойствах.
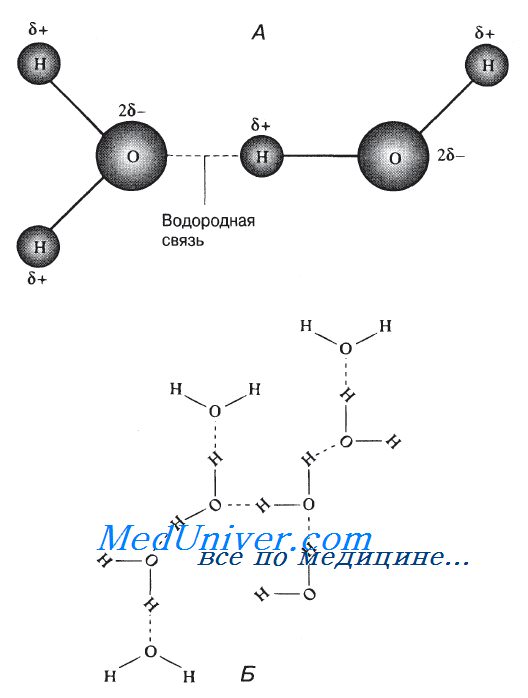
Свойства эти довольно необычны и обусловлены главным образом малыми размерами молекул воды. их полярностью и способностью соединяться друг с другом водородными связями. Под полярностью подразумевают неравномерное распределение зарядов в молекуле. У воды один конец молекулы («полюс») несет небольшой положительный заряд, а другой — отрицательный. Такую молекулу называют диполем. У атома кислорода способность притягивать электроны выражена сильнее, чем у водородных атомов, поэтому атом кислорода в молекуле воды стремится оттянуть к себе электроны двух водородных атомов. Электроны заряжены отрицательно, в связи с чем атом кислорода приобретает небольшой отрицательный заряд, а водородные атомы — положительный.
В результате между молекулами воды возникает слабое электростатическое взаимодействие и, поскольку противоположные заряды притягиваются, молекулы как бы «склеиваются». Эти взаимодействия, более слабые, чем обычные ионные или ковалентные связи, называются водородными связями. Водородные связи постоянно образуются, распадаются и вновь возникают в толще воды. И хотя это слабые связи, но их совокупный эффект обусловливает многие необычные физические свойства воды. Учитывая данную особенность воды, мы можем теперь перейти к рассмотрению тех ее свойств, которые важны с биологической точки зрения.
Водородные связи между молекулами воды. А. Две молекулы воды, соединенные водородной связью-6+ — очень маленький положительный заряд; 6
— очень маленький отрицательный заряд. Б. Сеть из молекул воды, удерживаемых вместе водородными связями. Такие структуры постоянно образуются, распадаются и вновь возникают в воде, находящейся в жидком состоянии.
Биологическое значение воды
Вода как растворитель .Вода — превосходный растворитель для полярных веществ. К ним относятся ионные соединения, такие как соли, содержащие заряженные частицы (ионы), и некоторые неионные соединения, например сахара, в молекуле которых присутствуют полярные (слабо заряженные) группы (у Сахаров это несущая небольшой отрицательный заряд гидроксильная группа, —ОН). Когда вещество растворяется в воде, молекулы воды окружают ионы и полярные группы, отделяя ионы или молекулы друг от друга.
В растворе молекулы или ионы получают возможность двигаться более свободно, так что реакционная способность вещества возрастает. По этой причине в клетке большая часть химических реакций протекает в водных растворах. Неполярные вещества, например липиды, отталкиваются водой и в ее присутствии обычно притягиваются друг к другу, иными словами, неполярные вещества гидрофобны (гидрофобный — водоотталкивающий). Подобные гидрофобные взаимодействия играют важную роль в формировании мембран, а также в определении трехмерной структуры многих белковых молекул, нуклеиновых кислот и других клеточных компонентов.
Присущие воде свойства растворителя означают также, что вода служит средой для транспорта различныхвеществ. Эту роль она выполняет в крови, в лимфатической и экскреторной системах, в пищеварительном тракте и во флоэме и ксилеме растений.
Вода. Роль воды в мире. Биологическое значение воды.
Без воды жизнь на нашей планете не могла бы существовать. Вода важна для живых организмов по двум причинам. Во-первых, она является необходимым компонентом живых клеток, и, во-вторых, для многих организмов она служит еще и средой обитания. Для человека ценность имеет лишь питьевая вода. Для получения питьевой воды используются фильтры для воды. которые позволяют очистить ее от вредных примесей, сделать пригодной для питья и приготовления пищи. Именно поэтому следует сказать несколько слов о ее химических и физических свойствах.
Свойства эти довольно необычны и обусловлены главным образом малыми размерами молекул воды. их полярностью и способностью соединяться друг с другом водородными связями. Под полярностью подразумевают неравномерное распределение зарядов в молекуле. У воды один конец молекулы («полюс») несет небольшой положительный заряд, а другой — отрицательный. Такую молекулу называют диполем. У атома кислорода способность притягивать электроны выражена сильнее, чем у водородных атомов, поэтому атом кислорода в молекуле воды стремится оттянуть к себе электроны двух водородных атомов. Электроны заряжены отрицательно, в связи с чем атом кислорода приобретает небольшой отрицательный заряд, а водородные атомы — положительный.
В результате между молекулами воды возникает слабое электростатическое взаимодействие и, поскольку противоположные заряды притягиваются, молекулы как бы «склеиваются». Эти взаимодействия, более слабые, чем обычные ионные или ковалентные связи, называются водородными связями. Водородные связи постоянно образуются, распадаются и вновь возникают в толще воды. И хотя это слабые связи, но их совокупный эффект обусловливает многие необычные физические свойства воды. Учитывая данную особенность воды, мы можем теперь перейти к рассмотрению тех ее свойств, которые важны с биологической точки зрения.
— очень маленький отрицательный заряд. Б. Сеть из молекул воды, удерживаемых вместе водородными связями. Такие структуры постоянно образуются, распадаются и вновь возникают в воде, находящейся в жидком состоянии.
Биологическое значение воды
Вода как растворитель. Вода — превосходный растворитель для полярных веществ. К ним относятся ионные соединения, такие как соли, содержащие заряженные частицы (ионы), и некоторые неионные соединения, например сахара, в молекуле которых присутствуют полярные (слабо заряженные) группы (у Сахаров это несущая небольшой отрицательный заряд гидроксильная группа, —ОН). Когда вещество растворяется в воде, молекулы воды окружают ионы и полярные группы, отделяя ионы или молекулы друг от друга.
В растворе молекулы или ионы получают возможность двигаться более свободно, так что реакционная способность вещества возрастает. По этой причине в клетке большая часть химических реакций протекает в водных растворах. Неполярные вещества, например липиды, отталкиваются водой и в ее присутствии обычно притягиваются друг к другу, иными словами, неполярные вещества гидрофобны (гидрофобный — водоотталкивающий). Подобные гидрофобные взаимодействия играют важную роль в формировании мембран, а также в определении трехмерной структуры многих белковых молекул, нуклеиновых кислот и других клеточных компонентов.
Присущие воде свойства растворителя означают также, что вода служит средой для транспорта различных веществ. Эту роль она выполняет в крови, в лимфатической и экскреторной системах, в пищеварительном тракте и во флоэме и ксилеме растений.
Источник