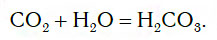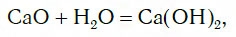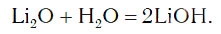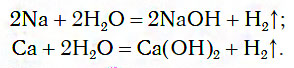- Вода: строение и свойства
- Физические свойства
- Химические свойства
- Урок 28. Химические свойства воды
- Взаимодействие с оксидами неметаллов
- Взаимодействие с оксидами металлов
- Взаимодействие с металлами
- Взаимодействие воды с металлами
- Как они взаимодействуют?
- Пример взаимодействие активных металлов с водой
- СВОЙСТВА МАТЕРИАЛОВ ПРИ ДЕЙСТВИИ ВОДЫ (ГИДРОФИЗИЧЕСКИЕ СВОЙСТВА)
Вода: строение и свойства
Вода — строение молекулы, химические и физические свойства. Взаимодействие с простыми веществами (металлами и неметаллами), и со сложными веществами.
Физические свойства
Молекулы воды связаны водородными связями: nH2O = (Н2O)n, поэтому вода жидкая в отличие от ее газообразных аналогов H2S, H2Se и Н2Те.
Химические свойства
1. Вода реагирует с металлами и неметаллами .
1.1. С активными металлами вода реагирует при комнатной температуре с образованием щелочей и водорода :
2Na + 2H2O → 2NaOH + H2
- с магнием реагирует при кипячении:
- алюминий не реагирует с водой, так как покрыт оксидной плёнкой. Алюминий, очищенный от оксидной плёнки, взаимодействует с водой, образуя гидроксид:
- металлы, расположенные в ряду активности от Al до Н , реагируют с водяным паром при высокой температуре, образуя оксиды и водород:
- металлы, расположенные в ряду активности от после Н , не реагируют с водой:
Ag + Н2O ≠
2. Вода реагирует с оксидами щелочных и щелочноземельных металлов , образуя щелочи (с оксидом магния – при кипячении):
3. Вода взаимодействует с кислотными оксидами (кроме SiO2):
4. Некоторые соли реагируют с с водой. Как правило, в таблице растворимости такие соли отмечены прочерком :
Например , сульфид алюминия разлагается водой:
5. Бинарные соединения металлов и неметаллов , которые не являются кислотами и основаниями, разлагаются водой.
Например , фосфид кальция разлагается водой:
6. Бинарные соединения неметаллов также гидролизуются водой.
Например , фосфид хлора (V) разлагается водой:
6. Некоторые органические вещества гидролизуются водой или вступают в реакции присоединения с водой (алкены, алкины, алкадиены, сложные эфиры и др.).
Источник
Урок 28. Химические свойства воды
В уроке 28 «Химические свойства воды» из курса «Химия для чайников» узнаем о взаимодействии воды с различными веществами.
При обычных условиях вода является достаточно активным веществом по отношению к другим веществам. Это означает, что со многими из них она вступает в химические реакции.
Взаимодействие с оксидами неметаллов
Если струю газообразного оксида углерода(IV) CO2 (углекислого газа) направить в воду, то часть его растворится в ней (рис. 109).
При этом в растворе протекает химическая реакция соединения, в результате которой образуется новое вещество — угольная кислота H2CO3:
На заметку: Собирая углекислый газ над водой, Дж. Пристли обнаружил, что часть газа растворяется в воде и придает ей приятный терпкий вкус. По сути дела, Пристли впервые получил напиток типа газированной, или содовой, воды.
Реакция соединения происходит также, если к воде прибавить твердый оксид фосфора(V) P2O5. При этом протекает химическая реакция с образованием фосфорной кислоты H3PO4 (рис. 110):
Испытаем растворы, полученные при взаимодействии CO2 и P2O5 с водой, индикатором метиловым оранжевым. Для этого прибавим по 1—2 капли раствора индикатора к полученным растворам. Цвет индикатора изменится с оранжевого на красный, что говорит о присутствии кислот в растворах. Значит, при взаимодействии CO2 и P2O5 с водой действительно образовались кислоты H2CO3 и H3PO4.
Оксиды, подобные CO2 и P2O5, которые при взаимодействии с водой образуют кислоты, относят к кислотным оксидам.
Кислотные оксиды — это оксиды, которым соответствуют кислоты.
Некоторые из кислотных оксидов и соответствующих им кислот приведены в таблице 11. Обратите внимание, что это оксиды элементов неметаллов. Как правило, оксиды неметаллов являются кислотными оксидами.
Взаимодействие с оксидами металлов
С оксидами металлов вода реагирует иначе, чем с оксидами неметаллов.
Исследуем взаимодействие оксида кальция CaO с водой. Для этого поместим в стакан с водой небольшое количество CaO и тщательно перемешаем. При этом протекает химическая реакция:
в результате которой образуется новое вещество Ca(OH)2, относящееся к классу оснований. Таким же образом реагируют с водой оксиды лития, натрия. При этом также образуются основания, например:
Подробнее с основаниями вы познакомитесь в следующем уроке. Оксиды металлов, которым соответствуют основания, называют основными оксидами.
Основные оксиды — это оксиды, которым соответствуют основания.
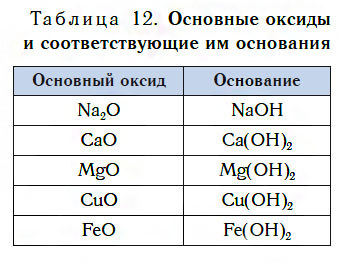
В таблице 12 приведены формулы некоторых основных оксидов и соответствующих им оснований. Заметьте, что, в отличие от кислотных оксидов, в состав основных оксидов входят атомы металлов. Большинство оксидов металлов — это основные оксиды.
Несмотря на то что каждому основному оксиду соответствует основание, не все основные оксиды взаимодействуют с водой, подобно CaO, образуя основания.
Взаимодействие с металлами
При обычных условиях активные металлы (K, Na, Ca, Ba и др.) бурно реагируют с водой:
В этих реакциях выделяется водород и образуются растворимые в воде основания.
Как химически активное вещество вода вступает в реакции со многими другими веществами, но об этом вы узнаете при дальнейшем изучении химии.
Краткие выводы урока:
- Вода — химически активное вещество. Она вступает в реакции с кислотными и основными оксидами, активными металлами.
- При взаимодействии воды с большинством кислотных оксидов образуются соответствующие кислоты.
- Некоторые основные оксиды при реакции с водой образуют растворимые основания.
- При обычных условиях вода реагирует с наиболее активными металлами. При этом образуются растворимые основания и водород.
Надеюсь урок 28 «Химические свойства воды» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Источник
Взаимодействие воды с металлами
Вода обладает разнообразными свойствами. Она может замерзать. Превращаться в пар. С водой человек дружит с рождения. Помимо всего этого она так же может вступать во взаимодействие с металлом. Как? Читайте нашу статью, и Вы узнаете об этом! Вступая в контакт с жидкостью, металлы способны давать самые удивительные реакции! Например: чтобы насытить воду железом её настаивают несколько часов на железе, после чего употребляют во внутрь, а если бросить в стакан с водой щелочной металл то произойдет взрыв. Существует множество разнообразных металлов и каждый случай взаимодействия уникален! Проводите опыты, делайте собственные открытия, а посвятить Вас в основы взаимодействия воды с металлами поможет наша статья!
Как они взаимодействуют?
Взаимодействие металла с водой может происходить по разному, в зависимости от металла и воды. Каждый металл обладает своими неповторимыми особенностями. Так же, может показаться, что формулы очень сложные, однако со временем Вы легко научитесь их читать. Если алюминий, железо вступает в активные реакции с водой, то это значит что в нем присутствуют образующиеся соли. Он окисляется ионами водорода. Проследить это можно по формуле и записать в виде сокращенной формулировки Me + nH + → Me n+ + H2↑
Вступая в реакцию с водой, в исключительных ситуациях образуются гидроксиды. Очень активно в спокойных условиях вступают в реакцию с влагой щелочные металлы, например Литий (Li), натрий (Na) , Калий (К), Рубидий (Rb) , Цезий (Cs), Франций (FR).
Щелочные металлы вступают в очень бурную реакцию с водой. Отследить процесс взаимодействия металлов с водой можно по формулам:
NaH + HCl ® NaCl + H2

Активные металлы способны вступать во взаимодействие с водой при обычных условиях согласно схеме: 2Me + 2nH2O → 2Me(OH)n + nH2 .Итогом окисления как правило становится гидроксид Me(OH)n (где n-степень окисления металла).
Приведем пример: Ca + 2H2O → Ca(OH)2 + H2↑
Металлы же со средней степенью активности вступают во взаимодействие с водой при нагревании по схеме: 2Me + nH2O Me2On + nH2 . Итогом такой реакции становится появление оксида металла. Его формула — Me2On (где n-степень окисления металла) .
Пример взаимодействие активных металлов с водой
Металлы так же используют при изготовлении кухонной утвари. К примеру алюминиевая сковородка, металлический корпус чайника, лопасти блендера. Тут важна стойкость металла. Самой известной реакцией металла на воду является окисление самой обыкновенной стали на воздухе и в воде. Железо в таком случае разрушается, ржавеет. Происходящие при этом процессы являются весьма сложными и удивительным природным процессом. Если же окисление происходит в морской воде, то процесс ускоряется, этому способствует определенная концентрация соли находящаяся в составе воды.
Противостоять образованию ржавчины можно при использовании разнообразных лаков, призванных защитить от коррозии металла и перехитрить химические законы! Так же, вода вступая в реакцию с нагретым металлом способна образовывать накипь.
Это явление можно наблюдать на частях чайника сделанных из алюминия или стали, который давно не чистили. Такой чайник достаточно прокипятить с лимонной кислотой и он снова будет как новый!
Иногда образование накипи не связано с активными металлами, а имеет немного другую природу. В частности, накипь может появляться из-за солей жесткости в воде. В таком случае нужно купить качественный фильтр для жесткой воды.
Источник
СВОЙСТВА МАТЕРИАЛОВ ПРИ ДЕЙСТВИИ ВОДЫ (ГИДРОФИЗИЧЕСКИЕ СВОЙСТВА)



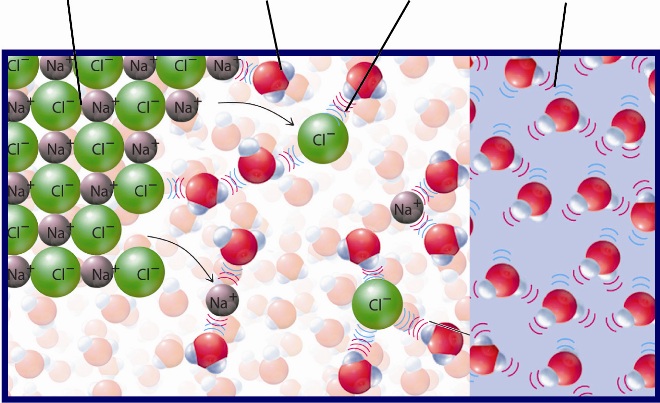
Взаимодействие воды, равно как и других жидкостей, с поверхностями твердых тел проявляется в смачивании, обусловленном силами взаимодействия твердых тел с растворами. Она вызывает растекание жидкости на поверхности и впитывание пористыми телами и порошками. Смачивают твердое тело только те жидкости, которые снижают поверхностное натяжение на границе с воздухом. Способность материала смачиваться водой называется гидрофильностъ, не смачиваться — гидрофобность. В период непосредственного контакта материала с водой его увлажнение происходит благодаря капиллярному всасыванию, диффузии и гидростатическому заполнению водой открытых пор. Свойства, связанные с взаимодействием материалов с водой и жидкостями, называются гидрофизическими.
Водопоглощение — это степень заполнения пор материала водой, характеризуется водопоглощением по массе и по объему:
WМ=(m BH -m C )/ m C *100, % 7
где: m BH – масса образца в водонасыщенном состоянии, г; m C — масса образца в сухом состоянии, г; VО – общий объем образца, см 3 .
Водопоглощение по объему характеризует открытую пористость материала WV=Потк. В отличие от водопоглощения пористость материала всегда меньше 100%. Водопоглощение плотных материалов (сталь, стекло, битум) приближается к 0%. Во время насыщения водой материалы могут существенно менять механические свойства за счет образования адсорбпионно-активной среды и расклинивающего действия растворителя, растворения вещества на контактах сращивания кристаллов, набухания структуры некоторых минералов и т.п.
Влажность — содержание преимущественно конденсатной влаги в виде тонких молекулярных пленок, адсорбированных на стенках пор в материале и определяется отношением массы воды, находящейся в данный момент в материале, к массе (реже к объему) материала в сухом состоянии и вычисляется по формулам 7 и 8. Влажность изменяется от 0%(для абсолютно сухих материалов) до значения полного водопоглощения и зависит от пористости, гигроскопичности и других свойств материала, а также от состояния окружающей среды — относительной влажности, температуры воздуха, контакта материала с водой.
Поскольку свойства сухих и влажных материалов различны, необходимо учитывать как влажность материала, так и его способность к поглощению воды. Во всех случаях — при транспортирования, хранений и применении, строительные материалы предохраняют от увлажнения.
Водостойкость — способность материала сохранять механические свойства в насыщенном водой состоянии (в основном прочность при сжатии) и характеризуется коэффициентом размягчения:
КР = R BH /R C , 0. 1 10
где R BH — предел прочности водонасыщенного образца, МПа;
R C — предел прочности сухого образца, МПа.
Материалы, у которых коэффициент размягчения больше либо равняется 0,75 называют водостойкими. Повышение водостойкости достигается снижением растворимости и пористости материала, его гидрофобизацией или покрытие водостойкими суспензиями.
Морозостойкость — способность материала в насыщенном водой состоянии выдерживать многократное число циклов попеременного замораживания и оттаивания без признаков разрушения и без значительного снижения прочности и массы. Морозостойкость — одна из основных характеристик, описывающая долговечность строительных материалов, эксплуатируемых в конструкциях и сооружениях. При смене температурно-влажностных градиентов некоторые материалы разрушаются. Вода, находясь в порах материала, при замерзания увеличивается в объеме примерно на 9. 10%. Разрушение материала происходит благодаря развитию значительных внутренних напряжений в результате кристаллизационного действия замерзающей воды. Интенсивность разрушения связана с ростом водопоглощения материала через открытую пористость, а также снижением температуры окружающей среды (т.е. с увеличением объема образующегося льда в материале).
Материалы, для которых установлены стандартом испытания, состоящие из попеременного многократного замораживания при температуре не выше -17°С и оттаивания в воде при температуре +20+2°С, и у которых не появляются трещины, расслаивание, выкрошивание и которые теряют не более 25% прочности и 5% массы, считаются морозостойкими.

Критерием морозостойкости строительных материалов является коэффициент морозостойкости КМРЗ= R N / R BH — отношение предела прочности при сжатии материала после N циклов испытаний к пределу прочности при сжатии водонасыщенных образцов, не подвергшихся действию отрицательных температур, в эквивалентном возрасте. Для морозостойких материалов КМРЗ должен быть не менее 0,75.
По морозостойкости, т.е. по числу циклов замораживания и оттаивания, материалы подразделяют на марки: F10, 15, 25, 35, 50, 100, 150, 200, 300, 400, 500. Один цикл испытаний (N) на морозостойкость равен: 4 часа замораживания водонасыщенных образцов при температуре -20+3,°С и 4 часа оттаивания в воде при температуре +20+2,°С. Существует ряд ускоренных методов определения морозостойкости. Например, один цикл ускоренного испытания также равен 8 часам: 4 часа кипячения в насыщенном растворе сернокислого натрия и 4 часа высушивания в сушильном шкафу при температуре +105°С. При высушивании в порах материала образуются кристаллы Na2SO4 создающие кристаллизационное давление в порах материала. Кроме этого кипячение способствует более глубокому проникновению в поры насыщенного раствора после цикла высушивания. При ускоренном испытании на морозостойкость разрушение материала происходит приблизительно в 5 раз быстрее.
Источник