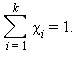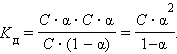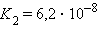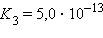Тема 1.4 Вода. Растворы. Электролитическая диссоциация



Растворы – это гомогенные (однофазные) системы переменного состава, состоящие из двух или более веществ (компонентов).
По характеру агрегатного состояния растворы могут быть газообразными, жидкими и твердыми. Обычно компонент, который в данных условиях находится в том же агрегатном состоянии, что и образующийся раствор, считают растворителем, остальные составляющие раствора – растворенными веществами. В случае одинакового агрегатного состояния компонентов растворителем считают тот компонент, который преобладает в растворе.
Движущими силами образования растворов являются энтропийный и энтальпийный факторы. При растворении газов в жидкости энтропия всегда уменьшается ΔS 0). Чем сильнее взаимодействие растворенного вещества и растворителя, тем больше роль энтальпийного фактора в образовании растворов.
Для жидких растворов (расплавов) процесс растворения идет самопроизвольно до установления динамического равновесия между раствором и твердой фазой.
Концентрация насыщенного раствора определяется растворимостью вещества при данной температуре. Растворы с меньшей концентрацией называются ненасыщенными.
Растворимость для различных веществ колеблется в значительных пределах и зависит от их природы, взаимодействия частиц растворенного вещества между собой и с молекулами растворителя, а также от внешних условий (давления, температуры и т. д.)
В химической практике наиболее важны растворы, приготовленные на основе жидкого растворителя. Именно жидкие смеси в химии называют просто растворами. Наиболее широко применяемым неорганическим растворителем является вода. Растворы с другими растворителями называются неводными.
Растворы имеют чрезвычайно большое практическое значение, в них протекают многие химические реакции, в том числе и лежащие в основе обмена веществ в живых организмах.
Важной характеристикой растворов служит их концентрация, которая выражает относительное количество компонентов в растворе. Различают массовые и объемные концентрации, размерные и безразмерные.
К безразмерным концентрациям (долям) относятся следующие концентрации:
Массовая доля растворенного вещества W(B) выражается в долях единицы или в процентах:
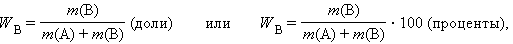 |
где m(B) и m(A) – масса растворенного вещества B и масса растворителя A.
Объемная доля растворенного вещества σ(B) выражается в долях единицы или объемных процентах:
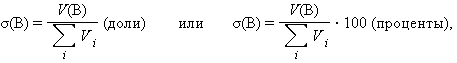 |
где Vi – объем компонента раствора, V(B) – объем растворенного вещества B. Объемные проценты называют градусами *) .
*) Иногда объемная концентрация выражается в тысячных долях (промилле, ‰) или в миллионных долях (млн –1 ), ppm.
Мольная доля растворенного вещества χ(B) выражается соотношением
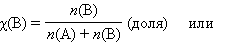 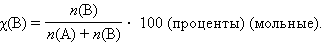 |
Сумма мольных долей k компонентов раствора χi равна единице
К размерным концентрациям относятся следующие концентрации:
Моляльность растворенного вещества Cm(B) определяется количеством вещества n(B) в 1 кг (1000 г) растворителя, размерность моль/кг.
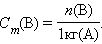 |
Молярная концентрация вещества B в растворе C(B) – содержание количества растворенного вещества B в единице объема раствора, моль/м 3 , или чаще моль/литр:
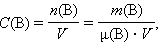 |
где μ(B) – молярная масса B, V – объем раствора.
Молярная концентрация эквивалентов вещества B CЭ(B) (нормальность – устаревш.) определяется числом эквивалентов растворенного вещества в единице объема раствора, моль∙литр –1 :
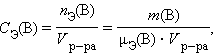 |
где nЭ(B) – количество вещества эквивалентов, μЭ – молярная масса эквивалента.
Титр раствора вещества B(TB) определяется массой растворенного вещества в г, содержащегося в 1 мл раствора:
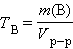 г∙мл –1 или г∙мл –1 или |
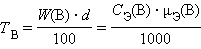 г∙мл –1 . г∙мл –1 . |
Массовые концентрации (массовая доля, процентная, моляльная) не зависят от температуры; объемные концентрации относятся к определенной температуре.
Все вещества в той или иной степени способны растворяться и характеризуются растворимостью. Некоторые вещества неограниченно растворимы друг в друге (вода-ацетон, бензол-толуол, жидкие натрий-калий). Большинство соединений ограниченно растворимы (вода-бензол, вода-бутиловый спирт, вода-поваренная соль), а многие малорастворимы или практически нерастворимы (вода-BaSO4, вода-бензин).

Растворимостью вещества при данных условиях называют его концентрацию в насыщенном растворе. В таком растворе достигается равновесие между растворяемым веществом и раствором. В отсутствие равновесия раствор остается стабильным, если концентрация растворенного вещества меньше его растворимости (ненасыщенный раствор), или нестабильным, если в растворе содержится вещества больше его растворимости (пересыщенный раствор).
Растворение некоторых веществ сопровождается высвобождением или образованием ионов. При этом возможны диссоциативный и ионизационный механизмы. Диссоциативный механизм превалирует при разрушении ионной кристаллической решетки под воздействием сольватирующего растворителя.
Так, ионы, составляющие кристаллическую решетку KCl, приобретают способность проводить электрический ток в любом из двух случаев разрушения кристаллической решетки – под воздействием тепловой энергии (расплав) или под воздействием сольватирующего растворителя (растворение). В последнем случае в раствор переходят готовые ионы, окруженные молекулами растворителя. Процесс взаимодействия ионов кристаллической решетки с молекулами растворителя называется сольватацией.
Ионизационный механизм состоит в том, что в молекулах газообразных, твердых и жидких веществ под воздействием полярных молекул растворителя увеличивается доля ионности настолько, что в раствор могут переходить сольватированные ионы. В зависимости от природы растворителя электролит может быть полностью диссоциирован, либо будет вести себя как слабый электролит:
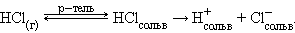 |
В воде равновесие смещено вправо и растворенный хлористый водород диссоциирован полностью. В бензоле растворенный HCl ведет себя как слабый электролит.
Важной характеристикой электролитов служит степень диссоциации α:
|
По величине степени диссоциации электролиты делятся на слабые и сильные. Для сильных электролитов, к которым относятся некоторые минеральные кислоты и щелочи, большинство солей, α > 30 %. К слабым относят некоторые минеральные кислоты (HNO2, HCN, H2SO3), большинство оснований, практически все органические кислоты.
Важнейшей характеристикой слабого электролита служит константа диссоциации.
Рассмотрим равновесную реакцию диссоциации слабого электролита HAn:
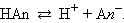 |
Константа равновесия Kр этой реакции и есть Kд:
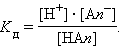 |
Если выразить равновесные концентрации через концентрацию слабого электролита C и его степень диссоциации α, то получим:
|
Это соотношение называют законом разбавления Оствальда. Для очень слабых электролитов при α –5 , 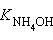
Многоосновные кислоты и многокислотные основания характеризуются соответствующим числом ступенчатых констант диссоциации:
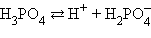 | 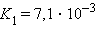 |
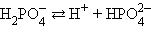 | 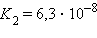 |
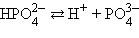 | 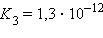 |
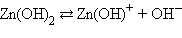 | 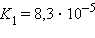 |
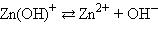 | 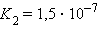 |
Кислоты и основания диссоциируют ступенчато. Каждая ступень диссоциации характеризуется своей константой. Так, трехосновная ортофосфорная кислота H3PO4 диссоциирует следующим образом:
|
Важное значение имеет диссоциация воды, поскольку, являясь слабым электролитом и обычным растворителем, она участвует в кислотно-основном равновесии растворенных в ней электролитов.
Вода диссоциирует на ионы:
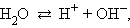 |
ее константа при 298 K равна
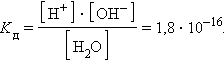 |
При столь малой константе диссоциации концентрация воды остается практически неизменной и равной
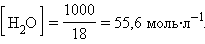 |
Отсюда произведение постоянных величин Kд∙[H2O] = [H + ]∙[OH – ] = const.
Численная величина произведения ионов, на которые диссоциирует вода, называемое ионным произведением воды Kв, равна
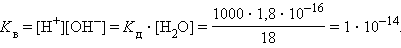 |
Таким образом, в пределах 15–25 °C ионное произведение воды Kв = 10 –14 .
Равенство [H + ] и [OH – ] соответствует нейтральной среде [H + ] = [OH – ] = 1 ∙ 10 –7 , при [H + ] > 1 ∙ 10 –7 – кислой, при [H + ] –7 – щелочной.
Для определения кислотно-основных свойств раствора пользуются водородным показателем pH. По определению, это отрицательный десятичный логарифм концентрации водородных ионов: pH = –lg [H + ].
Очевидно, –lg [H + ][OH – ] = –lg 1 ∙ 10 –14 дает pH + pOH = 14.
Тогда pH 7 соответствует щелочной среде, pH = 7 – нейтральной среде.
Поскольку pH + pOH = 14, можно видеть, что pH может меняться от небольших отрицательных значений до величин, немного превышающих 14 (pH NaOH c C = 2 равен 14,3).
Принципиальное отличие сильных электролитов от слабых состоит в том, что равновесие диссоциации сильных электролитов полностью смещено вправо:
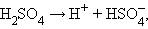 |
а потому константа равновесия (диссоциации) оказывается величиной неопределенной. Снижение электропроводности при увеличении концентрации сильного электролита обусловлено электростатическим взаимодействием ионов.
Дебай и Хюккель, предложив модель, которая легла в основу теории сильных электролитов, постулировали:
1) Электролит полностью диссоциирует, но в сравнительно разбавленных растворах (C = 0,01 моль·л –1 ).
2) Каждый ион окружен оболочкой из ионов противоположного знака. В свою очередь, каждый из этих ионов сольватирован. Это окружение называется ионной атмосферой.
Сильный электролит полностью диссоциирует (α > 30%), но в сравнительно разбавленных растворах (C = 0,01 моль·л–1).
Источник