Тепловые эффекты при растворении различных веществ воде
Раздел 5. РОЗЧИНИ.ТЕОРІЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ
§ 5.3. Тепловые явления при растворении
Растворение веществ сопровождается тепловым эффектом: выделением или поглощением теплоты — в зависимости от природы вещества. Во время растворения в воде, например, гидроксида калия, серной кислоты наблюдается сильное разогревание раствора, т.е. выделение теплоты, а при растворении нитрата аммония — сильное охлаждение раствора, то есть поглощение теплоты. В первом случае осуществляется экзотермический процесс (∆Н 0), во втором — эндотермический (∆Н > 0). Теплота растворения ∆Н — это количество теплоты, которое выделяется или поглощается при растворении 1 моль вещества. Так, для гидроксида калия ∆Н° = -55,65 кДж/моль, а для нитрата аммония ∆ Н = +26,48 кДж/моль.
В результате химического взаимодействия растворенного вещества с растворителем образуются соединения, которые называются сольватами (или гидратами, если растворителем является вода). Образование таких соединений роднит растворы с химическими соединениями.
Великий русский химик Д.И. Менделеев создал химическую теорию растворов, которую он обосновал многочисленными экспериментальными данными, изложенными в его труде “Исследование водных растворов по их удельному весу», опубликованной в 1887 г. “Растворы суть химические соединения, определяемые силами, действующими между растворителем и растворенной веществом”, — писал он. Теперь известна природа этих сил. Сольваты (гидраты) образуются за счет донорно-акцепторного, ион-дипольного взаимодействия, за счет водородных связей, а также взаимодействия дисперсной (в случае растворов родственных веществ, например бензола и толуола). Особенно склонны к гидратации (соединения с водой) ионы. Ионы присоединяют полярные молекулы воды, в результате образуются гидратированные ионы (см. § 5.4); поэтому, например, в растворе ион купруму(II) голубой, а в безводном сульфаті купруму он бесцветный. Многие из таких соединений непрочны и легко разлагаются при выделении их в свободном состоянии, однако в ряде случаев образуются прочные соединения, которые можно легко выделить из раствора кристаллизацией. При этом выпадают кристаллы, содержащие молекулы воды.
Кристаллические вещества, содержащие молекулы воды, называются кристалогідратами, а вода, входящая в состав кристаллогидратов, называется кристалізаційною. Кристалогідратами есть много природных минералов. Ряд веществ (в том числе и органические) добываются в чистом виде только в форме кристаллогидратов. Д.И. Менделеев доказал существование гидратов серной кислоты, а также ряда других веществ .
Следовательно, растворение — не только физический, но и химический процесс. Растворы образуются путем взаимодействия частиц растворенного вещества с частицами растворителя. Ученик Д.И. Менделеева Д.П. Коновалов всегда подчеркивал, что между химическими соединениями и растворами нет границ.
Жидкие растворы занимают промежуточное положение между химическими соединениями постоянного состава и механическими смесями. Как и химические соединения, они однородны и характеризуются тепловыми явлениями, а также концентрацией, что часто наблюдается — уменьшением объема при смешивании жидкостей. С другой стороны, в отличие от химических соединений растворы не подлежат закон постоянства состава. их, как и смеси, можно легко разделить на составляющие части. Процесс растворение — это физико-химический процесс, а растворы — физико-химические системы.
Большое внимание изучению растворов уделял М.В. Ломоносов. Он провел исследование по установлению зависимости растворимости веществ от температуры, изучал явления выделения и поглощения теплоты при растворение и открыл охлаждающие смеси. М.В. Ломоносов впервые установил, что растворы замерзают (кристаллизуются) при более низкой температуре, чем растворитель. Он также дал молекулярно-кинетическое объяснение растворению, близкий к современному, считая, что частицы вещества, растворились, равномерно распределяются среди частиц растворителя.
1 В химических формулах и гидратов кристаллогидратов формулу воды пишут отдельно (через точку), например H 2 SO 4 ∙ Н2О, H 2 SO 4 2Н2О, H 2 SO 4 ∙ 4Н2О, Н2С2О4 ∙ 2Н2 O , N 2 SO 4 ∙ 10 Н2О, Al 2 ( S 04)3 1 8Н2О и др.
Около 40 лет научной работы посвятил изучению растворов Д.И. Менделеев. Его химическая теория растворов оказалась исключительно плодотворной. На ее основе сформировались новые научные дисциплины — такие, как физико-химический анализ, химия комплексных соединений, электрохимия неводных растворов. Ныне эта теория общепризнана.
Значительный вклад в развитие химической теории растворов внесли известные российские ученые Д.П. Коновалов, 1.0. Каблуков, М.С. Курнаков.
Источник
ТЕПЛОВОЙ ЭФФЕКТ РАСТВОРЕНИЯ



Раствором называют гомогенную систему, состоящую из двух или большего числа компонентов. При переходе вещества в раствор происходит разрыв межмолекулярных и ионных связей кристаллической решетки твердого вещества и переход его в раствор в виде отдельных молекул или ионов, которые равномерно распределяются среди молекул растворителя.
Для разрушения кристаллической решетки вещества необходимо затратить большую энергию. Эта энергия освобождается в результате гидратации (сольватации) ионов и молекул, т. е. химического взаимодействия растворяемого вещества с водой (или вообще с растворителем).
Значит, растворимость вещества зависит от разности величин энергии гидратации (сольватации) и энергии кристаллической решетки вещества.
Энергия растворения ∆Нраст — энергия, поглощающаяся (или выделяющаяся) при растворении 1 моль вещества в таком объеме растворителя, дальнейшее прибавление которого не вызывает изменения теплового эффекта.
Общий тепловой эффект растворения зависит от тепловых эффектов:
· а) разрушения кристаллической решетки (процесс всегда идет с затратой энергии ∆Н1>0);
· б) диффузии растворенного вещества в растворителе (затрата энергии ∆Н2>0);
· в) сольватации (гидратации) (выделение теплоты, ∆Н3
Так, при растворении в воде хлорида натрия температура практически не изменяется, при растворении нитрата калия или аммония температура резко снижается, а при растворении гидроксида калия или серной кислоты температура раствора резко повышается.
Растворение твердых веществ в воде чаще бывает процессом эндотермическим, так как во многих случаях при гидратации выделяется теплоты меньше, чем тратится на разрушение кристаллической решетки.
Энергию кристаллической решетки можно рассчитать теоретически. Однако для теоретического расчета энергии сольватации до сих пор нет надежных методов.
Существуют некоторые закономерности, которые связывают растворимость веществ с их составом.
Для солей одного и того же аниона с разными катионами (или наоборот) растворимость будет наименьшей в том случае, когда соль образована ионами одинакового заряда и примерно одинакового размера, т.к. в этом случае энергия ионной кристаллической решетки максимальна.
Например, растворимость сульфатов элементов второй группы периодической системы уменьшается по подгруппе сверху вниз (от магния к барию). Это объясняется тем, что ионы бария и сульфата по размерам больше всего подходят друг к другу. В то время как катионы кальция и магния намного меньше анионов SO4 2- .
Растворимость гидроксидов этих элементов, наоборот, увеличивается от магнию к бария, потому что радиусы катионов магния и анионов гидроксида практически одинаковые, а катионы бария по размеру очень отличаются от небольших анионов гидроксила.

Однако бывают исключения, например, для оксалатов и карбонатов кальция, стронция, бария и др.
Энергию растворения можно рассчитать:
1) используя изменение температуры при растворении.
Количество энергии, выделяющейся при нагревании или охлаждении тела рассчитывается по уравнению (1.2):
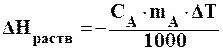
где ∆Нраств. – энергия растворения вещества, кДж/моль;
сА — удельная теплоемкость вещества А, Дж/(г∙К);
m1 — масса вещества А, г;
∆Т – изменение температуры, град.
ПРИМЕР 1.1 При растворении 8г хлорида аммония в 291г воды температура понизилась на 2 0 . Вычислите теплоту растворения NH4C1 в воде, принимая удельную теплоемкость полученного раствора равной теплоемкости воды 4,1870 Дж/(г * К).
Решение:
Используя уравнение (1.2), рассчитаем энергию, поглощаемую 291 г воды при растворении 8г NH4C1, т.к. при этом температура уменьшается на 2 0 С, то: ∆Нраств.= -(4,187∙291∙(-2)) = 2436,8 Дж.
Для определения энтальпии растворения NH4C1 составляем пропорцию, М (NH4C1)=53,49 г/моль:
8г NH4Cl — 2436,8 Дж
53,49г NH4C1 — х Дж
х = 1629,3Дж = 16,3кДж. Следовательно, растворение NH4C1 сопровождается поглощением тепла.
2) используя следствие из закона Гесса: тепловой эффект химической реакции (ΔН 0 х.р.) равен сумме теплот (энтальпий) образования продуктов реакции (ΔH 0 o6р..npoд.) минус сумма теплот (энтальпий) образования исходных веществ (ΔН 0 обр.исх.) с учётом коэффициентов перед формулами этих веществ в уравнении реакции.
ΔН 0 х.р.= ΣΔН 0 обр.прод — Σ ΔН 0 обр.исх , (1.3)
ПРИМЕР 1.2 Рассчитайте тепловой эффект реакции растворения алюминия в разбавленной соляной кислоте, если стандартные теплоты образования реагирующих веществ равны (кДж/моль): ∆Н 0 (НС1) <aq> = — 167,5; ∆Н 0 А1С13<аq>= -672,3.
Решение: Реакция растворения А1 в соляной кислоте протекает по уравнению 2А1+6НС1(aq)=2AlCl3(aq)+3H2. Поскольку алюминий и водород являются простыми веществами, то для них ΔН 0 =0 кДж/моль, то тепловой эффект реакции растворения равен:
Используя следствие из закона Гесса можно определить возможность протекания реакции растворения. В этом случае необходимо рассчитать энергию Гиббса.
ПРИМЕР 1.3 Будет ли растворяться сульфид меди в разбавленной серной кислоте, если энергия Гиббса реагирующих веществ равна (кДж/моль): ∆G 0 (CuS(к))= -48,95; ∆G 0 (H2SО4(aq))=-742,5; ∆G 0 (CuSО4(aq))= -677,5, ∆G 0 (Н2S(г)) = -33,02.
Решение. Для ответа необходимо подсчитать ∆G 0 298 реакции растворения. Возможная реакция растворения CuS в разбавленной H2SO4 протекает по уравнению:
∆G 0 298 = -677,5-33,02 + 742,5 + 48,95 =80,93 кДж/моль.
Так как ∆G>0, реакция невозможна, т. е. CuS не будет растворяться в разбавленной H2SO4.
Зная энергию растворения можно рассчитать энергию присоединения кристаллизационной воды (энергию гидратации).
Теплота гидратации ∆Н 0 гидрат. — теплота, выделяемая при взаимодействии 1 моль растворяемого вещества с растворителем — водой.
ПРИМЕР 1.4. При растворении 52,06г ВаС12 в 400 моль Н2О выделяется 2,16 кДж теплоты, а при растворении 1 моль ВаС12∙2Н2О в 400 моль Н2О поглощается 18,49 кДж теплоты. Вычислите теплоту гидратации безводного ВаС12,
Решение. Процесс растворения безводного ВаС12 можно представить следующим образом:
а) гидратация безводной соли ВаС12
Количество теплоты ∆Н 0 , выделяющееся при растворении безводного ВаС12, равно алгебраической сумме тепловых эффектов этих двух процессов:
∆Н 0 == ∆Н 0 гидр+∆Н 0 раств; ∆Н 0 гидр = ∆Н 0 — ∆Н 0 раств
Для вычисления теплоты гидратации безводного хлорида бария надо определить теплоту растворения ВаС12 для тех же условий, что и для ВаС12∙2Н2О, т. е. для 1 моль ВаС12 (раствор в обоих случаях должен иметь одинаковую концентрацию); M(BaCl2)=208,25 г/моль
52,06г ВаС12 — 2,16кДж
208,25г ВаС12 — х кДж
х=8,64 кДж/моль. Следовательно, ∆Нраств=-8,64 кДж/моль.
Тогда ∆Нгидр=18,49+8,64 =27,13 кДж/моль.
Источник
Тепловые эффекты при растворении веществ
Содержание:
| Предмет: | Химия |
| Тип работы: | Курсовая работа |
| Язык: | Русский |
| Дата добавления: | 11.05.2019 |
- Данный тип работы не является научным трудом, не является готовой выпускной квалификационной работой!
- Данный тип работы представляет собой готовый результат обработки, структурирования и форматирования собранной информации, предназначенной для использования в качестве источника материала для самостоятельной подготовки учебной работы.
Если вам тяжело разобраться в данной теме напишите мне в whatsapp разберём вашу тему, согласуем сроки и я вам помогу!
По этой ссылке вы сможете найти много готовых курсовых работ по химии:
Посмотрите похожие темы возможно они вам могут быть полезны:
Введение:
Как правило, при растворении тепло поглощается или выделяется, а объем раствора изменяется. Это объясняется тем, что при растворении вещества происходит два процесса: разрушение структуры растворяемого вещества и взаимодействие частиц растворителя с частицами растворенного вещества. Оба эти процесса сопровождаются различными изменениями энергии. Энергия требуется для разрушения структуры растворенного вещества, тогда как энергия высвобождается, когда частицы растворителя взаимодействуют с частицами растворенного вещества. В зависимости от соотношения этих тепловых эффектов процесс растворения вещества может быть эндотермическим или экзотермическим. Тепловые эффекты растворения разных веществ различны. Так, когда серная кислота растворяется в воде, выделяется значительное количество тепла, аналогичное явление наблюдается, когда безводный сульфат меди растворяется в воде (экзотермические реакции). Когда нитрат калия или нитрат аммония растворяются в воде, температура раствора резко падает (эндотермические процессы), а когда растворяется хлорид натрия в воде, температура раствора практически не изменяется.
Классификация решений
Растворитель и раствор. Общие свойства истинных решений. Насыщенный, перенасыщенный и ненасыщенный раствор. Методы выражения состава раствора (массовая доля вещества в растворе, молярная концентрация, нормальная концентрация). Физическая теория решений Дж. Вант Хоффа и С. Аррениуса. Химическая теория растворов Д.И.Менделеева. Сольваты, гидраты, кристаллогидраты, кристаллизационная вода. Растворение веществ как физико-химический процесс. Тепловой эффект процесса растворения. Растворимость веществ. Факторы, влияющие на растворимость веществ. Электролиты и неэлектролиты. Теория электролитической диссоциации С. Аррениуса. Степень электролитической диссоциации. Зависимость степени диссоциации от природы электролита, природы растворителя, концентрации и температуры раствора. Кажущаяся степень диссоциации сильных электролитов. Константа электролитической диссоциации. Диссоциация воды. Ионный продукт воды. Водородный показатель. Уравнения ионно-молекулярной реакции. Гидролиз соли. Факторы, влияющие на процесс гидролиза. Степень и константа гидролиза.
Растворение происходит самопроизвольно (DS O и AS 0), поэтому с увеличением температуры их растворимость увеличивается.
Как вы можете объяснить различные значения тепловых эффектов растворения твердых веществ.
Значение AH.idr можно рассчитать, используя известные значения энтальпии других процессов. Итак, растворение ионного соединения может быть представлено в виде двух стадий: разрушения кристаллической решетки на свободные ионы и гидратации ионов. Тогда, согласно закону Гесса, тепловой эффект (энтальпия) растворения DYArasty можно представить в виде алгебраической суммы энергии (энтальпии) разрушения кристаллической решетки AR. и энтальпия гидратации ионов DNahid.
Температура обычно увеличивается с ростом температуры, но есть и обратная зависимость. Влияние температуры зависит от теплового эффекта процесса растворения и от изменения энтропии в этом процессе.
Влияние молекулярной массы полимера на тепловой эффект процесса растворения зависит от физического состояния полимера. Для высокоэластичных полимеров плотность упаковки и, следовательно, энергия межмолекулярных взаимодействий не зависят от молекулярного веса благодаря гибкости макромолекул; следовательно, тепловой эффект растворения одинаков для полимеров с различной длиной цепи. Для стеклообразных полимеров с увеличением молекулярной массы плотность упаковки полимерных цепей уменьшается, полимер становится более рыхлым, энергия межмолекулярного взаимодействия уменьшается, а термический эффект растворения увеличивается.
Теплота растворения (обозначение — D, N °, единицы — J кДж кДж / моль «) является тепловым эффектом процесса растворения вещества при постоянном давлении.
Мы находим противоположную картину для фторидов щелочноземельных металлов. Например, I MgF = 689 ккал, и хотя теплота гидратации превышает эту величину на 10 ккал, то есть составляет 699 ккал, тем не менее фторид магния нерастворим в воде. Объяснение этого неожиданного поведения состоит в том, что энтропия ионов уменьшается по мере того, как они переходят в раствор. Это, в свою очередь, приводит к снижению теплового эффекта процесса растворения (точнее, его абсолютного значения) примерно на 15 ккал, что определяет практически полную нерастворимость этой соли.
Процесс образования гидратов происходит с выделением тепла. Когда вещество, подвергающееся гидратации, растворяется, общий тепловой эффект представляет собой сумму теплового эффекта фактического растворения и теплового эффекта гидратации. Поскольку первый из этих процессов является эндотермическим, а второй — экзотермическим, общий тепловой эффект процесса растворения, равный алгебраической сумме тепловых эффектов отдельных процессов, может быть как положительным, так и отрицательным.
Безводный хлорид алюминия сильно испаряется в воздухе и с шипением растворяется в воде. Объясните причину этих явлений. Рассчитать тепловой эффект процесса растворения хлорида алюминия.
И тепловой эффект гидратации. Поскольку первый из этих процессов является эндотермическим, а второй — экзотермическим, общий тепловой эффект процесса растворения, равный алгебраической сумме тепловых эффектов отдельных процессов, может быть как положительным, так и отрицательным.
В процессе растворения твердого кристаллического вещества энергия, затрачиваемая на разрушение кристаллической решетки, компенсируется выделением энергии взаимодействия молекул или ионов с растворителем. Количественное соотношение расходуемой и выделяемой энергии определяет тепловой эффект процесса растворения. Например, энергия электростатического взаимодействия ионов натрия и хлора в кристалле хлорида натрия очень высока, и для образования свободных ионов при разрушении одного моля Na 1 потребуется энергия, равная 197 000 калорий. Однако из-за выделения теплоты гидратации ионов наблюдается очень небольшой эффект при растворении хлорида натрия.
Для аналогичных веществ (например, для газов с низкой полярностью) растворимость обычно естественным образом уменьшается с увеличением эндотермичности теплового эффекта процесса растворения.
Для большинства физико-химических расчетов необходимо знать теплоемкость веществ, участвующих в процессе, тепловые эффекты процессов растворения, фазовых превращений и химических реакций. Эти значения могут быть измерены экспериментально. При температурах, близких к комиатным (20-50 ° С), широко используется калориметрический метод.
Растворимость твердых веществ зависит от теплового эффекта процесса растворения. Если он является эндотермическим, то при повышении температуры их растворимость увеличивается в соответствии с принципом Ле-Шателье.
В зависимости от соотношения величины этих тепловых эффектов процесс растворения вещества может быть эндо- и экзотермическим.
Процесс образования раствора — растворения — состоит в разрушении взаимодействия молекул отдельных веществ и образовании новых межмолекулярных связей между компонентами раствора.
Количество тепла, поглощаемое или выделяемое при растворении одного моля вещества в избытке растворителя, называется теплотой растворения этого вещества.
Образование раствора — это спонтанный процесс, сопровождающийся уменьшением свободной энергии Гиббса (рост ДГ): Рост DG = рост DH — рост TDS 0. В то же время протекает процесс взаимодействия частиц растворенного вещества с водой с образованием гидратов, сопровождающийся выделением тепла (DHohydr 0) и, самопроизвольно или под внешним воздействием (встряхивание, введение кристаллов), переходят в состояние равновесия (DGrost = 0). В этом случае избыток растворенного вещества выпадает в осадок.
Концентрация решений
Концентрация растворения относится к количеству растворенного вещества, содержащемуся в определенном количестве или в определенном объеме раствора или растворителя.
В химии наиболее часто используются следующие способы выражения концентрации.
Процентная концентрация. Показывает количество граммов растворенного вещества, содержащегося в 100 г раствора. Например, 15% водный раствор соли представляет собой такой раствор, 100 г которого содержит 15 г соли и 85 г воды.
Вывод:
Молярная концентрация (молярность). Показывает количество молей растворенного вещества, содержащегося в 1 литре раствора, обозначенное в моль / л или формуле вещества, заключенной в квадратные скобки. Например, [NaOH] = 2 моль / л представляет собой раствор, содержащий 2 моль (или 80 г) гидроксида натрия в одном литре раствора.
Молярная концентрация эквивалентов. Показывает количество молей растворенных эквивалентов, содержащихся в 1 л раствора, обозначенное Cek. Например, SEC H2SO4 = 0,1 моль экв / л — это раствор H2SO4, содержащий 0,1 моль эквивалентов серной кислоты (или 4,9 г) в 1 л раствора.
Эквивалент (обозначенный буквой E) представляет собой действительную или условную частицу вещества, которая может заменить, добавить, высвободить или каким-либо другим образом эквивалентна одному иону водорода в кислотно-основных или ионообменных реакциях или одному электрону в окислительно-восстановительные реакции.
Кислотный эквивалент равен молярной массе кислоты, деленной на ее основность, то есть на число атомов водорода в молекуле кислоты, которая может быть заменена металлом.
Присылайте задания в любое время дня и ночи в ➔ 
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
Источник







