ТЕТРАГИДРОФУРАН
ТЕТРАГИДРОФУРАН (тетраметиленоксид, ТГФ), мол.м. 72,1; бесцв. жидкость с эфирным запахом; т.пл. — 108,5 °С, т. кип. 65,6-66,0 °С; 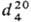
Для тетрагидрофурана характерны р-ции раскрытия цикла под действием разл. агентов, напр.:
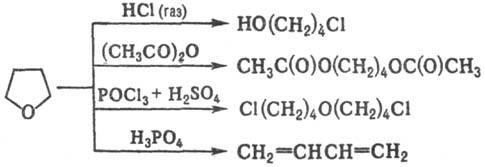
Раскрытие цикла иногда сопровождается полимеризацией, напр.: в присут. SOCl 2 + FeCl 3 при 0-5°С образуется полимер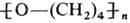
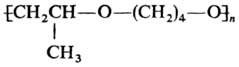
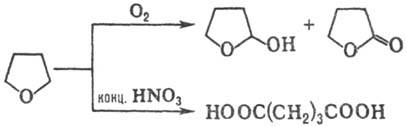
Хлорирование тетрагидрофурана Сl 2 при 0°С или SO 2 Cl 2 при 55-60°С приводит к 2,3-дихлортетрагидрофурану (выход 65-90%). Жидкофазное окисление О 2 воздуха в присут. пероксидов, солей переходных металлов или В 2 О 3 протекает с образованием 2-гидрокситетрагидрофурана (выход 15-17%) и g -бутиролактона (75-80%), окисление тетрагидрофурана конц. HNO 3 -c образованием янтарной к-ты (выход 90%):
При пропускании над А1 2 О 3 в смеси с NH 3 (300-350°C), H 2 S (400-450 °С) или H 2 Se (400 °С) тетрагидрофуран превращ. соотв. в пирролидин, тиофан или селенофан.
Осн. пром. методы получения тетрагидрофурана.
1) Декарбонилирование фурфурола с послед. гидрированием образующегося фурана:
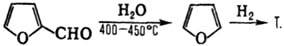
Катализатор первой стадии — Cu(CrO 2 ) 2 или Сu-Аl, Cu-Cr-Al, второй-скелетный Ni с добавками Сr (условия р-ции: 80-160°С, 2-10 МПа), Ni/Cr 2 O 3 (100-180°C, 9-11 МПа, выход 97-99%), реже-Os или Pd.
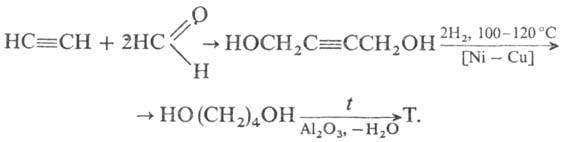
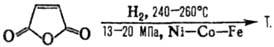
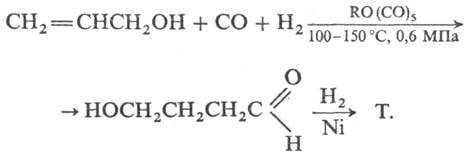
4) Гидрокарбонилирование аллилового спирта с послед. гидрированием промежут. w -гидроксимасляного альдегида:
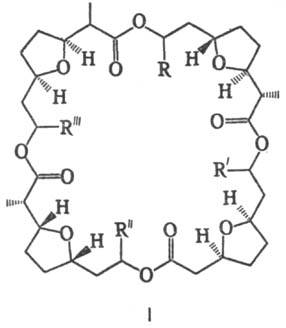
Т етрагидрофуран-р-ритель эфиров целлюлозы, алкидных смол, СК, ПВХ, металлоорг. соед. и др.; сырье для получения синте-тич. смол. Полимеры тетрагидрофурана и его сополимеры с этилен- и про-пиленоксидами-синтетич. смазочные масла, сырье для получения уретановых эластомеров. Тетрагидрофуран-структурный фрагмент нек-рых антибиотиков, в т.ч. нактинов (ф-ла I, R-R : ‘ = = Аlк)-макролидных антибиотиков, продуцируемых акти-номицетами рода Streptomyces, с помощью к-рых. в организме осуществляется транспорт ионов К через клеточные мембраны.
Для тетрагидрофурана т. всп. -20°С, т. воспл. 250 °С, КПВ 1,84-11,8%. Тетрагидрофуран раздражает слизистые оболочки, всасывается через кожу, вызывает у животных поражение печени и почек; ЛД 50 2,3 г/кг (мыши или морские свинки, внутрижелудоч-но); ПДК 100 мг/м 3 .
Лит.: Пономарев А. А., Синтезы и реакции фурановых веществ, Саратов, 1960; Успехи химии фурана, под ред. Э. Я. Лукевица, Рига, 1978; Контактные реакции фурановых соединений, под ред. М. В. Шиманской, Рига, 1985; Plas H. С. van der, Ring transformations of heterocycles, v. 1-2, L.-N. Y., 1973; Pajda E., Kwasnicki Z., Weber K., «Chemik», 1977, t. 30, №. 3, s. 67-73; Chemistry of ethers, crown ether, hydroxy groups and their sulfur analogues, ed. by S. Patai, pt 1-2, Chichester, 1980. P. А. Караханов, В.И. Келарев.
Источник
Тетрагидрофуран — Tetrahydrofuran
- 109-99-9
Y
- ЧЕБИ: 26911
N
- ChEMBL276521
Y
- 7737
Y
- 3N8FZZ6PY4
Y



- 1650 мг / кг (крыса, перорально)
- 2300 мг / кг (мышь, перорально)
- 2300 мг / кг (морская свинка, перорально)
 N проверить ( что есть ?)
N проверить ( что есть ?)  Y
Y  N
NТетрагидрофуран ( THF ) или оксолан представляет собой органическое соединение с формулой (CH 2 ) 4 O. Соединение классифицируется как гетероциклическое соединение , в частности циклический эфир . Это бесцветная, смешивающаяся с водой органическая жидкость с низкой вязкостью . В основном он используется в качестве предшественника полимеров. Будучи полярным и имеющим широкий диапазон жидкостей, ТГФ является универсальным растворителем .
СОДЕРЖАНИЕ
Производство
Ежегодно производится около 200 000 тонн тетрагидрофурана. Наиболее широко используемый промышленный процесс включает катализируемую кислотой дегидратацию 1,4-бутандиола . Ashland / ISP — один из крупнейших производителей этого химического маршрута. Метод аналогичен производству диэтилового эфира из этанола . Бутандиол происходит от конденсации из ацетилена с формальдегидом с последующим гидрированием . Компания DuPont разработала способ производства ТГФ путем окисления н- бутана до неочищенного малеинового ангидрида с последующим каталитическим гидрированием. Третье крупное промышленный маршрут влечет за собой гидроформилирование из аллилового спирта с последующим гидрированием в 1,4-бутандиол .
Другие методы
ТГФ также можно синтезировать каталитическим гидрированием фурана . Это позволяет преобразовывать определенные сахара в ТГФ посредством кислотно-катализируемого переваривания в фурфурол и декарбонилирования в фуран, хотя этот метод не получил широкого распространения. Таким образом, ТГФ получают из возобновляемых источников.
Приложения
Полимеризация
В присутствии сильных кислот THF превращается в линейный полимер, называемый поли (тетраметиленэфир) гликоль (PTMEG), также известный как политетраметиленоксид (PTMO):
Этот полимер в основном используется для изготовления эластомерных полиуретановых волокон, таких как спандекс .
Как растворитель
Другое основное применение ТГФ — это промышленный растворитель для поливинилхлорида (ПВХ) и в лаках . Это апротонный растворитель с диэлектрической проницаемостью 7,6. Это умеренно полярный растворитель, способный растворять широкий спектр неполярных и полярных химических соединений. ТГФ смешивается с водой и может образовывать твердые клатрат-гидратные структуры с водой при низких температурах.
ТГФ был исследован как смешивающийся сорастворитель в водном растворе, способствующий сжижению и делигнификации лигноцеллюлозной биомассы растений для производства возобновляемых платформенных химикатов и сахаров в качестве потенциальных предшественников биотоплива . Водный ТГФ усиливает гидролиз гликанов из биомассы и растворяет большую часть лигнина биомассы, что делает его подходящим растворителем для предварительной обработки биомассы.
THF часто используется в науке о полимерах. Например, его можно использовать для растворения полимеров перед определением их молекулярной массы с помощью гель-проникающей хроматографии . ТГФ также растворяет ПВХ, поэтому он является основным ингредиентом клеев для ПВХ. Его можно использовать для разжижения старого ПВХ-цемента и часто в промышленности для обезжиривания металлических деталей.
ТГФ используется в качестве компонента подвижных фаз для обращенно-фазовой жидкостной хроматографии . Он обладает большей силой элюирования, чем метанол или ацетонитрил , но используется реже, чем эти растворители.
THF используется в качестве растворителя в 3D-печати при использовании пластиков PLA . Его можно использовать для очистки засоренных деталей 3D-принтера, а также при отделке отпечатков для удаления линий экструдера и придания блеска готовому изделию. В последнее время ТГФ используется в качестве сорастворителя для литий-металлических батарей, помогая стабилизировать металлический анод.
Лабораторное использование
В лаборатории ТГФ является популярным растворителем, когда его смешиваемость с водой не является проблемой. Он более основной, чем диэтиловый эфир, и образует более прочные комплексы с Li + , Mg 2+ и боранами . Это популярный растворитель для реакций гидроборирования и для металлоорганических соединений, таких как литийорганический реагент и реактивы Гриньяра . Таким образом, хотя диэтиловый эфир остается предпочтительным растворителем для некоторых реакций (например, реакций Гриньяра), ТГФ выполняет эту роль во многих других, где желательна сильная координация и точные свойства эфирных растворителей, таких как эти (по отдельности и в смесях и при различные температуры) позволяет точно настраивать современные химические реакции.
Коммерческий ТГФ содержит значительное количество воды, которую необходимо удалять для ответственных операций, например операций, связанных с металлоорганическими соединениями . Хотя ТГФ традиционно сушат перегонкой из агрессивного осушителя , молекулярные сита лучше.
Реакция с сероводородом
Основность Льюиса
ТГФ представляет собой основание Льюиса, которое связывается с различными кислотами Льюиса, такими как I 2 , фенолы , триэтилалюминий и бис (гексафлорацетилацетонато) медь (II) . THF был классифицирован в модели ECW, и было показано, что не существует одного порядка основных сильных сторон. Многие комплексы имеют стехиометрию MCl 3 (THF) 3 .
Меры предосторожности
ТГФ является относительно нетоксичным растворителем со средней смертельной дозой (LD 50 ), сравнимой с таковой для ацетона . Обладая замечательными растворяющими свойствами, он проникает в кожу, вызывая быстрое обезвоживание. ТГФ легко растворяет латекс, поэтому с ним следует обращаться в перчатках из нитрилового каучука . Он легко воспламеняется.
Одной из опасностей, связанных с ТГФ, является его склонность образовывать взрывчатое соединение 2-гидроперокситетрагидрофуран при реакции с воздухом:
Чтобы свести к минимуму эту проблему, коммерческие поставки THF часто стабилизируют бутилированным гидрокситолуолом (BHT). Перегонка ТГФ досуха небезопасна, поскольку взрывоопасные пероксиды могут концентрироваться в остатке.
Источник








