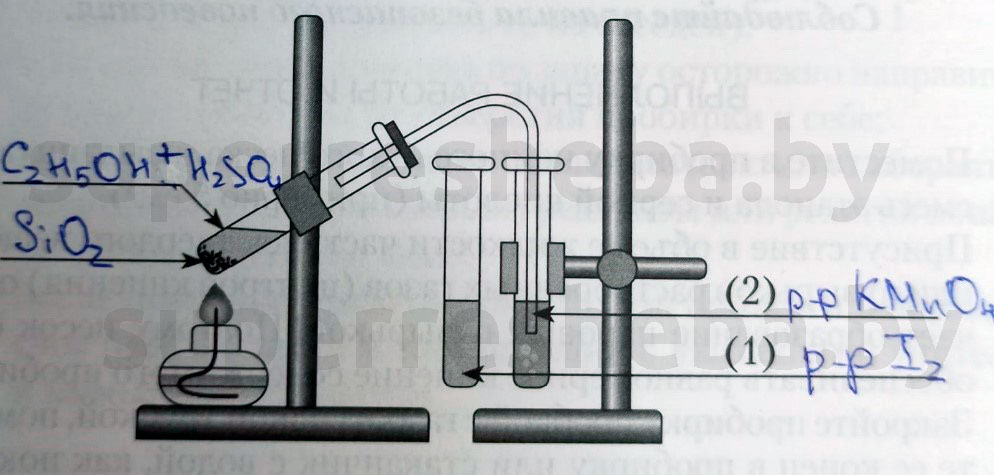
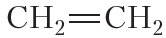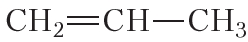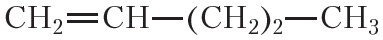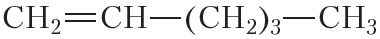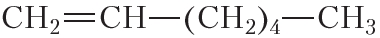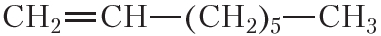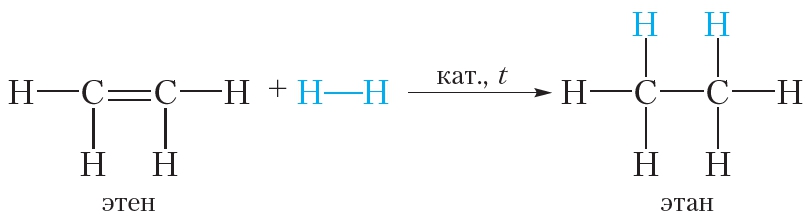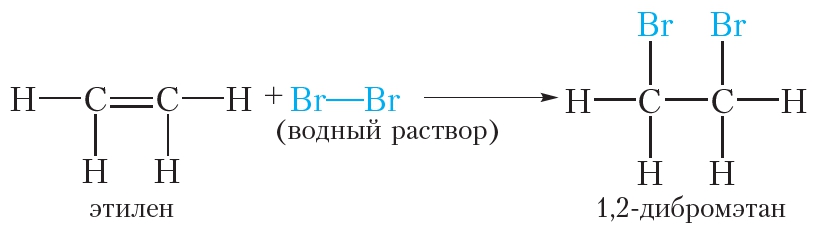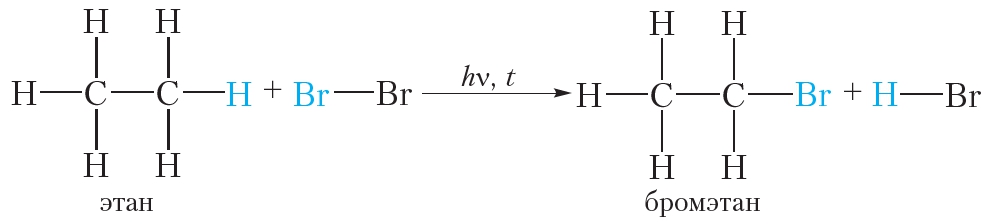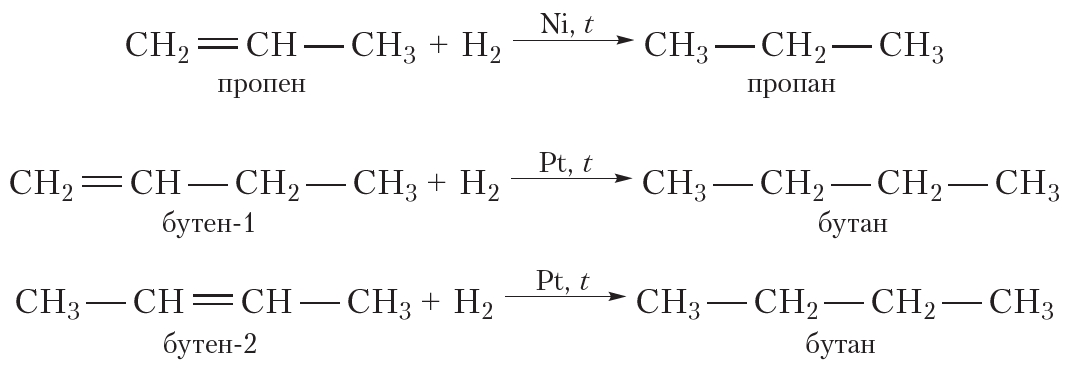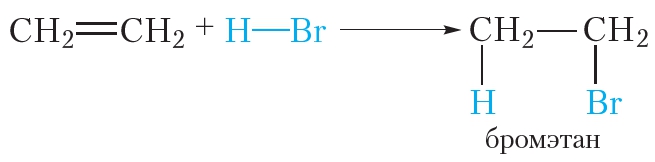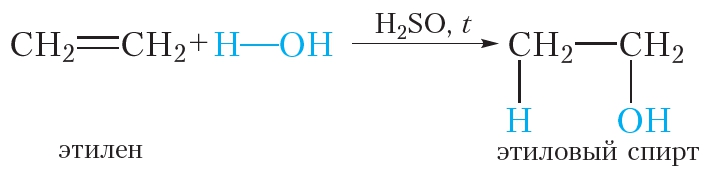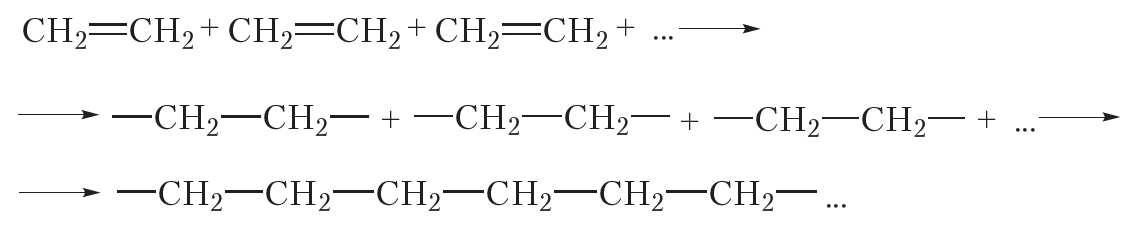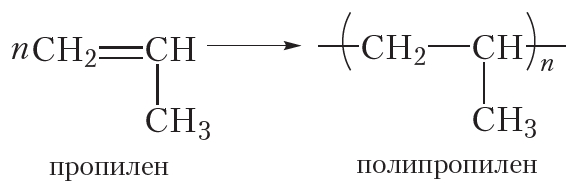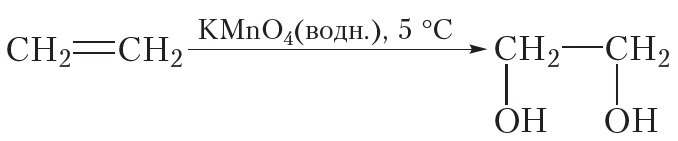Практ. 1
Напишите над стрелками формулы или названия веществ в пробирках.
Объясните явления, которые наблюдаются в процессе получения этилена.
В процессе получения мы наблюдали появление пузырьков газа и обесцвечивание растворов иода и перманганата калия. (Причины обесцвечивания приведены далее).
Приведите уравнение реакции получения этилена.
+ ° C 2 H 4 ↑ + H 2 O .
Объясните явления, наблюдаемые при пропускании этилена в пробирки с растворами иода (1) и перманганата калия (2).
В процессе получения этилена мы наблюдали обесцвечивание растворов иода и перманганата калия, потому что образовывались бесцветные продукты реакции. Раствор перманганата обесцвечивался, т.к. в ходе реакции перманганат переходил в щелочь и оксид марганца (IV), а раствора иода – потому что молекулы иода встраивались в молекулу этилена.
Приведите уравнения реакции этилена с раствором иода.
Приведите схему реакции этилена с раствором K M n O 4 \mathrm
Приведите уравнение реакции горения этилена.
1. Напишите, благодаря наличию какого структурного фрагмента в молекулах алкенов они вступают в реакции с иодной и бромной водой. К какому типу относятся данные реакции?
Алкены вступают в реакции с иодной и бромной водой благодаря наличию двойной связи. Эти реакции относятся к реакциям присоединения.
2. В каких условиях реагируют с бромом алканы? К какому типу относится реакция алканов с бромом?
Алканы реагируют с бромом на свету. Это реакция замещения.
3. Сравните отношение к бромной воде алканов и алкенов. Можно ли различить этан и этен при помощи бромной воды?
Да, можно. При пропускании этана через бромную воду раствор брома не будет обесцвечиваться, а при пропускании этена — будет.
Источник
§ 15. Физические и химические свойства алкенов
| Сайт: | Профильное обучение |
| Курс: | Химия. 10 класс |
| Книга: | § 15. Физические и химические свойства алкенов |
| Напечатано:: | Гость |
| Дата: | Пятница, 22 Октябрь 2021, 03:22 |
Оглавление
Физические свойства
По физическим свойствам алкены мало отличаются от алканов с тем же числом атомов углерода в молекуле. Так, алкены с числом атомов углерода в молекуле 2—4 при комнатной температуре являются бесцветными газами. Алкены с числом атомов углерода в молекуле от 5 до 17 — жидкости. Алкены с ещё бóльшим числом атомов углерода в молекуле (от 18 и более) представляют собой твёрдые вещества. Температуры кипения некоторых алкенов неразветвлённого строения приведены в таблице 15.1.
Таблица 15.1. Температуры кипения алкенов
Температура кипения (tкип, °С)
Так же, как и алканы, алкены нерастворимы в воде, но хорошо растворяются в органических растворителях.
Плотность алкенов меньше, чем у воды.
Химические свойства
Благодаря наличию в молекуле π-связи реакционная способность алкенов намного выше, чем у алканов. Напомним, что для алканов характерны реакции замещения. Для алкенов характерными являются реакции присоединения:
Эти реакции сопровождаются разрывом π-связи, так как она менее прочная, чем σ-связь.
В реакции присоединения алкены вступают в более мягких условиях, чем алканы в реакции замещения. Реакции замещения для алкенов нехарактерны.
Реакции присоединения
1. Галогенирование. Присоединение галогенов
Алкены так же, как и алканы, взаимодействуют с галогенами. Однако в случае алкенов происходит реакция присоединения, а не замещения. Сравним эти реакции.
Бромирование этилена (реакция присоединения ):
Бромирование этана (реакция замещения ):
Этилен реагирует с водным раствором брома (бромной водой) при обычных условиях, в то время как реакция этана с бромом возможна только в жёстких условиях — при нагревании или ультрафиолетовом облучении.
При пропускании этилена через бромную воду протекает реакция присоединения брома по двойной связи. В результате оранжевый раствор брома обесцвечивается.
В молекуле этана нет двойных связей, поэтому при пропускании этана через бромную воду химическая реакция не протекает и раствор брома остаётся оранжевым.
Следовательно, реакция с бромной водой является качественной реакцией на двойную связь.
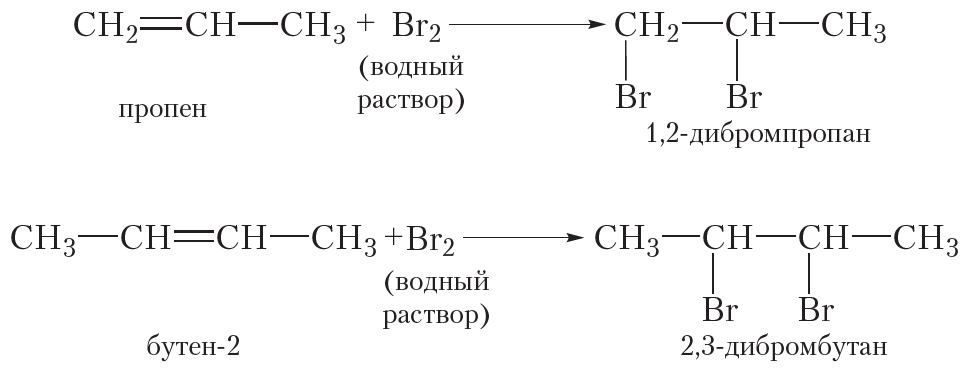
Подобно этилену, другие алкены легко присоединяют бром, обесцвечивая бромную воду:
2. Гидрирование. Присоединение водорода
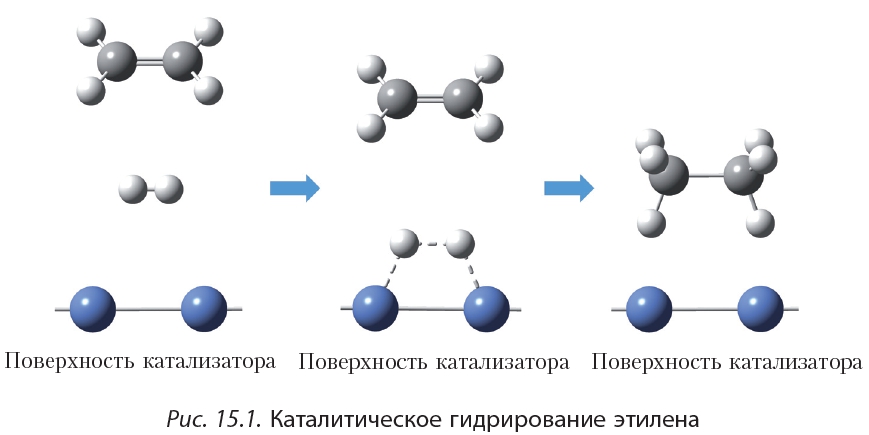
Присоединение водорода к органическому веществу называется реакцией гидрирования. При обычных условиях алкены не присоединяют водород. Для протекания реакции необходим катализатор (Pt или Ni).
В результате гидрирования алкенов образуются алканы. В начале данного параграфа приведено уравнение реакции гидрирования этена. Приведём уравнения реакций гидрирования некоторых других алкенов:
Как вы уже знаете, катализатор ускоряет протекание химической реакции, но сам при этом не расходуется. Роль катализатора в реакции гидрирования заключается в том, чтобы ослабить химическую связь в молекуле водорода и, таким образом, активировать эту молекулу для реакции присоединения:
3. Гидрогалогенирование. Присоединение галогеноводородов
Алкены могут вступать в реакции присоединения не только с простыми, но и со сложными веществами. Например, этилен легко присоединяет бромоводород:
Реакции присоединения галогеноводородов к органическим веществам называются реакциями гидрогалогенирования. Эти реакции протекают при обычных условиях.
4. Гидратация. Присоединение воды
Гидратацией называется реакция присоединения воды к органическому веществу. При нагревании в присутствии катализатора (H2SO4) этилен присоединяет воду. При этом образуется этиловый спирт:
Реакция полимеризации
За счёт раскрытия двойных связей отдельные молекулы этилена могут соединяться друг с другом, образуя длинные цепи. Схематично этот процесс можно изобразить так:
В результате соединения сотен или даже тысяч молекул этилена образуется одна гигантская молекула — полимер. Протекающая реакция называется реакцией полимеризации.
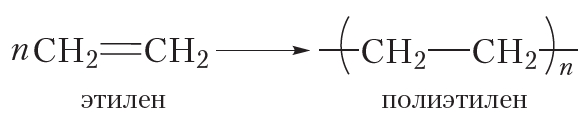
Более кратко процесс полимеризации этилена можно выразить следующим уравнением:
Полимеризоваться могут и другие алкены, в частности пропилен:
Исходное вещество в реакции полимеризации называется мономером, а продукт — полимером. Молекулы полимера также называют макромолекулами.
Число мономерных звеньев в молекуле полимера называется степенью полимеризации. В формуле полимера степень полимеризации обозначают индексом «n».
Полиэтилен и полипропилен нам хорошо знакомы. Из полиэтилена изготавливают полиэтиленовую плёнку, посуду, предметы домашнего обихода и т. д. Полипропилен очень похож на полиэтилен и отличается от него только повышенной прочностью и термостойкостью. Из полипропилена изготавливают плёнку для теплиц, корпуса автомобильных аккумуляторов и многое другое. Со многими полимерами вы познакомитесь далее.
Реакции окисления
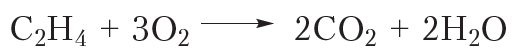
1. Горение. Взаимодействие с кислородом
Так же, как и алканы, алкены горят с образованием углекислого газа и воды:
Приведём уравнение реакции горения алкенов в общем виде:
2. Неполное окисление. Реакция с KMnO4
Окисление алкенов может протекать и без разрушения углеродного скелета. Так, при пропускании этилена через разбавленный водный раствор перманганата калия (KMnO4) фиолетового цвета окраска исчезает. Перманганат калия расщепляет π-связь в молекуле этилена, при этом σ-связь между атомами углерода сохраняется. Протекание этой реакции отобразим не с помощью уравнения, а упрощённо в виде схемы. Схема реакции окисления этилена водным раствором перманганата калия выглядит следующим образом:
Из схемы видно, что π-связь в ходе данной реакции раскрывается, к атомам углерода присоединяются две кислородсодержащие группы — OH , то есть этилен окисляется. В результате образуется этиленгликоль, представитель многоатомных спиртов.
Написание схем часто оказывается более удобным, чем уравнений, поэтому их широко используют в органической химии.
Так же, как и реакция с бромной водой, реакция с раствором перманганата калия является качественной реакцией на двойную связь. В результате данной реакции наблюдается обесцвечивание фиолетового раствора перманганата калия.
Характерными для алкенов являются реакции присоединения по двойной связи. При этом происходит расщепление π -связи. Алкены могут присоединять галогены, водород, галогеноводороды, воду.
Реакция полимеризации — это многократно повторяющаяся реакция присоединения. В результате этой реакции образуются гигантские молекулы полимеров, широко применяемых в нашей жизни.
Низкомолекулярное вещество, из которого синтезируют полимер, называется мономером; число мономерных звеньев в макромолекуле полимера называется степенью полимеризации.
Реакции обесцвечивания бромной воды и раствора перманганата калия являются качественными реакциями на двойную связь.
Вопросы и задания
1. Напишите уравнения реакций присоединения к этилену и пропилену: а) водорода; б) хлора. Назовите продукты реакций. Как на практике можно различить метан и этилен?
2. Напишите уравнение реакции бромоводорода с бутеном-2 . Назовите продукт реакции.
3. К бромной воде добавили избыток раствора гексена-1 в гептане. Какие явления будут наблюдаться при этом? Напишите уравнение протекающей реакции.
4. Напишите схему реакции взаимодействия пропилена с водным раствором перманганата калия.
5. В результате полимеризации этилена получен полимер массой 140 г, содержащий 1,505 ∙ 10 22 макромолекул. Вычислите: а) среднюю молярную массу полимера; б) степень полимеризации.
6. После пропускания через склянку с бромной водой (избыток) 20 дм 3 (н. у.) смеси этана и этилена масса склянки увеличилась на 20 г. Определите объём (н. у.) этана в смеси газов.
7*. Напишите схемы реакций, с помощью которых можно получить 2,2,3,3-тетраметилбутан из 2-метилбутена .

Источник
Урок — лабораторная работа по химии на тему «Получение этилена и изучение его свойств»
Лабораторная работа № 3. Получение этилена и изучение его свойств.
Научиться получать этилен в лаборатории путём нагревания смеси этилового спирта с концентрированной серной кислотой и проводить качественные реакции на непредельные углеводороды этиленового ряда, изучить свойства этилена.
Реактивы и оборудование:
Прибор для получения газов, водный раствор перманганата калия, раствор брома в воде (бромная вода), реакционная смесь этилового спирта и серной концентрированной кислоты (1:3), спиртовка, спички.
1. Получение этилена дегидратацией этилового спирта.
Получите готовую реакционную смесь у учителя. Соберите прибор для получения газов.
В пробирку налейте 2-3 мл этилового спирта и осторожно добавьте 6-9 мл концентрированной серной кислоты. Затем всыпьте немного прокаленного песка (песок или мелкие кусочки пемзы вводят для того, чтобы предотвратить толчки жидкости при кипении). Закройте пробирку пробкой с газоотводной трубкой, закрепите ее в штативе и осторожно нагрейте содержимое пробирки (рис.53). Что вы наблюдаете?
Осторожно, равномерно нагрейте смесь.
Соблюдайте осторожность. Вы работаете с концентрированной серной кислотой.
2. Окисление этилена кислородом перманганата калия
В другую пробирку налейте 2-3 мл разбавленного раствора перманганата калия, и пропустите через него газ. Что при этом наблюдаете?
3. Взаимодействие этилена с бромной водой.
В третью пробирку налейте 2-3 мл бромной воды , опустите газоотводную трубку до дна этой пробирки и пропустите через бромную воду выделяющийся газ. Что вы наблюдаете?
4. Окисление этилена кислородом воздуха (горение) Вынув газоотводную трубку из раствора и повернув ее отверстием кверху, подожгите выделяющийся газ. Каким пламенем горит этилен? Почему?
5. Оформите работу в тетради в виде таблицы:
Название опыта
Что делали. Ваши наблюдения
Уравнение реакции, выводы
1. Получение этилена дегидратацией этилового спирта.
Какой газ выделяется?
Закончите уравнение реакции:
Каким способом в лаборатории получают этилен?
Какую роль при этом играет серная кислота?
2. Окисление этилена кислородом перманганата калия.
Что происходит с раствором марганцовки?
Закончите уравнение реакции:
О чем свидетельствует изменение окраски раствора перманганата калия?
3. Взаимодействие этилена с бромной водой.
Что происходит с бромной водой?
Закончите уравнение реакции:
О чем свидетельствует изменение окраски раствора бромной воды?
4. Окисление этилена кислородом воздуха (горение).
Почему этилен горит более светящимся пламенем, чем метан?
Закончите уравнение реакции:
Что можно сказать о содержании углерода в этилене?
6. Общий вывод о проделанной работе: (из цели)
При взаимодействии этилена с бромной водой, красно-бурый раствор бромной воды обесцвечивается. Эта реакция является качественной на двойную связь.
При окислении этилена водным раствором перманганата калия образуется этиленгликоль. Заметно, что фиолетовая окраска раствора исчезает. Реакция является качественной на двойную связь.
В отличие от метана этилен горит светящимся пламенем, что обусловливается повышенным содержанием углерода
Урок химии проведённый в 10 классе с использованием компьютерных
Тема : «Получение этилена и опыты с ним.»
Цели урока : знать свойства этилена, способы его получения ,правила техники безопасности. Уметь получать этилен в лабораторных условиях, доказывать его наличие, подтверждая химическими реакциями, пользоваться химическим оборудованием и реактивами; продолжить работу по воспитанию патриотических чувств, гордость за достижения отечественной науки.
Оборудование: металлический штатив ,спиртовка ,спички, лучинка, штатив с пробирками, прибор для получения газа, ученические тетради ,ПК с мультимедийный проектором, CD «Виртуальная химия», презентация, инструктивные карточки.
Реактивы: этиловый спирт ,серная кислота –концентрированная, раствор перманганата калия, йодная вода, песок прокалённый.
Тип урока: практическая работа.
Организационная форма урока: комбинированный ( исследовательская работа)
Предварительно учащиеся получают домашнее задание, связанное с изучением содержания предстоящей практической работой. Для подготовки к работе необходимо использовать материал учебника 10- класса автор О.С. Габриелян (п.12); подготовить сообщение о учёном химике Е.Е. Вагнере.
1. Организационный момент. 2. Основная часть:
2. 1.Первый слайд презентации.(Сообщение темы урока, учащиеся из темы формулируют цель урока. Разбираем правила технике безопасности.
Учащиеся делаю запись темы, цели оборудования и реактивов в тетрадь.)
2.2.На основе полученной карточке приступают к практической части.
2.3.Проделав практическую часть оформляют полученные данные в тетради на основе карточки- инструкции( карточка инструкция прилагается)
2.4 Ребята вы проделали практическую работу в реальном времени ,а давайте сейчас посмотрим эту работу виртуально ( C D диск «Виртуальная химия» Получение этилена и изучение его свойств. ) сравнение результатов
2.5.Второй слайд презентации (использование этилена.)
2.6 Сообщение ученицы «Работы И.И. Вагнера» (сообщение прилагается)
3.Подведение итогов: Делаем вывод о проделанной работе, исходя из цели.
Озвучивание результатов работы учащихся
Уборка рабочего места. Сдача тетрадей на проверку.
4. Третий слайд презентации( домашнее задание)
Егор Егорович Вагнер — родился в Казани в 1849 г. Первоначальное образование получил в частном пансионе в Лифляндии. В 1867 г. поступил в казанский университет, оставался 2 года на юридическом факультете, а затем перешел на физико-математический, который и окончил в 1874 г. со степенью кандидата. Через год был командирован в Петербург, где работал в лаборатории профессора А. М. Бутлерова. С 1882 г. по 1886 г. занимал кафедру химии в институте сельского хозяйства в Новой Александрии, а с 1886 г. ту же кафедру в варшавском университете. Его научная деятельность относится к вопросам органической химии. Один из наиболее выдающихся «химических внуков» А. М. Бутлерова, родоначальника целой школы русских химиков «структуристов». В первых своих работах рассматривал те вопросы, которые наметились общим направлением Бутлеровской школы. Однако, в своих позднейших исследованиях и, главным образом, в большом труде «О реакции окисления кетонов» и затем в работах «Об окислении непредельных соединений» и «Об окислении третичных спиртов», выдвинул на первый план вопрос о зависимости продуктов данной химической реакции от условий, в которых эта реакция происходит, и таким образом перешел к вопросам, имеющим важное значение в химической механике.
Имя Вагнера одно из выдающихся не только среди русских химиков, но и среди химиков других стран. Его диссертация «Синтез вторичных спиртов и их окисление» (1885) и докторская «К реакции окисления непредельных углеродистых соединений» (1888), из которых первая представляет свод целого ряда работ, начиная с 1874 г., являются классическими трудами и дают ряд блестящих, исчерпывающих затронутые вопросы страниц органической химии. Непосредственно вслед за этими работами он перешел к исследованию химического строения терпенов, одной из труднейших задач современной органической химии, долго не поддававшейся решению, несмотря на то, что над нею работали даже такие крупные научные силы, как Флавицкий, Канонников, Валлах, Бэйер, Бредт и др. Благодаря своему замечательному дару сразу находить верные пути исследования и воспользовавшись ранее им же разработанным методом окисления непредельных соединений марганцовокалиевой солью, он очень скоро, уже в 1894 г., успел разъяснить строение терпинеола, терпина, лимонена, карвона и дигидрокарвеола, благодаря чему «совершенно просто развязывался основной узел химического вопроса». В последующие годы ему при содействии его многочисленных учеников, работавших под непосредственным его руководством, удалось выяснить взаимные отношения между собою пинена, камфена и борнеолов и тем сильно подвинуть вопрос о строении этих соединений. Совместно с А. М. Зайцевым открыл (1875) реакцию получения вторичных и третичных спиртов действием на карбонильные соединения цинка и алкилгалогенидов. Используя эту реакцию, осуществил (1874—1884) синтез ряда спиртов. Уточнил (1885) правило окисления кетонов, сформулированное А.Н. Поповым. Открыл (1888) реакцию окисления органических соединений, содержащих этиленовую связь, действием на них 1% раствором перманганата калия. Используя этот способ, доказал непредельный характер ряда терпенов.
Егор Егорович умер в 1903 г. Последние годы жизни состоял профессором органической химии и деканом химического отделения Варшавского политехнического института. В качестве члена комитета он принимал деятельное участие в постройке этого института (1898) и устроил в нем образцовую химическую лабораторию. В 1899 г. Русское физико-химическое общество присудило Вагнеру за его ученые заслуги большую премию имени А. М. Бутлерова.
Источник