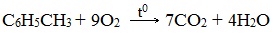- Толуол с водой при катализаторе
- Реакции замещения
- Реакции присоединения
- Реакции окисления
- Ароматические УВ. Бензол
- Арены ряда бензола (моноциклические арены)
- Электронное строение молекулы бензола
- Физические свойства бензола
- Химические свойства бензола
- I. Реакции замещения
- II. Реакции присоединения
- III. Реакции окисления
- Получение бензола
- Изомерия и номенклатура гомологов бензола
- Физические свойства толуола
- Химические свойства толуола
- I. Реакции замещения
- II. Реакции присоединения
- III.Реакции окисления
- Получение толуола:
- Похожее
- Добавить комментарий Отменить ответ
Толуол с водой при катализаторе
Все реакции толуола (метилбензола) можно подразделить на два типа: реакции, затрагивающие бензольное кольцо и реакции, затрагивающие метильную группу.
Реакции замещения
1. Реакции с участием бензольного кольца
Метилбензол вступает во все реакции замещения, в которых участвует бензол, и проявляет при этом более высокую реакционную способность, реакции протекают с большой скоростью.
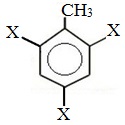
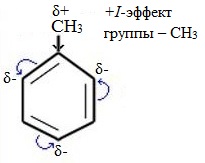
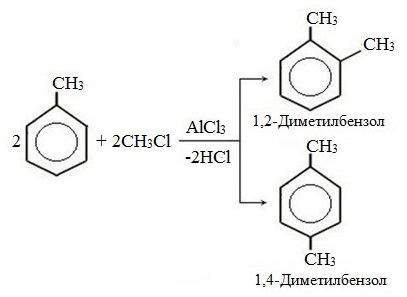
Метильный радикал, содержащийся в молекуле толуола, является ориентантом I рода, поэтому в результате реакций замещения в бензольном ядре получаются орто- и пара- производные толуола или при избытке реагента – трипроизводные общей формулы:
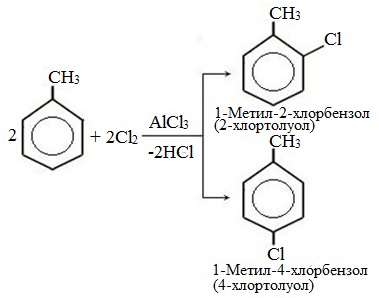
а) галогениерование
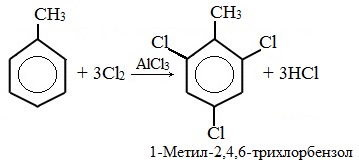
При избытке галогена можно получить ди- и три-замешенные производные в соответствии с правилами ориентации:
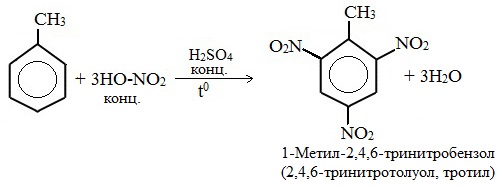
б) нитрование
Например, при нитровании толуола С6Н5CH3 (70°С) происходит замещение не одного, а трех атомов водорода с образованием 2,4,6-тринитротолуола:
Здесь ярко проявляется взаимное влияние атомов в молекуле на реакционную способность вещества. С одной стороны, метильная группа СH3 (за счет +I-эффекта) повышает электронную плотность в бензольном кольце в положениях 2, 4 и 6 и облегчает замещение именно в этих положениях:
С другой стороны, под влиянием бензольного кольца метильная группа СH3 в толуоле становится более активной в реакциях окисления и радикального замещения по сравнению с метаном СH4.
в) сульфирование
г) алкилирование
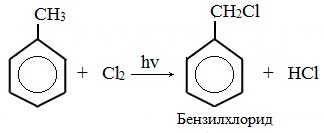
2. Реакции с участием боковой цепи
Метильная группа в метилбензоле может вступать в реакции, характерные для алканов:
Это объясняется тем, что на лимитирующей стадии легко (при невысокой энергии активации) образуется радикал бензил ·CH2-C6H5. Он более стабилен, чем алкильные свободные радикалы (·СН3, ·СH2R), т.к. его неспаренный электрон делокализован за счет взаимодействия с π- электронной системой бензольного кольца:
Реакции присоединения
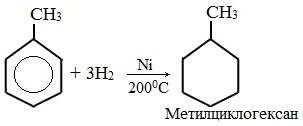
а) гидрирование
Реакции окисления
а) горение
б) неполное окисление
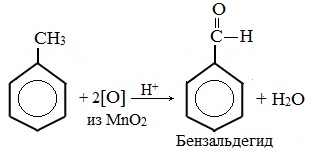
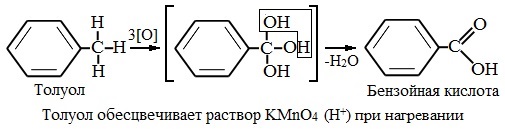
В отличие от бензола его гомологи подвергаются окислению легче предельных углеводородов. При этом окислению подвергаются лишь радикалы, связанные с бензольным кольцом, в случае толуола — метильная группа. Мягкие окислите (MnО2) окисляют ее до альдегидной группы, более сильные окислители (KMnO4) вызывают дальнейшее окисление до кислоты:
Толуол, в отличие от метана, окисляется в мягких условиях (обесцвечивает подкисленный раствор KMnO4 при нагревании).
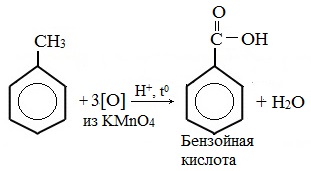
Любой гомолог бензола с одной боковой цепью окисляется KMnO4 и другим сильным окислителем в бензойную кислоту:
Гомологи, содержащие две боковые цепи, дают двухосновные кислоты:
Источник
Ароматические УВ. Бензол
Ароматические УВ (арены) – это УВ, молекулы которых содержат одно или несколько бензольных колец.
Примеры ароматических УВ:
Арены ряда бензола (моноциклические арены)
Общая формула: CnH2n-6, n≥6
Простейшим представителем ароматических УВ является бензол, его эмпирическая формула С6Н6.
Электронное строение молекулы бензола
Общая формула моноциклических аренов CnH2n-6 показывает, что они являются ненасыщенными соединениями.
В 1856 г. немецкий химик А.Ф. Кекуле предложил циклическую формулу бензола с сопряженными связями (чередуются простые и двойные связи) — циклогексатриен-1,3,5:
Такая структура молекулы бензола не объясняла многие свойства бензола:
- для бензола характерны реакции замещения, а не реакции присоединения, свойственные ненасыщенным соединениям. Реакции присоединения возможны, но протекают труднее, чем для алкенов;
- бензол не вступает в реакции, являющиеся качественными реакциями на непредельные УВ (с бромной водой и раствором КМnО4).
Проведенные позже электронографические исследования показали, что все связи между атомами углерода в молекуле бензола имеют одинаковую длину 0,140 нм (среднее значение между длиной простой связи С—С 0,154 нм и двойной связи С=С 0,134 нм). Угол между связями у каждого атома углерода равен 120 о . Молекула представляет собой правильный плоский шестиугольник.
Современная теория для объяснения строения молекулы С6Н6 использует представление о гибридизации орбиталей атома углерода.
Атомы углерода в бензоле находятся в состоянии sp 2 -гибридизации. Каждый атом «С» образует три σ-связи (две с атомами углерода и одну с атомом водорода). Все σ-связи находятся в одной плоскости:
Каждый атом углерода имеет один р-электрон, который не участвует в гибридизации. Негибридизованные р-орбитали атомов углерода находятся в плоскости, перпендикулярной плоскости σ-связей. Каждое р-облако перекрывается с двумя соседними р-облаками, и в результате образуется единая сопряженная π-система (вспомните эффект сопряжения р-электронов в молекуле бутадиена-1,3, рассмотренный в теме «Диеновые углеводороды»):
Сочетание шести σ-связей с едиой π-системой называется ароматической связью.
Цикл из шести атомов углерода, связанных ароматической связью, называется бензольным кольцом, или бензольным ядром.
В соответствии с современными представлениями об электронном строении бензола молекулу С6Н6 изображают следующим образом:
Физические свойства бензола
Бензол при обычных условиях — бесцветная жидкость; t o пл= 5,5 о С; t o кип. = 80 о С; имеет характерный запах; не смешивается с водой, хороший растворитель, сильно токсичен.
Химические свойства бензола
Ароматическая связь определяет химические свойства бензола и других ароматических УВ.
6π-электронная система является более устойчивой, чем обычные двухэлектроиные π-связи. Поэтому реакции присоединения менее характерны для ароматических УВ, чем для непредельных УВ. Наиболее характерными для аренов являются реакции замещения.
I. Реакции замещения
1.Галогенирование
2.Нитрование
Реакцию осуществляют смесью концентрированных азотной HNO3 и серной H2SO4 кислот (нитрующая смесь):
3.Сульфирование
4.Алкилирование (замещение атома «Н» на алкильную группу) – реакции Фриделя-Крафтса, образуются гомологи бензола:
Вместо галогеналканов можно использовать алкены (в присутствии катализатора – AlCl3 или неорганической кислоты):
II. Реакции присоединения
1.Гидрирование
2.Присоединение хлора
III. Реакции окисления
2. Неполное окисление (KMnO4 или K2Cr2O7 в кислой среде). Бензольное кольцо устойчиво к действию окислителей. Реакция не происходит.
Получение бензола
1) переработка нефти и угля;
2) дегидрирование циклогексана:
3) дегидроциклизация (ароматизация) гексана:
В лаборатории:
Сплавление солей бензойной кислоты со щелочами:
Изомерия и номенклатура гомологов бензола
Любой гомолог бензола имеет боковую цепь, т.е. алкильные радикалы, связанные с бензольным ядром. Первый гомолог бензола представляет собой бензольное ядро, связанное с метильным радикалом:
Толуол не имеет изомеров, поскольку все положения в бензольном ядре равноценны.
Для последующих гомологов бензола возможен один вид изомерии – изомерия боковой цепи, которая может быть двух видов:
1) изомерия числа и строения заместителей;
2) изомерия положения заместителей.
Физические свойства толуола
Толуол — бесцветная жидкость с характерным запахом, не растворимая в воде, хорошо растворяется в органических растворителях. Толуол менее токсичен, чем бензол.
Химические свойства толуола
I. Реакции замещения
1.Реакции с участием бензольного кольца
Метилбензол вступает во все реакции замещения, в которых участвует бензол, и проявляет при этом более высокую реакционную способность, реакции протекают с большей скоростью.
Метильный радикал, содержащийся в молекуле толуола, является заместителем рода, поэтому в результате реакций замещения в бензольном ядре получаются орто- и пара-производные толуола или при избытке реагента — трипроизводные общей формулы:
а) галогенирование
При избытке галогена можно получить ди- и три- замещенные производные в соответствии с правилами ориентации:
б) нитрование
в) сульфирование
г) алкилирование
2. Реакции с участием боковой цепи
Метильная группа в метилбензоле может вступать в реакции, характерные для алканов:
При дальнейшем хлорировании можно получить дихлорметилбензол и трихлорметилбензол:
II. Реакции присоединения
Гидрирование
III.Реакции окисления
2. Неполное окисление
В отличие от бензола его гомологи окисляются некоторыми окислителями; при этом окислению подвергается боковая цепь, в случае толуола – метильная группа. Мягкие окислители типа MnO2 окисляют его до альдегидной группы, более сильные окислители (KMnO4) вызывают дальнейшее окисление до кислоты:
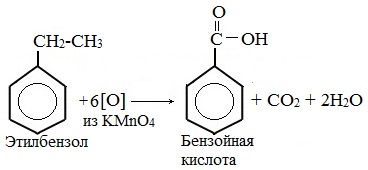
Любой гомолог бензола с одной боковой цепью окисляется сильным окислителем типа KMnO4 в бензойную кислоту, т.е. происходит разрыв боковой цепи с окислением отщепившейся части ее до СО2; например:
При наличии нескольких боковых цепей каждая из них окисляется до карбоксильной группы и в результате образуются многоосновные кислоты, например:
Получение толуола:
В промышленности:
1) переработка нефти и угля;
2) дегидрирование метилциклогексана:
3) дегидроциклизация гептана:
В лаборатории:
1) алкилирование по Фриделю-Крафтсу;
2) реакция Вюрца-Фиттига (взаимодействие натрия со смесью галогенбензола и галогеналкана):
Похожее
Добавить комментарий Отменить ответ
Репетитор по химии. Занятия проходят онлайн по Скайпу. По всем вопросам пишите в Ватсапп: +7 928 285 70 42
Источник