- Агрегатное состояние воды
- Твёрдое состояние воды
- Жидкое состояние воды
- Газообразное состояние воды
- Что мы узнали?
- Агрегатные состояния воды в обычных условиях
- Агрегатные состояния воды в обычных условиях в природе
- Круговорот воды в природе
- Жидкое состояние воды в природе
- Твердое состояние воды в природе
- Газообразное состояние воды в природе
- Агрегатные состояния воды — переходные процессы
- Четвёртое или второе жидкое агрегатное состояние воды
- Важно знать …
- Выводы
- Основные агрегатные состояния вещества
- Агрегатные состояния вещества
- Твердое состояние
- Жидкое состояние
- Газообразное состояние
- Фазовые переходы: изменение агрегатных состояний вещества
- График фазовых переходов
- Решение задач по фазовым переходам
- Сублимация и десублимация
- Влажность воздуха: испарение и конденсация
- Как влажность влияет на человека
Агрегатное состояние воды

Средняя оценка: 4.7
Всего получено оценок: 39.
Средняя оценка: 4.7
Всего получено оценок: 39.
Вода — важная составляющая нашей планеты, основа жизни на Земле. В природе она может находиться в трёх разных агрегатных состояниях: твёрдом, жидком и газообразном. Примеры этих состояний можно наблюдать в погодных явлениях. В статье кратко опишем, как происходит процесс перехода воды из одного состояния в другое, что на это влияет.
Твёрдое состояние воды
В твёрдом состоянии вода представляет собой лёд, снег и иней. При низкой температуре жидкая вода замерзает, и её молекулы начинают приобретать форму кристаллов. Чтобы вода начала замерзать, достаточно 0 °С по Цельсию, и ниже.
При замерзании молекулы воды отодвигаются друг от друга, делая лёд менее плотным, чем жидкость. Это значит, что вода в твёрдом состоянии имеет больший объём, чем в жидком.
Большинство веществ при снижении температуры сжимается, а вода — расширяется, и в этом заключается её уникальная особенность. В качестве доказательства можно наполненную водой бутылку поставить в морозильник. Когда вода превратиться в лёд, её объём увеличится, и бутылка попросту взорвётся.
Наличие солей в воде снижает температуру замерзания. По этой причине солёная морская вода замерзает не при О °С, а при –1,8 °С по Цельсию.
Жидкое состояние воды
Вода в жидком состоянии широко распространена по всей планете. Это не только реки, моря и озера, но также атмосферные осадки (дождь) и облака, которые состоят из крошечных капелек воды. Кроме того, вода в жидком агрегатном состоянии вода находится в почве в виде подземных рек и озёр.

Жидкая вода с лёгкостью переходит в газообразное и твёрдое состояние под воздействием температуры. В этом процессе свою роль играет и давление.
Газообразное состояние воды
Переход воды из жидкого состояния в газообразное называется испарением. В условиях нормального атмосферного давления он происходит при 100 °С по Цельсию (для пресной воды).
При кипячении вода из состояния жидкости переходит в пар — газообразное состояние воды. В природе вода также испаряется с поверхности водоёмов, просто этот процесс происходит гораздо медленнее. Скорость испарения зависит от температуры. Вода, испарённая с поверхности Земли, образует облака и тучи.

Помимо основных трех форм, вода может находиться в четвёртом агрегатном состоянии — плазмы, или, точнее, гидроплазмы. Если водяной пар нагреть до температуры 2200–13900 °С по Цельсию, то молекулы воды начнут распадаться, и в результате получится смесь атомов кислорода и водорода в виде плазмы.
Что мы узнали?
Существуют три состояния воды в природе: жидкое, твёрдое и газообразное. На переход из одного состояния в другое влияют внешние факторы, прежде всего, температура. Также существует четвёртое состояние воды — плазма, однако для неё нужно соблюдать экстремально высокую температуру, которую можно обеспечить лишь в лабораторных условиях. Для учеников 3 класса на уроке по окружающему миру можно кратко перечислить понятные примеры агрегатных состояний: дождь, облака (жидкое), лёд, иней, снег (твёрдое), пар (газообразное).
Источник
Агрегатные состояния воды в обычных условиях
Агрегатные состояния воды в природе — облака, дождь, снег, лед, град, роса, иней туман … мы знакомы с ними с раннего детства.
Агрегатные состояния воды в обычных условиях в природе
Агрегатные состояния воды ежедневно встречаются нам в окружающей нас природе. Они активно влияют на все аспекты жизнедеятельности человека.
В природе в естественных условиях вода может в изобилии существовать в 3-х основных агрегатных состояниях:
- Твердое состояние – лед, снег, град, иней … ;
- Жидкое – вода, дождь, туман, роса, радуга, облака …;
- Газообразное – пар …
К выше сказанному, важно уточнить, что туман и облака, на самом деле, не являются газообразным состоянием воды. Они являются результатом конденсации водяного пара, а не самим паром как таковым. Подробнее про Водяной пар читайте в статье ВОДЯНОЙ ПАР — ГАЗООБРАЗНОЕ СОСТОЯНИЕ ВОДЫ → .
Круговорот воды в природе
Уникальное свойство воды — возможность быть в природных условиях в трех разных базовых агрегатных состояниях, обеспечивает нашей планете жизненно важный процесс – гидрологический цикл или круговорот воды в природе. Если кратко круговорот воды состаит из таких процессов — осадков, испарения и конденсации. Круговорот воды в природе обеспечивает ее присутствие практически во всех уголках нашей планеты, а вода, как известно, источник жизни. Более подробно про него читайте в нашей статье КРУГОВОРОТ ВОДЫ В ПРИРОДЕ → .
Жидкое состояние воды в природе
Без воды в жидком состоянии большинство живых существ на нашей планете просто погибнет.
Химическая формула воды — H2O . Два атома водорода имеют положительный заряд, а один атом кислорода отрицательный. Связь между атомами «не сильная». Поэтому она легко разрывается, впрочем как и устанавливается.
Аккумулируется вода в жидком состоянии в хорошо всем нам известных формах — это океаны, моря, реки, озёра, пруды, ставки, каналы, атмосферных осадках …
Отметим интересный факт — вода в жидком состоянии при фиксированном объёме не имеет фиксированной формы.
Твердое состояние воды в природе
Вода из жидкого состояния переходит в твердое при температуре 0º C (плюс/минус в зависимости от давления). Процесс перехода воды из жидкого состояния в твердое имеет интересную аномалию. При понижении температуры молекулы воды, как и в других материях, сближаются друг с другом. Так происходит вплоть до температуры 4º C. При этой температуре у воды максимальная плотность. При дальнейшем понижении температуры плотность начинает уменьшаться. Благодаря именно этому удивительному свойству лёд плавает, а не тонет. Плотность льда составляет приблизительно 90% от плотности воды.
Вода в твердом состоянии имеет как фиксированный объём, так и фиксированную форму.
Газообразное состояние воды в природе
Из жидкого состояния в парообразное вода переходит при температуре 100º C (плюс/минус в зависимости от давления). Водяной пар не всегда можно увидеть, но его можно почувствовать. Количество пара в атмосфере определяется как влажность. При повышенной влажности можно сказать, что по ощущениям воздух становится «липким».
Агрегатные состояния воды — переходные процессы
Процессы перехода воды с одного агрегатного состояния в другое определяются следующим образом:
- Кипение и парообразование — переход воды из жидкого состояния в пар;
- Конденсация — процесс перехода пара в жидкое состояние воды;
- Кристаллизация — переход жидкости в лед;
- Плавление – переход льда в жидкость;
- Сублимация – переход льда прямо в парообразное состояние;
- Десублимация – переход пара сразу в лед, примером может служить иней.
Граничные точки перехода воды в состояния лед/вода и вода/пар определили соответственно как 0 и 100 градусов по Цельсию при условии атмосферного давления 760 мм рт. ст. или 101 325 Па. Всем с детства хорошо известна простая примета, температура за окном опустилась ниже нуля, ждите снега 🙂
Четвёртое или второе жидкое агрегатное состояние воды
Относительно недавно физики обнаружили новое состояние воды. Это состояние проявляется при температурах в промежутке от 40º до 60º C и проявляется в том, что жидкая вода непрерывно переключается между двумя состояниями, которые имеют разный набор физических свойств.
Данное качество жидкой воды обнаружила физик Лаура Маэстро из Оксфордского университета в Великобритании. Она вместе со своими коллегами провела исследования в ходе которых, при разных температурах измерялись такие физические параметры жидкой воды — показатель преломления, поверхностное натяжение, теплопроводность, диэлектрическая проницаемость … .
Дать объяснение этому феномену учёные пока не смогли. Возможно этот факт связан с другими аномальными свойствами воды, про которые мы подробно писали в нашей статье АНОМАЛЬНЫЕ СВОЙСТВА ВОДЫ, ИЛИ УДИВИТЕЛЬНОЕ РЯДОМ → .
Важно знать …
Необходимо отметить такой, важный для человека факт – при понижении атмосферного давления температура кипения падает. Это необходимо учитывать, например, в условиях высокогорья. Отметим также еще одно явление, которое полезно знать человеку в повседневной жизни — объем воды в твердом состоянии больше чем в жидком. Этот факт иллюстрирует общеизвестный пример – бутылка с водой оставленная на морозе будет разорвана, образовавшимся в ней льдом.
Очевидно, что в разных своих агрегатных состояниях Вода обладает разными базовыми физическими свойствами такими как – текучесть, твердость, летучесть.
Необходимо отметить, что пар определяет такой важный для человека и других живых организмов параметр как «влажность воздуха«. Влажность воздуха напрямую зависит от количества водяного пара в атмосфере, больше пара выше влажность. На земле существуют места как с очень высокой, так и с низкой влажностью атмосферы. Одним из самых влажных мест планеты считается индийский город Черрапунджи (Cherrapunji), а одним из самых сухих Сухие долины в Антарктике.
Выводы
Еще раз сделаем акцент на том, что во многом благодаря именно способности воды находиться в природных естественных условиях в трех разных агрегатных состояниях и существует жизнь на нашей планете.
Источник
Основные агрегатные состояния вещества
О чем эта статья:
Агрегатные состояния вещества
Чтобы разобраться с тем, какими бывают агрегатные состояния, предлагаю по ходу чтения статьи заполнять таблицу.
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
Лед, вода и водяной пар — это все три агрегатных состояния одного вещества. Лед — твердое состояние, вода — жидкая, пар — газообразное. Для каждого вещества существует три состояния.
Твердое состояние
Его очень легко представить — это любой предмет, который мы встречаем в жизни. В этом состоянии тело сохраняет форму и объем. Расстояние между молекулами, приблизительно равно размеру самих молекул, которые, в свою очередь, расположены очень структурированно.
Такая структура называется кристаллической решеткой — из-за четкой структуры молекулам сложно двигаться, и они просто колеблются около своих положений.
Заполняем нашу табличку
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
сохраняет форму и объем
в кристаллической решетке
соотносится с размером молекул
колеблется около своего положения в кристаллической решетке
Жидкое состояние
В этом состоянии сохраняется объем, но не сохраняется форма. Например, если перелить молоко из кувшина в стакан, то молоко, имевшее форму кувшина, примет форму стакана. Кстати, в корове у молока тоже была другая форма.

Расстояние между молекулами в жидком состоянии чуть больше, чем в твердом, но все равно невелико. При этом частицы не собраны в кристаллическую решетку, а расположены хаотично. Молекулы почти не двигаются, но при нагревании жидкости делают это более охотно.
Вспомните, что происходит, если залить чайный пакетик холодной водой — он почти не заваривается. А вот если налить кипяточку — чай точно будет готов.
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
сохраняет форму и объем
в кристаллической решетке
соотносится с размером молекул
колеблется около своего положения в кристаллической решетке
близко друг к другу
малоподвижны, при нагревании скорость движения молекул увеличивается
Газообразное состояние
В жизни мы встречаем газообразное состояние вещества, когда чувствуем запахи. Запах очень легко распространяется, потому что газ не имеет ни формы, ни объема (он занимает весь предоставленный ему объем), состоит из хаотично движущихся молекул, расстояние между которыми больше, чем размеры молекул.
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
сохраняет форму и объем
в кристаллической решетке
соотносится с размером молекул
колеблется около своего положения в кристаллической решетке
близко друг к другу
малоподвижны, при нагревании скорость движения молекул увеличивается
занимают предоставленный объем
больше размеров молекул
хаотичное и непрерывное
С агрегатными состояниями разобрались, ура! Но до сих пор неясно, каким образом у каждого вещества их целых три, и как одно переходит в другое. Для этого узнаем, что такое фазовые переходы.
Фазовые переходы: изменение агрегатных состояний вещества
При изменении внешних условий (например, если внутренняя энергия тела увеличивается или уменьшается в результате нагревания или охлаждения) могут происходить фазовые переходы — изменения агрегатных состояний вещества.
Фазовые переходы интересны тем, что все живое не Земле существует лишь благодаря тому, что вода умеет превращаться в лед или пар. С кристаллизацией, плавлением, парообразованием и конденсацией связаны многие процессы металлургии и микроэлектроники.
На схеме — названия всех фазовых переходов:

Переход из твердого состояния в жидкое — плавление;
Переход из жидкого состояния в твердое — кристаллизация;
Переход из газообразного состояния в жидкое — конденсация;
Переход из жидкого состояния в газообразное — парообразование;
Переход из твердого состояния в газообразное, минуя жидкое — сублимация;
Переход из газообразного состояния в твердое, минуя жидкое — десублимация.
График фазовых переходов
Если взять процесс превращения льда в воду, воды — в пар, и обратные действия, то мы получим очень информативный график.
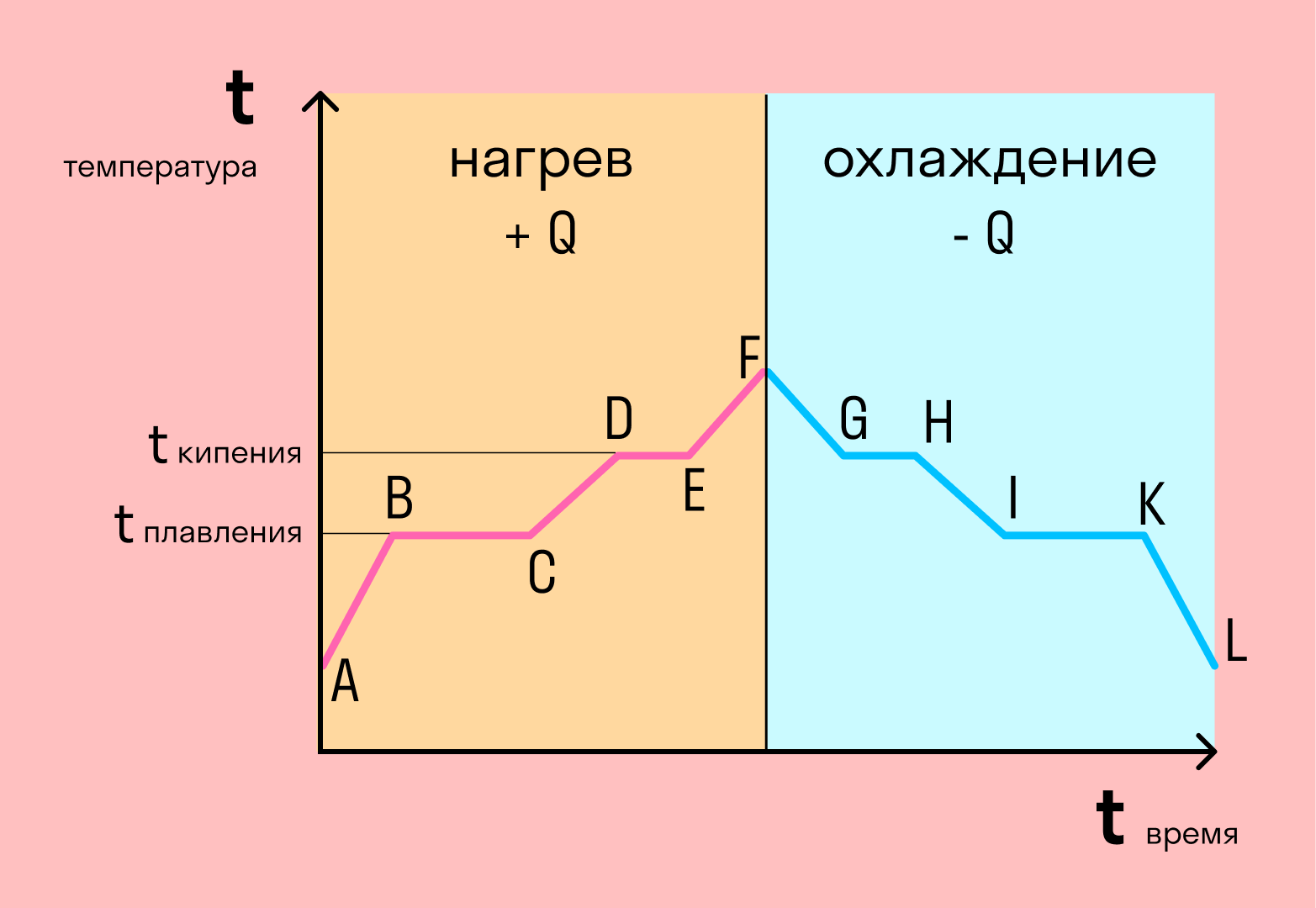
Разбираемся по шагам. Сначала взяли лед, конечно, при отрицательной температуре, потому что при нуле лед начинает плавиться. Нагрели лед до температуры плавления (до 0 градусов).
- AB — нагревание льда
После того, как лед нагрелся до температуры плавления, он начинает плавиться. Плавление происходит при постоянной температуре тем дольше длится, чем больше масса плавящегося вещества. Еще этот процесс зависит от свойств самого вещества, но об этом немного позже.
- BC — плавление льда
Расправившись вещество уже в жидком состоянии снова начинает нагреваться, и температура увеличивается, пока не достигает температуры кипения. В данном случае нагревается вода — это значит, что ее температура кипения равна 100 градусам Цельсия.
- CD — нагревание воды
При 100 градусах вода кипит, пока не выкипит целиком. В данном случае процесс аналогично плавлению происходит при постоянной температуре. Данный процесс нельзя путать с испарением, потому что парообразование происходит при конкретной температуре, а испарение — при любой.
- DE — кипение (парообразование) воды
Далее полученный пар нагревается, но путем нагревания невозможно дойти до другого фазового перехода — можно пойти только обратно.
- EF — нагревание пара
Первый шаг в обратную сторону — охлаждение до температуры кипения.
- FG — охлаждение пара
Дойдя до температуры кипения (в данном случае 100 градусов), пар начинает переходить в жидкое состояние. Этот процесс также происходит при постоянной температуре.
- GH — конденсация пара
Сконденсировавшись, вода охлаждается, пока не начнет замерзать.
- HI — охлаждение воды
Кристаллизуется (замерзает) вода при той же температуре, что и плавится лед — 0 градусов. Кристаллизация также происходит при постоянной температуре.
- IK — кристаллизация воды
После кристаллизации лед охлаждается.
- KL — охлаждение льда
С нагреванием и охлаждением все совсем просто — мы либо передаем теплоту телу (веществу), и оно идет на увеличение температуры, либо тело отдает тепло и охлаждается.
В остальных процессах температура не меняется. Это связано с тем, что количество теплоты не всегда зависит от температуры. Формулы для всех процессов выглядят так:
Нагревание
Охлаждение
Q — количество теплоты [Дж]
c — удельная теплоемкость вещества [Дж/кг*˚C]
m — масса [кг]
tконечная — конечная температура [˚C]
tначальная — начальная температура [˚C]
Плавление
Кристаллизация
Q — количество теплоты [Дж]
λ — удельная теплота плавления вещества [Дж/кг]
m — масса [кг]
Парообразование
Конденсация
Q — количество теплоты [Дж]
L — удельная теплота парообразования вещества [Дж/кг]
m — масса [кг]
Решение задач по фазовым переходам
С теорией разобрались — а теперь давайте практиковаться!
Задачка раз. Температура медного образца массой 100 г повысилась с 20 °С до 60 °С. Какое количество теплоты получил образец? Удельную теплоёмкость меди считать равной 380 Дж/(кг умножить на °С)
Сначала нужно перевести массу в килограммы:
Берем формулу количества теплоты для нагревания вещества:
Q = 380 * 0,1*(60-20) = 1520 Дж
Ответ: образец получил 1520 Дж
Задачка два. Какое количество теплоты необходимо для плавления 2,5 т стали, взятой при температуре плавления? Удельная теплота плавления стали λ=80кДж/кг. Теплопотерями пренебречь.
Сначала нужно перевести массу в килограммы и удельную теплоту в Дж/кг:
80 кДж/кг = 80000 Дж/кг
Берем формулу количества теплоты для плавления вещества:
Q = 80000*2500 = 200 000 000 Дж = 200 МДж
Ответ: для плавления 2,5 т стали необходимо 200 МДж теплоты.
Сублимация и десублимация
Мы уже рассказали про такие процессы, как сублимация и десублимация.
- Переход из твердого состояния в газообразное, минуя жидкое — сублимация (возгонка);
- Переход из газообразного состояния в твердое, минуя жидкое — десублимация.







