- Инструкция по безопасности: как не стать жертвой отравления угарным газом
- Что такое угарный газ?
- Чем опасен угарный газ?
- Кто отвечает за своевременную проверку и исправность дымоходов и вентиляционных каналов?
- Как обеспечить безопасность при работе газовой колонки?
- Зачем проводится техническое обслуживание?
- Угарный газ
- Содержание
- Строение молекулы
- История открытия
- Монооксид углерода в атмосфере Земли
- Получение
- Промышленный способ
- Лабораторный способ
- Физиологическое действие, токсичность
- Защита от монооксида углерода
- Свойства
- Определение монооксида углерода
- Применение
- См. также
- Литература
- Ссылки
- Полезное
- Смотреть что такое «Угарный газ» в других словарях:
Инструкция по безопасности: как не стать жертвой отравления угарным газом
Корреспонденты Myslo пообщались со специалистами «Тулагоргаза» и выяснили, почему в квартире появляется угарный газ и как уберечь от трагедии себя и близких.
Что такое угарный газ?
Угарный газ (СО) – яд быстрого и общетоксического действия, образуется при неполном сгорании газа вследствие плохого доступа кислорода.
Более 50% происшествий связаны с отравлением угарным газом из-за нарушений потребителями правил эксплуатации бытового газового оборудования.
Чем опасен угарный газ?
Угарный газ – невидим, не имеет ни цвета, ни запаха. Человек его никак не почувствует.
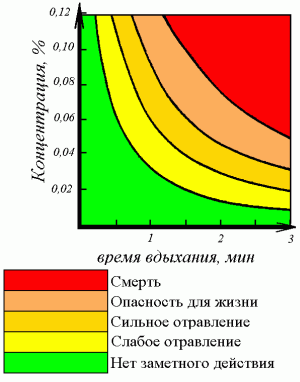
Трех вдохов достаточно взрослому человеку, чтобы получить смертельное отравление.
Концентрация СО в воздухе до 0,32% приводит к параличу и потере сознания (смерть наступает через 30 минут). При концентрации выше 1,2% сознание теряется после 2-3 вдохов, человек умирает менее чем через 3 минуты.
Признаки отравления угарным газом:
- Головная боль или головокружение,
- шум в ушах,
- одышка,
- учащенное сердцебиение,
- мерцание перед глазами,
- покраснение лица,
- тошнота,
- общая слабость.
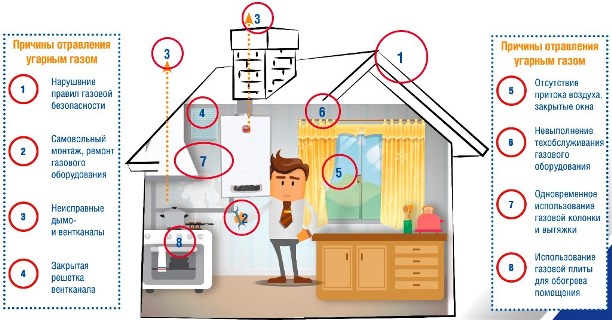
Причины появления угарного газа в помещении:
- Отсутствие тяги в дымоходах и вентиляционных каналах. Отсутствие своевременной проверки состояния дымовых и вентиляционных каналов. Неисправные дымоходы и вентканалы.
- Отсутствие притока воздуха, закрытые окна, закрытое положение жалюзийной решетки на вентиляционном канале в помещении.
- Одновременное пользование газовой колонкой и вытяжным зонтом.
- Отсутствие герметичного соединения дымоотвода от газовой колонки с дымовым каналом.
- Самовольное подключение, монтаж и ремонт газового оборудования.
- Использование газовой плиты для обогрева помещения.
- Неисправность автоматики безопасности.
- Неисправное, разукомплектованное или непригодное к ремонту газовое оборудование.
- Нарушение правил газовой безопасности.
Как избежать отравления угарным газом?
- Требовать от управляющей компании проверки состояния дымовых и вентиляционных каналов.
- Перед включением газовых приборов всегда проверять тягу.
- Пользоваться газовым оборудованием только при открытой форточке или фрамуге окна.
- Своевременно проводить техническое обслуживание газовых приборов.
На каждом из пунктов остановимся подробнее.
Кто отвечает за своевременную проверку и исправность дымоходов и вентиляционных каналов?
В многоквартирных домах проверкой состояния и функционирования дымовых и вентиляционных каналов, их ремонтом и при необходимости прочисткой должна заниматься управляющая компания. На практике – УК заключает договор с организацией, допущенной к проведению таких работ и имеющей соответствующую лицензию.
Проверка дымовых и вентиляционных каналов должна осуществляться не реже 3 раз в год (не позднее чем за 7 календарных дней до начала отопительного сезона, в середине отопительного сезона и не позднее чем через 7 дней после окончания отопительного сезона).
Как самому проверить тягу?
Для полного сгорания газа необходимо достаточное количество воздуха. Тяга – это направленное движение продуктов сгорания газа в дымовой или вентиляционный канал. Тяга может быть естественной и принудительной. Естественная тяга происходит за счет разности удельного веса продуктов сгорания газа и более холодного атмосферного воздуха.
Проверить тягу в дымовых и вентиляционных каналах можно с помощью листа тонкой бумаги:
- Приложите лист бумаги к вентиляционной решетке. Если бумага притягивается, тяга есть.
- Для проверки тяги в дымовых каналах газовых колонок или котлов приложите тонкий лист бумаги к смотровому окну приборов. Если бумага притягивается, тяга есть.
Как обеспечить безопасность при работе газовой колонки?
Одно из важных условий безопасной работы газовой колонки – обеспечение отвода продуктов сгорания, образующихся во время работы прибора, с помощью дымоотвода.
Согласно техническим регламентам алюминиевые гофрированные дымоходы не запрещены. Однако одновременно с этим в регламентах указано, что в качестве материала для изготовления дымоотводов наиболее предпочтительна нержавеющая сталь, соединительные и дымовые трубы должны быть изготовлены из негорючих материалов, быть плотными и не допускать подсоса воздуха на соединениях и в местах примыкания к дымовому каналу. Дымоотводы должны выполняться из материалов, способных противостоять без потери герметичности и прочности ударным механическим нагрузкам, стойких к транспортируемой и окружающей среде.
Использование алюминиевых дымоотводов требует со стороны пользователя постоянного контроля целостности гофры и ее надежного соединения с дымоходом. А в случае несвоевременного выполнения технического обслуживания газового оборудования, засора газовой колонки возможно неполное сгорание газа, возгорание сажи и прогорание стенок алюминиевого дымоотвода. Как следствие всего перечисленного, выход угарного газа в жилое помещение.
АО «Тулагоргаз» как специализированная организация с 65-летним опытом работы рекомендует при установке или замене газовой колонки применять стальные (оцинкованные) дымоотводы. Использование стальных дымоотводов — это безопасный способ эксплуатации газового оборудования.
Зачем проводится техническое обслуживание?
Задача газовиков — убедиться, что газовое оборудование в квартирах исправно и может дальше безопасно эксплуатироваться, есть ли свободный доступ к газопроводам и кранам для их ремонта и обслуживания и т.д.
Важно: техническое обслуживание газовых приборов проводится ЕЖЕГОДНО. Даже если у вас новое оборудование, независимо от гарантийного срока ТО проводится ежегодно.
Кому точно пора проводить ТО?
Тем, кто не проводил проверку более года, тем, кто внес предоплату за ТО, но специалистов так и не вызвал, тем, у кого вообще нет договора на техническое обслуживание.
Если в день проверки вас не будет дома, вызовите мастера заранее, в удобное время.
В АО «Тулагоргаз» действует гибкий график работы, техническое обслуживание газовых приборов проводится по будням в вечернее время, а также по субботам.
Оставить заявку можно по телефонам: 25-36-68, 25-36-56, 25-36-37 или на сайте.
Исправное газовое оборудование – залог безопасности. Берегите не только кошелек, но и жизнь — свою и соседей!
Фото 1. Сечение дымоотвода не соответствует требованиям завода-изготовителя и паспорта на газовое оборудование.
Фото 2. Неплотное соединение дымоотвода от газовой колонки с дымоходом.
Фото 3. Наиболее предпочтительный материал для изготовления дымоотвода — нержавеющая сталь. Недопустима эксплуатация дымоотвода из разных материалов.
Фото 4. Нет вертикального участка, провис горизонтального участок дымоотвода от газовой колонки, нарушена целостность гофрированной трубы. Она небезопасна в использовании. Во время работы газового прибора угарный газ может выйти в помещение.
Фото 5. Нет доступа для проверки места соединения дымоотвода с дымоходом.
Фото 6. Подключение вытяжного зонта к системе дымоудаления. Данная конструкция категорически запрещена к эксплуатации.
Источник
Угарный газ
Угарный газ
| Монооксид углерода | |
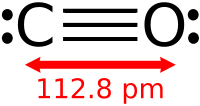 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Монооксид углерода |
| Химическая формула | CO |
| Отн. молек. масса | 28.0101 а. е. м. |
| Молярная масса | 28.0101 г/моль |
| Физические свойства | |
| Плотность вещества | 0,00125 (при 0°C) г/см³ |
| Состояние (ст. усл.) | бесцветный газ |
| Термические свойства | |
| Температура плавления | −205 °C |
| Температура кипения | −191,5 °C |
| Энтальпия (ст. усл.) | −110,52 кДж/моль |
| Химические свойства | |
| Растворимость в воде | 0.0026 г/100 мл |
| Классификация | |
| номер CAS | [630-08-0] |
Монооксид углерода (лат. Carbon monoxide ; другие названия — уга́рный газ, окись углерода, моноокись углерода, оксид углерода (II)) — бесцветный газ без вкуса и запаха. Химическая формула CO.
- ICSC 0023
- RTECS FG3500000
- ООН 1016
- EC 006-001-00-2
- Класс опасности ООН 2,3
- Вторичная опасность по классификации ООН 2,1
| Стандартная энергия Гиббса образования ΔG | −137,14 кДж/моль (г) (при 298 К) |
| Стандартная энтропия образования S | 197,54 Дж/моль·K (г) (при 298 К) |
| Стандартная мольная теплоёмкость Cp | 29,11 Дж/моль·K (г) (при 298 К) |
| Энтальпия плавления ΔHпл | 0,838 кДж/моль |
| Энтальпия кипения ΔHкип | 6,04 кДж/моль |
| Критическая температура tкрит | −140,23°C |
| Критическое давление Pкрит | 3,499 МПа |
| Критическая плотность ρкрит | 0,301 г/см 3 |
Основными типами химических реакций, в которых участвует монооксид углерода, являются реакции присоединения и окислительно-восстановительные реакции, в которых он проявляет восстановительные свойства.
При комнатных температурах CO малоактивен, его химическая активность значительно повышается при нагревании и в растворах (так, в растворах он восстанавливает соли Au, Pt, Pd и других до металлов уже при комнатной температуре. При нагревании восстанавливает и другие металлы, например CO + CuO → Cu + CO2↑. Это широко используется в пирометаллургии. На реакции CO в растворе с хлоридом палладия основан способ качественного обнаружения CO, см. ниже).
Окисление СО в растворе часто идёт с заметной скоростью лишь в присутствии катализатора. При подборе последнего основную роль играет природа окислителя. Так, KMnO4 быстрее всего окисляет СО в присутствии мелкораздробленного серебра, K2Cr2O7 — в присутствии солей ртути, KClO3 — в присутствии OsO4. В общем, по своим восстановительным свойствам СО похож на молекулярный водород.
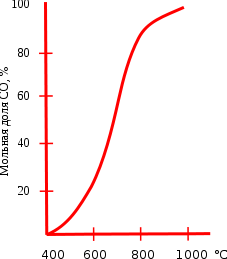
Ниже 830°C более сильным восстановителем является CO, — выше — водород. Поэтому равновесие реакции:
до 830°С смещено вправо, выше 830°C влево.
Интересно, что существуют бактерии, способные за счёт окисления СО получать необходимую им для жизни энергию.
Монооксид углерода горит синим пламенем (температура начала реакции 700°C) на воздухе:
Температура горения CO может достигать 2100°C, она является цепной, причём инициаторами служат небольшие количества водородсодержащих соединений (вода, аммиак, сероводород и др.)
Благодаря такой хорошей теплотворной способности, CO является компонентом разных технических газовых смесей (см., например генераторный газ), используемых, в том числе, для отопления.
Монооксид углерода реагирует с галогенами. Наибольшее практическое применение получила реакция с хлором:
Реакция экзотермическая, её тепловой эффект 113 кДж, в присутствии катализатора (активированный уголь) она идёт уже при комнатной температуре. В результате реакции образуется фосген — вещество, получившее широкое распространение в разных отраслях химии (а также как боевое отравляющее вещество). По аналогичным реакцииям могут быть получены COF2 (карбонилфторид) и COBr2 (карбонилбромид). Карбонилиодид не получен. Экзотермичность реакций быстро снижается от F к I (для реакций с F2 тепловой эффект 481 кДж, с Br2 — 4 кДж). Можно также получать и смешанные производные, например COFCl (подробнее см. галогенпроизводные угольной кислоты).
Реакцией CO с F2, кроме карбонилфторида можно получить перекисное соединение (FCO)2O2. Его характеристики: температура плавления −42°C, кипения +16°C, обладает характерным запахом (похожим на запах озона), при нагревании выше 200°C разлагается со взрывом (продукты реакции CO2, O2 и COF2), в кислой среде реагирует с иодидом калия по уравнению:
Монооксид углерода реагирует с халькогенами. С серой образует сероксид углерода COS, реакция идёт при нагревании, по уравнению:
Получены также аналогичные селеноксид COSe и теллуроксид COTe.
C переходными металлами образует очень летучие, горючие и ядовитые соединения — карбонилы, такие как Cr(CO)6, Ni(CO)4, Mn2CO10, Co2(CO)9 и др.
Как указано выше, монооксид углерода незначительно растворяется в воде, однако не реагирует с ней. Также он не вступает в реакции с растворами щелочей и кислот. Однако с расплавами щелочей вступает в реакцию:
Интересна реакция монооксида углерода с металлическим калием в аммиачном растворе. При этом образуется взрывчатое соединение диоксодикарбонат калия:
2K + 2CO → K + O — —C2—O — K +
Реакцией с аммиаком при высоких температурах можно получить важное для промышленности соединение — циановодород HCN. Реакция идёт в присутствии катализатора (оксид тория ThO2) по уравнению:
Определение монооксида углерода
Качественно можно определить наличие CO по потемнению растворов хлорида палладия (или пропитанной этим раствором бумаги). Потеменение связано с выделением мелкодисперсного металлического палладия по схеме:
Эта реакция очень чувствительная. Стандартный раствор 1 грамма хлорида палладия на литр воды.
Количественное определение монооксида углерода основано на иодометрической реакции:
Применение
- Моноксид углерода применяется для обработки мяса животных и рыбы, придает им ярко красный цвет и вид свежести, не изменяя вкуса (en:Clear smoke или en:Tasteless smoke технология). Допустимая концентрация CO равна 200 мг/кг мяса.
- Инсульт (ОНМК) — новые методы лечения.
См. также
Литература
- Ахметов Н. С. Общая и неорганическая химия. 5-е изд., испр. — М.: Высш. шк.; 2003 ISBN 5-06-003363-5
- Некрасов Б. В. Основы общей химии. Т. I, изд. 3-е, испр. и доп. Изд-во «Химия», 1973 г. Стр. 495—497, 511—513
- Химия: Справ. из./В. Шретер, К.-Х. Лаутеншлегер, Х. Бибрак и др.: Перс. с нем. 2-е изд., стереотип. — М.:Химия, 2000 ISBN 5-7245-0360-3 (рус.)
Ссылки
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое «Угарный газ» в других словарях:
УГАРНЫЙ ГАЗ — (монооксид углерода, СО), бесцветный, лишенный запаха ядовитый газ, который образуется при неполном сгорании ископаемых топлив; он присутствует, например, в составе угольного газа и выхлопных газов автомобилей. Ядовитое действие угарного газа… … Научно-технический энциклопедический словарь
Угарный газ — оксид углеродa, CO (a. carbon monoxide; н. Kohlenoxyd, Kohlenmonoxyd; ф. oxyde de carbone; и. oxido de carbono), хим. соединение углерода c кислородом из группы оксидов; природный газ без цвета и запаха. Bпервые выделен в лабораторных… … Геологическая энциклопедия
угарный газ — сущ., кол во синонимов: 2 • газ (55) • угар (22) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
УГАРНЫЙ ГАЗ — (монооксид углерода, оксид углерода, СО) продукт неполного окисления углерода и его соединений (в печи, двигателе и др.), чрезвычайно ядовитый газ (вызывает отравление организма угар (см. (1))) без цвета, запаха и вкуса, плохо растворим в воде.… … Большая политехническая энциклопедия
УГАРНЫЙ ГАЗ — УГАРНЫЙ ГАЗ, то же, что углерода оксид … Современная энциклопедия
УГАРНЫЙ ГАЗ — то же, что углерода оксид … Большой Энциклопедический словарь
УГАРНЫЙ ГАЗ — неполный окисел углерода, возникающий в условиях горения при недостатке кислорода воздуха. У. г. не имеет цвета, вкуса и запаха, ядовит; при содержании его в воздухе от 0,02% отравляет организм, а потому во всех цехах, в к рых может возникнуть… … Технический железнодорожный словарь
Угарный газ — см. Оксид углерода … Российская энциклопедия по охране труда
Угарный газ — УГАРНЫЙ ГАЗ, то же, что углерода оксид. … Иллюстрированный энциклопедический словарь
угарный газ — то же, что оксид углерода. * * * УГАРНЫЙ ГАЗ УГАРНЫЙ ГАЗ, то же, что углерода оксид (см. УГЛЕРОДА ОКСИД) … Энциклопедический словарь
Источник