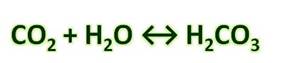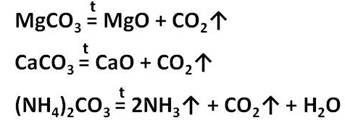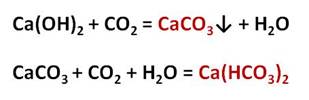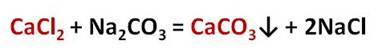- Карбонат кальция: способы получения и химические свойства
- Способ получения
- Качественная реакция
- Химические свойства
- Практическая работа 3. Получение углекислого газа и изучение его свойств.
- Угольная кислота. Карбонаты. Жёсткость воды
- Урок 27. Химия 9 класс ФГОС
- В данный момент вы не можете посмотреть или раздать видеоурок ученикам
- Получите невероятные возможности
- Конспект урока «Угольная кислота. Карбонаты. Жёсткость воды»
Карбонат кальция: способы получения и химические свойства
Карбонат кальция CaCO3 — соль кальция и угольной кислоты. Белый, при прокаливании разлагается, плавится без разложения под избыточным давлением CO2. Практически не растворяется в воде.
Относительная молекулярная масса Mr = 100,09; относительная плотность для тв. и ж. состояния d= 2,93; tпл = 1242º C при избыточном давлении.
Способ получения
1. Карбонат кальция можно получить путем взаимодействия хлорида кальция и карбоната кальция , образуется карбонат кальция и хлорид натрия:
2. В результате взаимодействия при комнатной температуре оксида кальция и углекислого газа происходит образование карбоната кальция:
3. Гидроксид кальция вступает в взаимодействие с углекислым газом и образует карбонат кальция и воду:
Качественная реакция
Качественная реакция на карбонат кальция — взаимодействие его с раствором сильных кислот. В результате реакции происходит бурное выделение углекислого газа, образование которого можно проверить, если пропустить его через известковую воду, которая мутнеет из-за образования осадка:
1. При взаимодействии с хлороводородной кислотой, карбонат кальция образует хлорид кальция, углекислый газ и воду:
Химические свойства
1. Карбонат кальция разлагается при температуре выше 900 — 1200º С, с образованием оксида кальция и углекислого газа:
2. Карбонат кальция вступает в реакцию со многими сложными веществами :
2.1. Карбонат кальция реагирует с оксидами :
2.1.1. Карбонат лития вступает в взаимодействие с оксидом кремния при 800º С и образует на выходе силикат кальция и углекислый газ:
2.2. Карбонат кальция реагирует с кислотами :
2.2.1. При взаимодействии с разбавленной хлороводородной кислотой карбонат кальция образует хлорид кальция, углекислый газ и воду:
2.2.2. Карбонат кальция реагирует с разбавленной плавиковой кислотой . Взаимодействие карбоната кальция с плавиковой кислотой приводит к образованию фторида кальция, воды и углекислого газа:
2.2.3. Карбонат кальция взаимодействует с сероводородной кислотой при 900º С и образует сульфид кальция, воду и углекислый газ:
3. Карбонат кальция реагирует с простыми веществами:
3.1. Карбонат кальция при 800 — 850º С вступает в реакцию с углеродом (коксом) образуя оксид кальция и угарный газ:
CaCO3 + C = CaO + 2CO
Источник
Практическая работа 3. Получение углекислого газа и изучение его свойств.
Оборудование и реактивы: лабораторный штатив с лапкой, аппарат Кирюшкина (либо прибор, состоящий из колбы на 100 мл и пробки с газоотводной трубкой), стакан на 100 мл, кусок бумаги, спиртовка, держатель для пробирок, лучинка, две пробирки, известковая вода (раствор гидроксида кальция), лакмус.
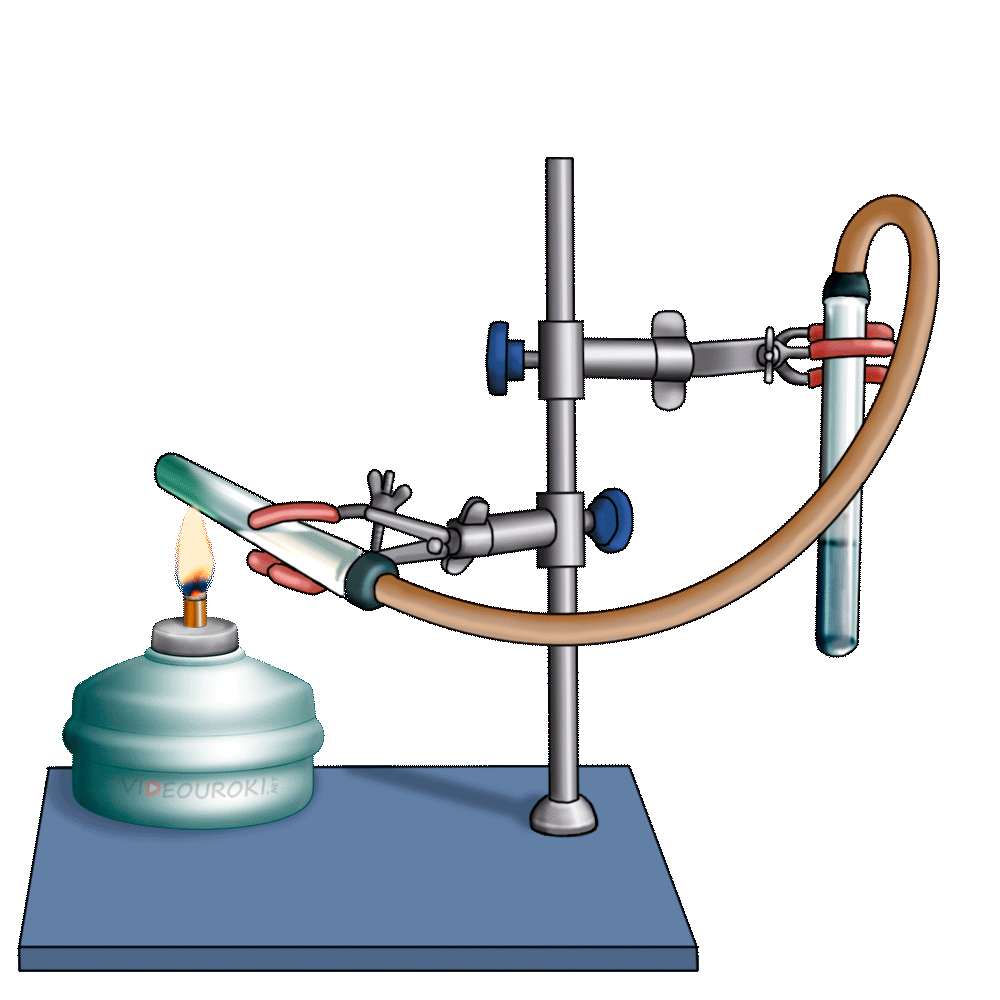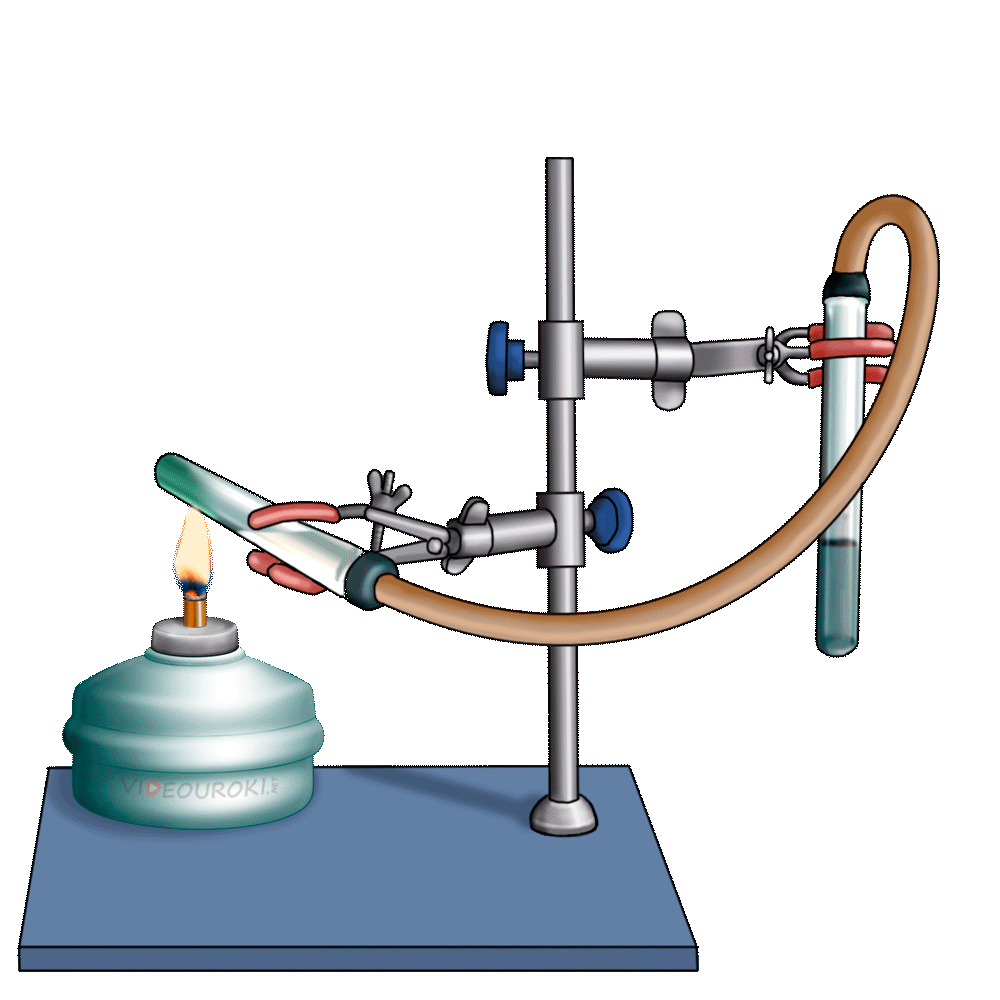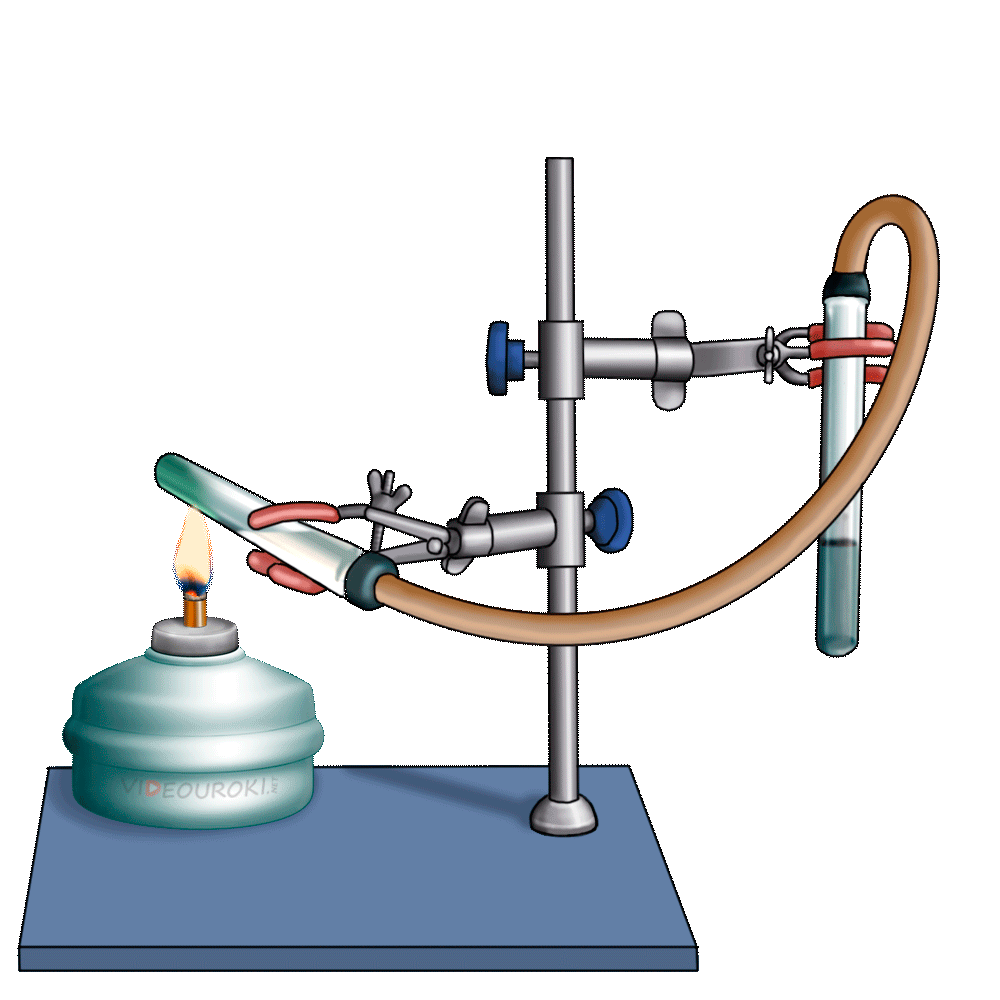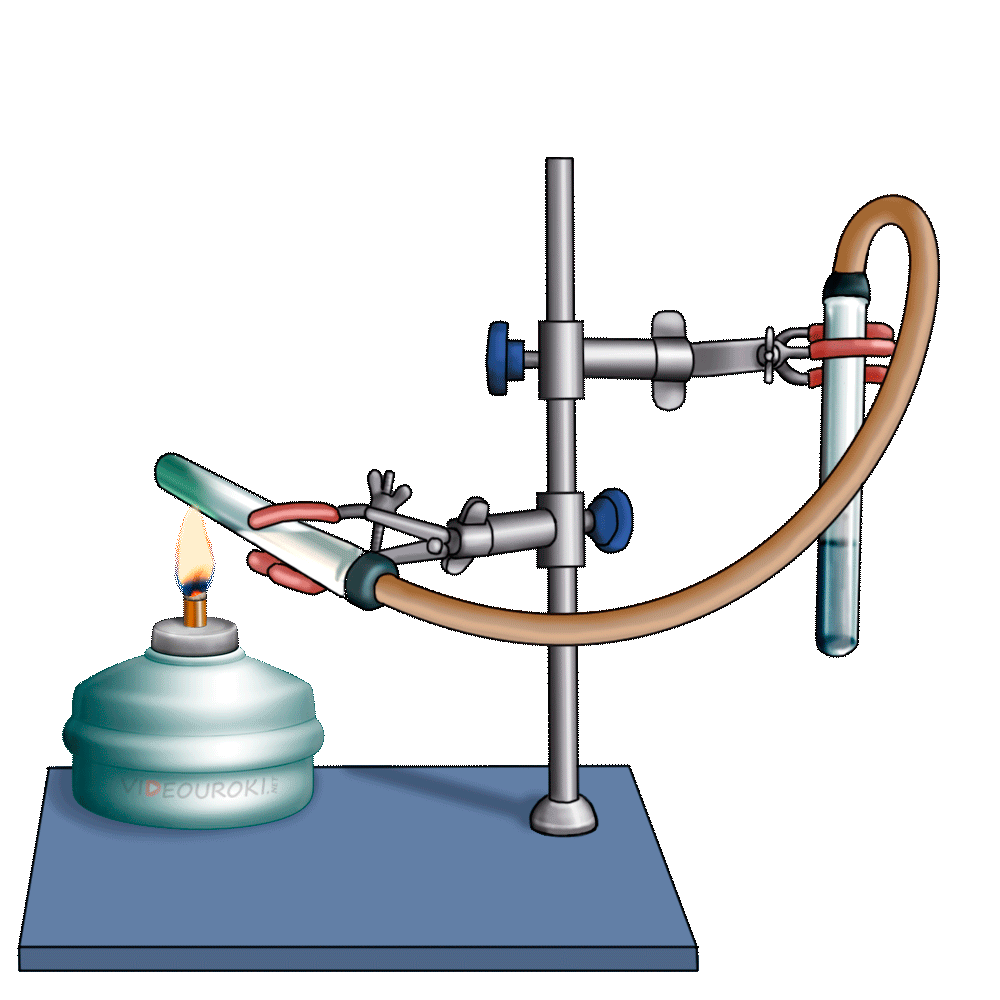
1. Изучите выданный вам прибор Кирюшкина для получения газов (рис. 133). Он состоит из пробирки с трубкой для выхода газа и вставленной в неё пробки с длинной воронкой, на нижней части которой укреплена прокладка. Газоотводная трубка снабжена краном, регулирующим ток выделяющегося газа. Выньте пробку с воронкой из пробирки, но не полностью, а на 2-3 см и в образовавшийся зазор опустите несколько кусочков мрамора так, чтобы они оказались на прокладке. После этого плотно закройте пробирку пробкой. Налейте в воронку 10%-й раствор соляной кислоты в таком количестве, чтобы кислота полностью закрыла мрамор. Закройте кран на газоотводной трубке. Что происходит? Если кислота поднимается вверх по воронке, значит, прибор герметичен и готов к использованию. Если в школьной лаборатории нет приборов Кирюшкина, для получения углекислого газа можно воспользоваться колбой, закрытой пробкой с помещённой в неё газоотводной трубкой (рис. 134). В колбу кладут кусочки мрамора (или насыпают порошок мела) и заливают 10%-м раствором соляной кислоты. В чём состоит недостаток такого прибора по сравнению с прибором Кирюшкина?
2. Заполните углекислым газом химический стакан. Для этого опустите конец газоотводной трубки на дно стакана и откройте кран. Чтобы углекислый газ не смешивался с воздухом, отверстие стакана закройте листом бумаги, в котором сделайте отверстие для газоотводной трубки. Через несколько минут приподнимите бумагу и поднесите к отверстию стакана зажжённую лучинку. Что наблюдаете? Продолжайте заполнение стакана углекислым газом до тех пор, пока лучинка не станет гаснуть. После этого закройте кран на аппарате Кирюшкина. Напишите уравнение реакции получения углекислого газа. Можно ли собирать углекислый газ в сосуд, расположенный вверх дном? Почему?
3. «Перелейте» собранный углекислый газ в две пробирки. При помощи зажжённой лучинки убедитесь в том, что они заполнены углекислым газом. В одну пробирку прилейте 1 мл фиолетового раствора лакмуса. Что наблюдаете? О чём свидетельствует изменение окраски индикатора? Напишите уравнение реакции.
4. К другой пробирке с углекислым газом прилейте 1 мл известковой воды (раствор гидроксида кальция). Какое вещество выпадает в осадок? Напишите уравнение реакции.
5. В пробирку с осадком карбоната кальция поместите конец газоотводной трубки аппарата Кирюшкина и откройте кран. Пропускайте углекислый газ до тех пор, пока весь осадок не растворится. Какое вещество находится в растворе? После этого нагрейте раствор в пробирке до кипения. Напишите в тетрадь уравнения реакций.
6. Сделайте выводы о физических и химических свойствах углекислого газа.
При заливе мрамора кислотой наблюдается выделение газа. Недостаток колбы с газоотводной трубкой состоит в том, что в ней нельзя остановить реакцию, а в приборе Кирюшкина – можно.
При внесении тлеющей лучины в стакан с углекислым газом, лучина гаснет.
Уравнение реакции получения углекислого газа:
CaCO3 + 2HCl ⟶ CaCl2 + H2O + CO2↑
Углекислый газ нельзя собирать в сосуд, расположенный вверх дном, потому что углекислый газ тяжелее воздуха.
Раствор лакмуса в углекислом газе меняет свой цвет на красный, что говорит о кислой среде.
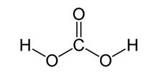
CO2 + H2O ⇄ H2CO3
H2CO3 ⇄ H + + HCO3 —
При добавлении известковой воды к углекислому газу наблюдается выпадение карбоната кальция:
Ca(OH)2 + CO2 ⟶ CaCO3↓ + H2O
При пропускании углекислого газа через пробирку с карбонатом кальция, наблюдается растворение осадка, т. к. в результате реакции образуется растворимый гидрокарбонат кальция.
CaCO3 + H2O + CO2 ⟶ Ca(HCO3)2
После кипячения раствора с гидрокарбонатом кальция, наблюдается появление осадка карбоната кальция.
Ca(HCO3)2 t ⟶ CaCO3↓ + H2O + CO2↑
Физические свойства. Углекислый газ – это бесцветный газ с кисловатым запахом и вкусом, он тяжелее воздуха.
Химические свойства. Углекислый газ относится к кислотным оксидам. Частично взаимодействует с водой с образованием угольной кислоты, лакмус окрашивает такой раствор в красный цвет, что говори о кислой среде. Углекислый газ взаимодействует с щелочами с образованием карбонатов, также взаимодействует с карбонатами с образованием гидрокарбонатов.
Источник
Угольная кислота. Карбонаты. Жёсткость воды
Урок 27. Химия 9 класс ФГОС
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Угольная кислота. Карбонаты. Жёсткость воды»
Угольная кислота. Карбонаты. Жёсткость воды
Угольная кислота образуется при растворении оксида углерода (IV) в воде. Эта кислота нестойкая и почти сразу распадается на исходные вещества – углекислый газ и воду.
Получим угольную кислоту и исследуем её свойства. Собрав прибор для получения газов и проверив его на герметичность, следует поместить в пробирку кусочки мрамора и прилить соляной кислоты. После чего мы можем наблюдать выделение газа, который следует пропустить через воду с лакмусом. При этом видно, что лакмус изменил окраску с фиолетовой на красную. Но через некоторое время лакмус опять меняет свою окраску с красной на фиолетовую, потому что образовавшаяся угольная кислота является нестойкой и через некоторое время распадается на исходные вещества – углекислый газ и воду.

Как двухосновная кислота угольная кислота диссоциирует по двум ступеням: на первой ступени образуется ион водорода и гидрокарбонат-ион, а на второй – ион водорода и карбонат-ион:
Угольная кислота образует два типа солей: средние – карбоната и кислые – гидрокарбонаты. Например, CaCO3 – карбонат кальция, Ca(HCO3)2 – гидрокарбонат кальция. Из карбонатов в воде растворимы только соли калия, натрия и аммония. Карбонаты других металлов нерастворимы в воде и при нагревании разлагаются на оксид металла и углекислый газ. При разложение карбоната магния образуется оксид магния и углекислый газ, а при разложении карбоната кальция образуется оксид кальция и углекислый газ. При нагревании карбоната аммония образуется аммиак, вода и углекислый газ.
Кислые соли растворимы в воде.
Карбонаты могут превращаться в гидрокарбонаты: если через них пропустить углекислый газ в присутствии воды. Например, если через известковую воду пропускать углекислый газ, то сначала известковая вода мутнеет, вследствие образования карбоната кальция, но при дальнейшем пропускании углекислого газа помутнение исчезает, потому что карбонат переходит в гидрокарбонат.
Наличием гидрокарбонатов кальция и магния в природной воде объясняется её временная жёсткость. В жёсткой воде плохо мылится мыло, трудно стирать бельё, плохо развариваются овощи. Если нагреть растворимый гидрокарбонат кальция, то образуется снова карбонат кальция – нерастворимая в воде соль.
Эта реакция приводит к образованию накипи на стенках котлов, чайников, труб парового отопления. В природе в результате этой реакции в пещерах формируются свисающие вниз сталактиты, навстречу которым снизу вырастают сталагмиты.


Другие соли кальция и магния, такие как хлориды и сульфаты, придают воде постоянную жёсткость. Для её устранения нужно использовать карбонат натрия – Na2CO3 – соду, которая переводит ионы кальция в осадок. Например, в реакции хлорида кальция с карбонатом натрия образуется нерастворимая соль – карбонат кальция и хлорид натрия. Таким образом, карбонат натрия перевёл растворимую соль кальция – хлорид кальция, в нерастворимую – карбонат кальция.
Соду можно использовать и для устранения временной жёсткости.
Качественными реакциями на карбонаты и гидрокарбонаты являются реакции этих солей с кислотами. Например, если в расвтор карбоната натрия добавить соляной кислоты, то происходит «вскипание» раствора, из-за образовавшегося углекислого газа. То же самое можно наблюдать при добавлении соляной кислоты к гидрокарбонату натрия.
Из солей угольной кислоты наиболее широко применяют кристаллическую соду – Na2CO3 ∙ 10H2O, кальцинированную соду – Na2CO3 – в стекольной, мыловаренной, целлюлозно-бумажной, текстильной, нефтеперерабатывающей и других отраслях промышленности, а в быту её используют как моющее средство.
Сода была известна человеку примерно за полторы – две тысячи лет до нашей эры, а может быть и раньше. Её добывали из содовых озёр и извлекали из месторождений. Первые сведения о получении соды путём упаривания воды озёр относятся к шестьдесят четвертому г н. э. и приведены в сочинениях древнеримского врача и ботаника Диоскорида Педания о лекарственных веществах.
Питьевая сода – NaHCO3 – применяется в медицине, хлебопечении, пищевой промышленности, питьевая сода входит в состав наполнителя для огнетушителей.
Карбонат калия, или поташ – K2CO3 – используют для получения мыла, в фотографии, в качестве удобрения, при изготовлении тугоплавкого стекла.
Известняк, или мрамор – CaCO3 – используют в строительстве как облицовочный и строительный материал. Он необходим для получения извести, его вносят в почву для понижения кислотности, мел необходим для побелки, а также в стекольной, резиновой и других областях промышленности.
Таким образом, угольная кислота – это двухосновная слабая неустойчивая кислота, которая образуется при растворении в воде углекислого газа, она диссоциирует по двум ступеням, поэтому образует два типа солей – карбонаты и гидрокарбонаты, карбонаты многих металлов нерастворимы в воде и при нагревании разлагаются, а гидрокарбонаты – это растворимые соли. Карбонаты можно перевести в гидрокарбонаты и наоборот. Для перевода карбоната в гидрокарбонат через карбонат пропускают углекислый газ в воде, а при нагревании гидрокарбонатов образуются карбонаты. Различают временную и постоянную жёсткость. Временная жёсткость обусловлена наличием гидрокарбонатов кальция и магния и устраняется кипячением, постоянная жёсткость обусловленая наличием других солей кальция и магния, и устраняется добавлением соды. Качественными реакциями на карбонат и гидрокарбонат-ион является действие кислот на эти соли, при этом наблюдается бурное выделение углекислого газа. Карбонаты и гидрокарбонаты многих металлов находят широкое применение во многих отраслях народного хозяйства.
Источник