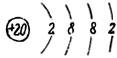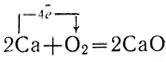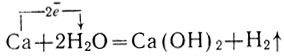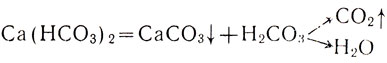- Практическая работа 6. Получение оксида углерода (IV) и изучение его свойств. Распознавание карбонатов.
- Получение оксида углерода (IV) и изучение его свойств.
- Распознавание карбонатов.
- Получение оксида углерода (IV) и изучение его свойств.
- Распознавание карбонатов.
- Углекислый газ пропустили через известковую воду реакция
- § 66. Кальций
- Углекислый газ пропустили через известковую воду реакция
- Углекислый газ пропустили через известковую воду реакция
- § 66. Кальций
Практическая работа 6. Получение оксида углерода (IV) и изучение его свойств. Распознавание карбонатов.
Получение оксида углерода (IV) и изучение его свойств.
1) Поместите в пробирку несколько кусочков мела или мрамора и прилейте немного разбавленной соляной кислоты. Пробирку быстро за кройте пробкой с газоотводной трубкой. Коней трубки поместите в другую пробирку, в которой находится 2-3 мл известковой воды. Несколько минут пропускайте выделяющийся газ через известковую воду.
Что происходит, если на мел (мрамор) действуют соляной кислотой?
Почему при пропускании образующегося газа через раствор известковой воды сначала происходит помутнение, а затем взвесь растворяется?
2) Конец газоотводной трубки выньте из раствора и сполосните в дистиллированной воде. Поместите трубку в пробирку с 2-3 мл дистиллированной воды и пропустите через неё выделяющийся газ. Через не сколько минут выньте трубку из раствора и добавьте к нему несколько капель синего лакмуса. Что наблюдаете?
3) В пробирку налейте 2-3 мл разбавленного раствора гидроксида натрия, добавьте к нему несколько капель фенолфталеина и затем через раствор пропустите выделяющийся газ. Что наблюдаете?
Напишите уравнения всех проведённых реакций в молекулярном, ионном и сокращённом ионном виде.
Распознавание карбонатов.
В трёх пробирках даны кристаллические вещества: сульфат натрия, хлорид цинка, карбонат калия. Определите, какое вещество находится в каждой пробирке.
Сделайте вывод, что является качественной реакцией на карбонат-ионы. Напишите соответствующее уравнение реакции.
Получение оксида углерода (IV) и изучение его свойств.
При взаимодействии мела с соляной кислотой наблюдается выделение газа:
CaCO3 + 2HCl ⟶ CaCl2 + H2O + CO2↑
CaCO3 + 2H + + 2Cl — ⟶ Ca 2+ + 2Cl — + H2O + CO2↑
CaCO3 + 2H + ⟶ Ca 2+ + H2O + CO2↑
При пропускании выделяющегося газа через известковую воду, наблюдается помутнение раствора:
Ca(OH)2 + CO2 ⟶ CaCO3↓ + H2O
Ca 2+ + 2OH — + CO2 ⟶ CaCO3↓ + H2O
При дальнейшем пропускании выделяющегося газа мутный раствор становится прозрачным. Это связано с тем, что нерастворимый карбонат кальция, при взаимодействии с углекислым газом, превращается в растворимый гидрокарбонат кальция:
CaCO3 + H2O + CO2 ⟶ Ca(HCO3)2
CaCO3 + H2O + CO2 ⟶ Ca 2+ + 2HCO3 —
При добавлении лакмуса в дистиллированную воду, через которую пропускали углекислый газ, наблюдается окрашивание в красный цвет. Это объясняется тем, что углекислый газ реагирует с водой с образованием слабой угольной кислоты:
H2O + CO2 ⇄ H2CO3
При добавлении фенолфталеина раствор гидроксида натрия, наблюдается окрашивание раствора в малиновый цвет. При пропускании углекислого газа через этот раствор, происходит его обесцвечивание. Это связано с тем, что гидроксид натрия вступает в реакцию с углекислым газом:
2NaOH + CO2 ⟶ Na2CO3 + H2O
2Na + + 2OH — + CO2 ⟶ 2Na + + CO3 2- + H2O
2OH — + CO2 ⟶ CO3 2- + H2O
Распознавание карбонатов.
В начале добавить соляной кислоты, в пробирке с карбонатом калия выделится газ: K2CO3 + 2HCl ⟶ 2KCl + H2O + CO2↑
В оставшиеся две пробирки добавить хлорид бария, в пробирке с сульфатом натрия образуется осадок белого цвета: Na2SO4 + BaCl2 ⟶ 2NaCl + BaSO4↓
В последнюю пробирку добавить гидроксид натрия, если там находится хлорид цинка, то выпадет белый осадок:
ZnCl2 + 2NaOH ⟶ 2NaCl + Zn(OH)2↓
Качественной реакцией на карбонат-ионы, является взаимодействие с кислотой, в результате реакции образовывается углекислый газ.
Источник
Углекислый газ пропустили через известковую воду реакция
§ 66. Кальций
Химический знак — Са. Порядковый номер — 20.
Атомный вес — 40. Строение атома:
По химической активности и другим химическим свойствам больше всего к щелочным металлам должны приближаться элементы, соседние с ними в периодической системе, образующие главную подгруппу II группы, особенно с большими порядковыми номерами, вследствие этого большими размерами атомов и особенно» слабой связью внешних, или валентных, электронов. От атома соседнего щелочного металла атомы элементов рассматриваемого семейства отличаются лишней единицей положительного заряда ядра и добавочным электроном во внешнем слое. Отдавая оба валентных электрона, они обращаются в двукратно положительно заряженные ионы, поэтому во всех соединениях положительно двухвалентны. В качестве представителя таких металлов рассмотрим кальций.
Отдавая внешние электроны, атом кальция превращается в ион Са 2+ . Во всех своих соединениях кальций положительно двухвалентен.
Кальций — легкий металл серебристо-белого цвета. Если кусочек кальция нагреть, он сгорает пламенем кирпично-красного цвета с образованием белого дыма. Этот дым образован тончайшими твердыми частичками окиси кальция СаО:
Будучи брошен в воду, кальций реагирует с нею, превращаясь в гидроокись кальция и вытесняя из воды водород:
Фенолфталеин в полученном растворе окрашивается в малиновый цвет. Так оправдывается ожидаемое сходство кальция с щелочными металлами: он, как и щелочные металлы, взаимодействует с водой с выделением водорода. Его гидроокись, как и гидроокиси щелочных металлов, растворима в воде, т. е. представляет собой щелочь.
Окись кальция. Окись кальция получают в промышленности обжигом известняка:
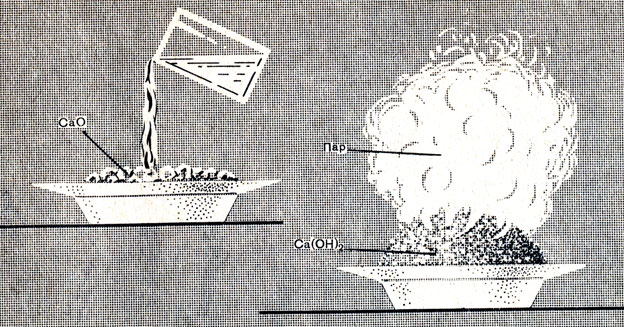
Окись кальция — тугоплавкое вещество. При смешивании с водой она соединяется с ней с выделением такого большого количества теплоты, что вода закипает. Куски окиси кальция, впитывая воду, разбухают и рассыпаются (рис. 53), превращаясь в тонкий рыхлый порошок гидроокиси кальция:
Рис. 53. Гашение извести
В производстве эта реакция называется гашением извести, окись кальция — негашеной известью, а гидроокись кальция — гашеной известью.
Окись кальция, как основной окисел, связывает двуокись углерода, превращаясь в карбонат кальция:
Гидроокись кальция. Гидроокись кальция немного растворима в воде. Ее водный раствор называется известковой водой. В ней гидроокись кальция полностью диссоциирована на ионы:
Если бросить в воду больше гидроокиси кальция, чем ее может раствориться, то получается белая суспензия частиц гидроокиси кальция в известковой воде — известковое молоко.
Тестообразная смесь гидроокиси кальция с водой, в которую для увеличения объема добавляется песок, применяют в строительстве для скрепления кирпичей и оштукатуривания стен. С течением времени, поглощая из воздуха двуокись углерода, смесь «схватывается», затвердевая в столь прочную массу, что при ломке старых зданий трещины проходят через кирпичи, а не по связывающим их прослойкам. Уравнение реакции «схватывания»:
Карбонат кальция. Прибавим к известковой воде фенолфталеин (раствор окрасится в малиновый цвет) и будем пропускать в раствор из аппарата Киппа углекислый газ. Прозрачный раствор мутнеет от выделения нерастворимого в воде карбоната кальция СаСО3:
Когда фенолфталеин обесцветится, реакция закончилась. Вся щелочь израсходовалась, ионов ОН — в растворе не осталось.
Продолжим опыт. Будем и далее пропускать углекислый газ. Муть исчезает. Следовательно, карбонат кальция превратился в другое соединение, растворимое в воде. Каков его состав?
Углекислый газ, соединяясь с водой, образует угольную кислоту:
Эта кислота реагирует с карбонатом кальция:
Образуется растворимый в воде бикарбонат кальция, раствор становится прозрачным. Ионное уравнение реакции:
Нагреем полученный раствор бикарбоната кальция. Он опять становится мутным, так как происходит обратная реакция, при которой образуется карбонат кальция:
или в ионной форме .
Эти реакции играют большую роль в природе. Дождевая вода растворяет углекислый газ и, просачиваясь через почву, взаимодействует с известняком, растворяя его в виде бикарбоната. Особенно энергично эта реакция протекает в толщах известняковых пород. При выходе такой воды на поверхность и испарении ее вновь выпадает карбонат кальция.
Эти реакции приводят к образованию пещер и возникновению в них причудливых сталактитов (рис. 54).
Рис. 54. Сталактиты
Гипс. Из солей кальция, кроме карбоната, представляет большой интерес гипс CaSO4*2H2O. При не слишком сильном нагревании гипс выделяет 3А кристаллизационной воды и превращается в белый порошок полуводного гипса (CaSO4)2*H2O.
При смешивании такого порошка с водой происходит обратная реакция
Смесь полуводного гипса с водой (густоты сметаны) вследствие этого затвердевает. Это используют на практике: из гипса делают лепные украшения, статуэтки. В смеси с гашеной известью полуводный гипс применяют для штукатурки стен; в хирургии его применяют для накладывания гипсовых повязок, которые удерживают кости в правильном положении, пока они не срастутся.
Гипс немного растворим в воде. С повышением температуры свыше 60°С растворимость гипса не возрастает, а уменьшается. Поэтому в чайниках возможно осаждение гипса в виде накипи.
- Сравните свойства кальция (в свободном состоянии) со свойствами А щелочных металлов. Приведите уравнения соответствующих реакций в молекулярной и сокращенной ионной форме. Почему кальций — легкий и прочный металл — не применяется для производства самолетов?
- Опишите свойства окиси кальция. Почему строители называют ее «кипелкой»? Как она получается в промышленности?
- Опишите свойства гидроокиси кальция. Почему строители называют ее «пушонкой»?
- Опишите свойства и применение гипса.
- Вы получили известковую воду и желаете ее сохранить до следующего урока химии. Как это сделать?
- * Известковую воду разделили на две одинаковые порции. Через одну пропускали углекислый газ, пока выпавший осадок не растворился, затем обе порции вновь слили. Что должны наблюдать при этом? Будет ли полученная взвесь обладать электропроводностью? Напишите уравнения реакций в молекулярной и ионной формах.
- Какое превращение испытывает гашеная известь в домах-новостройках и почему пока это превращение не закончится, здание остается сырым?
- Напишите уравнения реакций, при помощи которых можно осуществить следующие переходы:
Источник
Углекислый газ пропустили через известковую воду реакция
Через 925 г известковой воды (раствора гидроксида кальция) с массовой долей растворённого вещества 1% пропустили углекислый газ до образования осадка карбоната кальция. Вычислите объём (н.у.) затраченного на реакцию газа.
Это задание ещё не решено, приводим решение прототипа.
Через 80 г раствора гидроксида натрия с массовой долей растворённого вещества 10% пропустили углекислый газ до образования карбоната натрия. Вычислите объём (н.у.), затраченного на реакцию газа.
1. Составим уравнение реакции:
2. Рассчитаем массу и количество вещества прореагировавшего гидроксида натрия:
= 80 г · 0,1 = 8 г;
= 8 г : 40 г/моль = 0,2 моль.
3. Определим количество вещества и объём затраченного на реакцию углекислого газа:
= 0,1 моль;
= 0,1 моль · 22,4 л/моль = 2,24 л.
Аналоги к заданию № 2550: 2609 3407 4180 4241 4685 Все
Источник
Углекислый газ пропустили через известковую воду реакция
§ 66. Кальций
Химический знак — Са. Порядковый номер — 20.
Атомный вес — 40. Строение атома:
По химической активности и другим химическим свойствам больше всего к щелочным металлам должны приближаться элементы, соседние с ними в периодической системе, образующие главную подгруппу II группы, особенно с большими порядковыми номерами, вследствие этого большими размерами атомов и особенно» слабой связью внешних, или валентных, электронов. От атома соседнего щелочного металла атомы элементов рассматриваемого семейства отличаются лишней единицей положительного заряда ядра и добавочным электроном во внешнем слое. Отдавая оба валентных электрона, они обращаются в двукратно положительно заряженные ионы, поэтому во всех соединениях положительно двухвалентны. В качестве представителя таких металлов рассмотрим кальций.
Отдавая внешние электроны, атом кальция превращается в ион Са 2+ . Во всех своих соединениях кальций положительно двухвалентен.
Кальций — легкий металл серебристо-белого цвета. Если кусочек кальция нагреть, он сгорает пламенем кирпично-красного цвета с образованием белого дыма. Этот дым образован тончайшими твердыми частичками окиси кальция СаО:
Будучи брошен в воду, кальций реагирует с нею, превращаясь в гидроокись кальция и вытесняя из воды водород:
Фенолфталеин в полученном растворе окрашивается в малиновый цвет. Так оправдывается ожидаемое сходство кальция с щелочными металлами: он, как и щелочные металлы, взаимодействует с водой с выделением водорода. Его гидроокись, как и гидроокиси щелочных металлов, растворима в воде, т. е. представляет собой щелочь.
Окись кальция. Окись кальция получают в промышленности обжигом известняка:
Окись кальция — тугоплавкое вещество. При смешивании с водой она соединяется с ней с выделением такого большого количества теплоты, что вода закипает. Куски окиси кальция, впитывая воду, разбухают и рассыпаются (рис. 53), превращаясь в тонкий рыхлый порошок гидроокиси кальция:
Рис. 53. Гашение извести
В производстве эта реакция называется гашением извести, окись кальция — негашеной известью, а гидроокись кальция — гашеной известью.
Окись кальция, как основной окисел, связывает двуокись углерода, превращаясь в карбонат кальция:
Гидроокись кальция. Гидроокись кальция немного растворима в воде. Ее водный раствор называется известковой водой. В ней гидроокись кальция полностью диссоциирована на ионы:
Если бросить в воду больше гидроокиси кальция, чем ее может раствориться, то получается белая суспензия частиц гидроокиси кальция в известковой воде — известковое молоко.
Тестообразная смесь гидроокиси кальция с водой, в которую для увеличения объема добавляется песок, применяют в строительстве для скрепления кирпичей и оштукатуривания стен. С течением времени, поглощая из воздуха двуокись углерода, смесь «схватывается», затвердевая в столь прочную массу, что при ломке старых зданий трещины проходят через кирпичи, а не по связывающим их прослойкам. Уравнение реакции «схватывания»:
Карбонат кальция. Прибавим к известковой воде фенолфталеин (раствор окрасится в малиновый цвет) и будем пропускать в раствор из аппарата Киппа углекислый газ. Прозрачный раствор мутнеет от выделения нерастворимого в воде карбоната кальция СаСО3:
Когда фенолфталеин обесцветится, реакция закончилась. Вся щелочь израсходовалась, ионов ОН — в растворе не осталось.
Продолжим опыт. Будем и далее пропускать углекислый газ. Муть исчезает. Следовательно, карбонат кальция превратился в другое соединение, растворимое в воде. Каков его состав?
Углекислый газ, соединяясь с водой, образует угольную кислоту:
Эта кислота реагирует с карбонатом кальция:
Образуется растворимый в воде бикарбонат кальция, раствор становится прозрачным. Ионное уравнение реакции:
Нагреем полученный раствор бикарбоната кальция. Он опять становится мутным, так как происходит обратная реакция, при которой образуется карбонат кальция:
или в ионной форме .
Эти реакции играют большую роль в природе. Дождевая вода растворяет углекислый газ и, просачиваясь через почву, взаимодействует с известняком, растворяя его в виде бикарбоната. Особенно энергично эта реакция протекает в толщах известняковых пород. При выходе такой воды на поверхность и испарении ее вновь выпадает карбонат кальция.
Эти реакции приводят к образованию пещер и возникновению в них причудливых сталактитов (рис. 54).
Рис. 54. Сталактиты
Гипс. Из солей кальция, кроме карбоната, представляет большой интерес гипс CaSO4*2H2O. При не слишком сильном нагревании гипс выделяет 3А кристаллизационной воды и превращается в белый порошок полуводного гипса (CaSO4)2*H2O.
При смешивании такого порошка с водой происходит обратная реакция
Смесь полуводного гипса с водой (густоты сметаны) вследствие этого затвердевает. Это используют на практике: из гипса делают лепные украшения, статуэтки. В смеси с гашеной известью полуводный гипс применяют для штукатурки стен; в хирургии его применяют для накладывания гипсовых повязок, которые удерживают кости в правильном положении, пока они не срастутся.
Гипс немного растворим в воде. С повышением температуры свыше 60°С растворимость гипса не возрастает, а уменьшается. Поэтому в чайниках возможно осаждение гипса в виде накипи.
- Сравните свойства кальция (в свободном состоянии) со свойствами А щелочных металлов. Приведите уравнения соответствующих реакций в молекулярной и сокращенной ионной форме. Почему кальций — легкий и прочный металл — не применяется для производства самолетов?
- Опишите свойства окиси кальция. Почему строители называют ее «кипелкой»? Как она получается в промышленности?
- Опишите свойства гидроокиси кальция. Почему строители называют ее «пушонкой»?
- Опишите свойства и применение гипса.
- Вы получили известковую воду и желаете ее сохранить до следующего урока химии. Как это сделать?
- * Известковую воду разделили на две одинаковые порции. Через одну пропускали углекислый газ, пока выпавший осадок не растворился, затем обе порции вновь слили. Что должны наблюдать при этом? Будет ли полученная взвесь обладать электропроводностью? Напишите уравнения реакций в молекулярной и ионной формах.
- Какое превращение испытывает гашеная известь в домах-новостройках и почему пока это превращение не закончится, здание остается сырым?
- Напишите уравнения реакций, при помощи которых можно осуществить следующие переходы:
Источник