- Химия, Биология, подготовка к ГИА и ЕГЭ
- Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и гомологов бензола, стирола)
- Содержание:
- Предельные углеводороды
- Химические свойства алканов
- Химические и физические свойства циклоалканов
- Непредельные углеводороды
- Химические и физические свойства алкенов
- Химические и физические свойства диенов
- Химические и физические свойства алкинов
- Ароматические углеводороды
- Химические и физические свойства бензола
- Химические и физические свойства гомологов бензола
- Химические и физические свойства стирола
Химия, Биология, подготовка к ГИА и ЕГЭ
Вопрос А14 ЕГЭ по химии
Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и толуола)
Темы, которые нужно знать:
В лекциях по каждому классу веществ мы подробно рассматривали химические свойства и качественные реакции. Здесь мы рассмотрим именно те химические свойства углеводородов, на которые стоит обратить внимание, т.к. они часто встречаются в вопросах ЕГЭ.
| Углеводороды | Характерные химические реакции | Обратить внимание! |
| Алканы |
| |
| Галогеналканы | Характерные химические свойства
| Правило Зайцева:
СH3-CH Cl -C H 2-СH3 → СH3-CH = CH—СH3+ HCl Взаимодействие с щелочами: (среда реакции оказывает влияние на продукты)
|
| Алкены | Правило Марковникова:
Окисление алкенов:
| |
| Алкины | Характерные химические свойства — реакции присоединения:
| Реакция присоединения воды — с образованием альдегидов и кетонов: СH ≡ CH + H2O (Hg 2+ )= CH3CHO (альдегид) СH≡C-СH3 + H2O (Hg 2+ ) = СH3-C(=O)-СH3 (кетон) Реакции окисления алкинов -идут с разрывом тройной связи: С4H6+ [O] → 2CH3COOH |
| Алкадиены | Характерные химические свойства — реакции присоединения (как у алкенов) и полимеризации | |
| Циклоалканы | Характерные химические свойства — реакции замещения:
| Циклопропан и циклобутан вступают в реакции присоединения с раскрытием цикла: Окисление циклоалканов: цикл разрывается и по концам образуется группа -COOH: C5H10 + [O] → HOOC-(CH2)3-COOH |
| Бензол и его гомологи | У гомологов бензола направление реакции замещения зависит от катализатора: Окисление аренов: бензол не окисляется . любые гомологи бензола окисляются до бензойной кислоты: C7H8 + [O] = C6H5COOH |
Кстати, ответы на наши вопросы:
А14 1 вариант: в отличие от пропена пропин взаимодействует с аммиачным раствором оксида серебра
Ответ: 1)
А14 2 вариант: кетон образуется при гидратации пропина
Источник
Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и гомологов бензола, стирола)
Содержание:
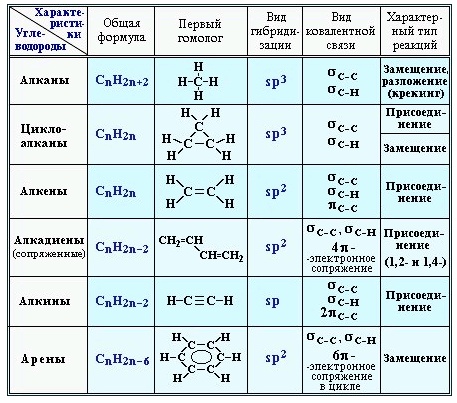
Углеводороды – это органические соединения, которые состоят из углерода и водорода (иногда замещается на группы). Существует огромное количество углеводородов и для них существует множество классификаций.
По составу углеродного скелета делятся на:
- ациклические (алифатические) – определяются по числу атомов, с которыми связан углерод;
- циклические – имеют замкнутую цепь:
- карбоциклические – в цикле присутствуют только атомы углерода,
- гетероциклические – присутствуют не только атому углерода.
По наличию кратных связей и открытости цепи:
- предельные – не имеют кратных связей:
- алканы,
- циклоалканы.
- непредельные – имеют кратные связи:
- алкены,
- диены,
- алкины.
- ароматические – имеют бензольное кольцо:
- бензол,
- гомологи бензола,
- арены.
Предельные углеводороды
Химические свойства алканов
Алканы (парафины) – это соединения, для которых характерна sp 3 -гибридизация и наличие только σ-связи. Используются как источник энергии в промышленности и помощник в получении белка в микробиологии.
I. Реакции замещения
Эти реакции сопровождаются гомолитическим разрывом, который начинается в неорганических молекулах.
Реакции замещения являются основным типом реакций, которые характерны для молекул алканов. В связи с высокой энергией ионизации в молекуле алканов очень насыщенные связи, из –за чего химическое взаимодействие затруднено. Общим для реакций замещения являются жесткость условий и наличие сильных окислителей.
В ходе взаимодействия с хлором или бромом получается взрывчатое вещество, имеющее практическое значение. Взаимодействие с фтором провоцирует взрыв, не имеющее промышленного отклика. А реакция с йодом протекает очень медленно, поэтому редко проводится.
Идет под воздействием света.
Замещение водорода проходит у наименее гидрированного атома углерода.
1888 год – Коновалов открыл реакцию взаимодействия алканов с азотной кислотой (13-14 %) под воздействием температуры в 140°С. Она используется для производства ракетного топлива и взрывчатых веществ.
Эту реакцию используют при мыловарении и в производстве синтетических моющих средств.
II. Реакции с разрывом углерод-углеродной связи
Энергия связи «углерод-углерод» высокая, поэтому она достаточно прочная. Реакций, сопровождающихся разрывом этой связи, немного и все они проходят в жестких условиях.
При нормальных условиях алканы не реагируют с сильными окислителями, такими как серная кислота, перманганат или дихромат калия.
Алканы горят бесцветным или голубоватым пламенем. У метана, этана, пропана, бутана и пентана копоть не наблюдается, а у соединений с длинными углеродными цепями она есть.
Идет в присутствии катализатора.
Это химический процесс, протекающий при действии высоких температур. В результате углеродная цепь рвется, и образуются молекулы алкана и алкена.
Крекинг бывает: термическим; каталитическим.
Для каталитической реакции используются катализаторы и меньшие температуры.
III. Реакции с разрывом углерод-водородной связи
Алканы – это вещества, с помощью которых можно получить соединения с кратными связями.
Отщепление водорода осуществляется в присутствии катализаторов и при высоких температурах.
При дегидрировании алканов с длинными углеродными цепями образуются алкены.
Нагревание линейных алканов с катализатором провоцирует образование веществ с разветвленным углеродным скелетом.
Из алканов получают топливо, которое широко используют в микробиологии, биотехнологиях, органическом синтезе.
Химические и физические свойства циклоалканов
Циклоалканы (нафтены) – это насыщенные циклические углеводороды. Циклоалканы по физическим свойствам схожи с линейными алканами. Циклопропан и циклобутан – это газы, а начиная с циклопентана – жидкости с температурой кипения и плотностью выше, чем у соответствующих парафинов. Не растворяются в воде, но растворимы в эфирах.
I. Реакции присоединения
Реакционная способность зависит от размера цикла. Низшие циклоалканы напоминают алкены, а высшие – алканы.
Действие галогена различно в зависимости от условий.
- Малые циклы под действием света
Малые циклы в нормальных условиях
Средние циклы под воздействием света (реакция замещения)
Взаимодействие с галогеноводородами
Реакция протекает в водном растворе.
В случае несимметричных молекулах соблюдается правило Марковникова.
Реакция проходит при высоких температурах и под действием таких катализаторов как никель, платина.
II. Дегидрирование
Высокие температуры (500°С) по-разному действуют на малые и большие циклы.
III. Горение
Устойчивость к окислителям повышается по гомологическому ряду.
Циклоалканы содержатся в нефтяных продуктах, и вырабатывается некоторыми видами растений. В природе они способны подвергаться микробиологическому окислению.
Непредельные углеводороды
Химические и физические свойства алкенов
Алкены (этиленовые углеводороды) – органические соединения, содержащие одну двойную связь. Температура плавления и кипения увеличивается по гомологическому ряду. При нормальных условиях с этена по бутен – газы, с пентена по гептадецен – жидкости, а далее твердые вещества. Они не растворяются в воде, но растворимы в эфирах.
π- связь менее прочная, чем σ-связь. Это связано с тем, что у негибридных облаков глубина перекрывания меньше. Для алкенов наиболее характерны реакции присоединения. Кроме того, алкены – это доноры электронов и их рассматривают как основания Льюиса.
I. Реакции присоединения
Электроны π-связи находятся вне плоскости, поэтому они более доступны для атакующей электрофильной частицы.
Реакция протекает под воздействием температуры и катализатора никеля.
Реакционная способность уменьшается в ряду HJ-HBr-HCl-HF. В этих реакциях действует правило Марковникова. Он утверждал, что при взаимодействии галогеноводородов или воды с несимметричными алкенами, водород присоединяется к более гидрированному атому углерода, а галоген – к менее.
Правило имеет несколько исключений.
- Перекисный эффект Карыша.
Реакция подразумевает присоединение бромоводорода в присутствии перекиси водорода.
Присутствие в молекуле алкена электроно-акцепторных функциональных групп в sp 3 -части.
Спирты образуются при присоединении алкенов с водой в присутствии серной кислоты, высоких температурах и при оксиде алюминия.
II. Реакции полимеризации
Полимер – это соединение, состоящее из множества мономеров. Полимеризация не приводит к изменению качественного и количественного состава мономеров. Получение полиэтилена из этена имеет цепной или ступенчатый характер.
III. Реакции замещения (галогенирование)
Реакции замещения водорода могут проходить и у непредельных алкенов, но в их sp 3 -части. Проходят при жестких условиях – температура свыше 500°С.
IV. Окисление
Идет легко и образует разные продукты в зависимости от условий.
Алкены горят желтым светящимся пламенем.
Осуществляется в нейтральной среде при окислении с помощью перманганата калия. В результате образуются диолы, причем гидроксильные группы присоединяются к атомам углерода кратной связи.
Проходит в кислой среде. При окислении с помощью кипящего раствора перманганата калия происходит полное разрушение кратной связи, и атомы углероды способны создать карбоновую кислоту или углекислый газ.
В симметричной молекуле алкена образуется две молекулы одной и той же кислоты.
Если в соединении при кратной связи содержится два углеродных заместителя, то при окислении происходит образование кетона.
Жесткое окисление проходит и в щелочной среде.
Те же реакции проходят в присутствии дихромата калия.
Алкены – это исходный продукт в производстве полимеров и других органических веществ.
Химические и физические свойства диенов
Алкадиены – это органические соединения, имеющие две двойные связи. Существует несколько видов диенов:
- с кумулированными связями – примыкают к одному углеродному атому — СН2=С=СН2;
- с изолированными связями – разделены одном атомом углерода – СН2=СН-СН2-СН-СН2;
- с конъюгированными связями – разделены одной одинарной связью – СН2=СН-СН-СН2.
В нормальных условиях пропадиен и бутадиен-1,3 являются газами, а изопрен – летучей жидкостью. Алкадиены с изолированными связями – жидкости. Высшие диены находятся в твердом состоянии.
I. Реакции присоединения
У кумулированых и изолированных сначала взаимодействует с реагентом одна связь, а затем другая. А у сопряженных кратные связи образуют единую систему в центре молекулы, при этом параллельно идет процесс присоединения.
CH2=CH-CH=CH2 + Br2 → Br-CH2-CH=CH-CH2-Br С помощью этой реакции обесцвечивание бромная вода.
Реакция идет при нагревании в 60°С.
II. Полимеризация
В процессе этих реакций образуются эластомеры (синтетические каучуки). Проводится в присутствии натрия.
Алкадиены могут обесцвечивать раствор перманганата калия.
Из диенов получают каучуки, из которых производят резину различных марок.
Химические и физические свойства алкинов
Алкины – это органические соединения, имеющие одну тройную связь. По гомологическому ряду температура плавления и кипения увеличивается. В нормальных условиях этин, пропин, бутин – газы, с пентина по гексадецентин – это жидкости, а далее, по увеличению молекулярной массы, — твердые вещества. Температуры кипения у алкинов выше, чем у соответствующих алкенов. Плохо растворяются в воде, хорошо – в органических растворителях.
I. Реакции присоединения
В процессе реакции присоединение происходит сначала по одной π-связи, а затем по другой. Идут по механизмам электрофильного и нуклеофильного присоединения.
Электрофильное присоединение
Идет под действием катализатора никеля.
CH≡CH + Cl2 → Cl-CH=CH-Cl
Cl-CH=CH-Cl + Cl2 → Cl-CH(Cl)-CH(Cl)-Cl
Гидратация (реакция Кучерова)
Вышеперечисленные реакции могут подразумевать как присоединение одной молекулы, так и нескольких. В гидратации возможно присоединение только одной молекулы воды. Реакция Кучерова проходит при температуре в 70°С и катализатора в виде сульфата ртути.
Нуклеофильное присоединение
- Присоединение синильной кислоты
Проходит в присутствии меди в аммиачном растворе.
Присоединение уксусной кислоты
II. Полимеризация
Протекает в присутствии солей меди и повышенных температурах.
Тримеризация (реакция Зелинского)
Протекает в присутствии активированного углерода и температурах свыше 500°С. 3
III. Реакции замещения
Замещение происходи у водорода, стоящего при углероде с кратной связью.
- Взаимодействие с амидом натрия
Взаимодействие с аммикатами серебра или одновалентной медью
Получающиеся соединения взрывоопасны. Чтобы их нейтрализовать, необходимо залить их соляной кислотой.
IV. Окисление
Этин горит с большим выделением тепла.
В нейтральной и слабощелочной средах образуются соли щавелевой кислоты , а окисление гомологов провоцирует разрыв тройной связи с образование солей карбоновых кислот.
3 CH≡CH + 8 KMnO4 → 3 KOOC-COOK + 8MnO2 + 2 KOH + 2 H2O
В кислой среде окислитель расщепляет кратную связь с образованием карбоновых кислот.
Только ацетилен используется в промышленности, и именно он является важным химическим сырьем.
Ароматические углеводороды
Химические и физические свойства бензола
Наличие ароматического кольца влияет на характер химических реакций. Единая 6π-система электронов устойчива, поэтому ароматическим углеводородам характерны реакции электрофильного замещения.
Бензол – это бесцветная жидкость, имеющая резкий запах. Горит сильно коптящим пламенем. Образует с воздухом взрывчатые смеси.
I. Реакции замещения
Все эти реакции протекают по механизму бимолекулярного нуклеофильного замещения.
II. Реакции присоединения
Протекают только в жестких условиях. Присоединяться способны только богатые энергией реагенты.
Идет под воздействием температуры и катализаторов в виде платины.
Галогенирование под воздействием света
При нормальных условиях азотная кислота, хромовая кислота и др. не могут окислить бензол. Он окисляется только в жестких условиях под действием кислорода, катализатора оксида ванадия и при температуре в 450°С.
Химические и физические свойства гомологов бензола
У гомологов бензола такие же физические свойства, что и у самого бензола. Во многом и химические свойства схожи.
I. Электрофильное замещение Радикалы гомологов бензола повышают электронную плотность на кольце в орто- и параположениях.
Катализатор – хлорид алюминия.
Нитрование в ядро
Сульфирование в ядро
Алкилирование в ядро
II. Реакции по боковой цепи
Осуществляется в присутствии света. Принцип замещения схож с реакцией алканов.
В отличие от бензола его гомологи способны вступать в реакции окисления.
Окисление дизамещенных гомологов происходит по такому же принципу.
Получение непредельных соединений
Реакция проходит под действием оксида цинка.
Химические и физические свойства стирола
Стирол – это бесцветная жидкость, имеющая резкий запах. Плохо растворяется в воде, но хорошо в органических растворителях.
I. Реакции присоединения
Стирол обесцвечивает бромную воду. Реакция идет не по бензольному кольцу, а по виниловой группе.
II. Полимеризация
В ходе реакции образуется полистирол – твердая стекловидная масса.
При производстве полимеров активно используется стирол. На его основе создаются полистирол, пенопласт, пластики.
Источник