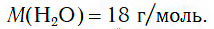Физические, химические и газовые свойства воды
Вода это естественная среда обитания гидробионтов (рыб, водорослей, микроорганизмов, растений). Вода имеет химические, газовые и физические свойства. Эти свойства имеют огромное значение для содержания и размножения рыб и растений в вашем аквариуме.
Биологическое равновесие это такое состояние воды, при котором продукты жизнедеятельности, успевают разрушаться естественным путем, не принося вред ее обитателям, но при этом физическое состояние не изменяется. Именно по этому необходимо создать правильное биологическое равновесие при запуске аквариума и дальнейшего ухода.
К физическим свойствам относится запах, цвет, температура. Физические свойства должны быть естественными, т.е. вода должна иметь определенный оттенок, не быть коричневой или зеленой, иметь затхлый запах, что свидетельствует о появлении большого количества бактерий.
При биологическом балансе вода в аквариуме должна быть прозрачной, запах должен напоминать ароматом свежескошенной травы.
И так если с физическими свойствами все понятно и их возможно исправить обычной уборкой аквариума, фильтра, промывкой грунта, а так же подменой воды, расселением (если у вас перенаселение), то с химическими не так все просто.
Химические свойства воды это, прежде всего активная реакция рН, и ее жесткость, а затем уже наличие металлов (меди) и др. таблицы Менделеева.
Нейтральная вода имеет рН 7.0., в такой воде одинаково щелочи и кислоты, или их отсутствие. Если показатель больше, то это увеличение щелочи или меньше то это увеличение кислоты. В аквариумах этот показатель варьируется от 4.5. до 9.0. все зависит от региона, в котором вы проживаете и берете воду из крана. Эти данные проверяются индикаторами (тест полосками, но есть и электронные).
Для каждого вида рыб необходим свой оптимальный уровень рН, именно поэтому их указывают в статье как правильно ухаживать за рыбками того или иного вида. Ели показатель не соответсвует рекомендованным параметрам или он отклонился его можно изменить и подогнать под необходимый. Но делать это постепенно, ежедневно увеличивая или уменьшая на 0.3.
Для подкисления, т.е. уменьшения показателя необходимо добавить дигидрофосфат калия или натрия 50г. на 100 литров. Для подщелачивания, т.е. увеличения показателя применяют пищевую соду 15 г. на 100 литров. Замеры рекомендую производить каждый месяц.
Кроме уровня рН для обитателей имеет важную роль и жесткость. Жесткость зависит от растворенных в воде окиси кальция. Это легко заметить на чайнике, где имеется белый налет. Что говорит о повышенной жесткости воды. Также можно проверить мылом, при жесткой, вода плохо мылиться и плохо создается пена, при мягкой образуется очень густая мыльная пена.
Жесткость делится на общую dH, и временную КН, измеряется в молях для России и градусах для Европы. 1ммоль\л говорит нам о наличии в одном литре воды 10 мг. СаО измеряется с помощью специальных градусников или тестов.
Сильно мягкая вода 0-1.42 ммоль или 0-4°
Мягкая вода 1.43-3.57 ммоль или 5-10°
Средняя жесткость воды 3.58-6.42 ммоль или 11-18°
Жесткая вода 6.43-10.71 ммоль или 19-30°
Сильно жесткая вода свыше 10.72 ммоль или 30°
Как и рН жесткость можно подогнать под определенный вид рыб или для нереста с помощью дистилляции или добавления дистиллированной воды, а также обработкой щавелевой, фосворной кислотой или известью. Но самым простым способом является заморозка воды до состояния льда, которую потом размораживают. При этом нельзя взбалтывать осадок и выливать с ним, или кипячение воды 15-20 минут. Если необходимо увеличить жесткость что мало вероятно с нашим то водопроводом, то добавляют 1 мл. 25% раствор магнезии на литр воды, это увеличит жесткость на 1.42 ммоль или 4°. Если добавить 1 мл. 10% раствора хлористого калия это увеличит жесткость на 1.07 ммоль или 3°.
Кроме вышеперечисленных характеристик существует еще и газовая, это способность воды растворять вещества твердые и газообразные. Основные 5 газов находящиеся постоянно в аквариуме это кислород, углерод, азот, хлор, метан.
Наличие кислорода измеряется электронным оксиометром, показатель должен быть выше 5 мг.л.
Содержание углерода должно быть не выше 2 мг.л..
Азот важен не только для людей но и рыб, и растений при фотосинтезе. С увеличением температуры происходит уменьшение концентрации азота.
Хлор это отрава для всего живого, он добавляется службами для обеззараживания водопроводной воды, именно поэтому нельзя наливать воду из под крана сразу в аквариум. Необходимо отстоять воду не меньше 5 дней, после чего хлор начинает улетучиваться.
Метан как и хлор вреден для рыб, его выводят водоросли кубышки и аэрация воды.
В заключении хочется сказать что благоприятные условия для рыбок это прежде всего правильные характеристики воды, а уже потом освещение и имитация природного ландшафта.
Если понравилась статья, палец вверх, по возможности сделай репост, он важен для развития канала. Подписывайтесь на канал, публикации выходят каждый день. Оставляйте комментарии.
Источник
Научная электронная библиотека
Шишелова Т И, Корзун Н Л, Толстой М Ю,
1.1. Физические свойства воды
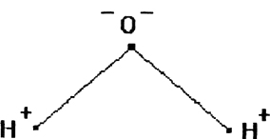
Физические свойства в полной мере изложены во многих работах. Вода (Н2O) – простейшее устойчивое химическое соединение водорода с кислородом, бесцветная жидкость с температурой кипения 100 °С. Химическая формула воды такая простая: Н2О; Н–О–Н [1–8]. Размер одной молекулы воды составляет около 3 Å (ангстрем) или примерно 0,28 нм (нанометра).
Рис. 1. Схема строения
молекулы воды
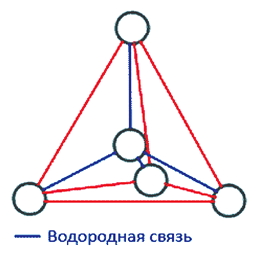
Рис. 2. Тетраэдрическая структура молекулы воды
Вода состоит из одного относительно большого атома кислорода и двух небольших атомов водорода, вокруг которого вращается облачко общих отрицательно заряженных электронов (рис. 1). Угол H–O–H молекулы H2O в газообразном и жидком виде колеблется от 104,5 до 109°
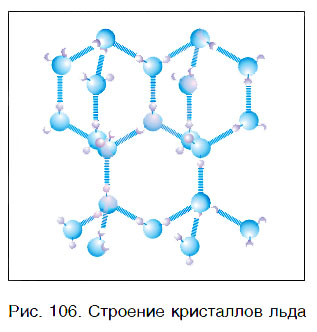
Во льду все молекулы связаны между собой водородными связями. При этом четыре связи каждой молекулы локально организованы в тетраэдрическую структуру, четыре близлежащие молекулы располагаются в вершинах трехгранной пирамиды, в центре которой находится пятая молекула
воды (рис. 2).
Положительно заряженное ядро атома кислорода, ввиду своей большой массы и заряда, сильнее притягивает к себе электронное облачко, оголяя при этом ядра водорода.
Три ядра в молекуле воды образуют равнобедренный треугольник с двумя протонами водорода в основании и кислородом в вершине. Расстояние O–H 0,9568 Å (0,1 нм); H–H – 1,54 Å (0,15 нм). Модель молекулы воды, предложенная Нильсом Бором [9], показана на рис. 3.
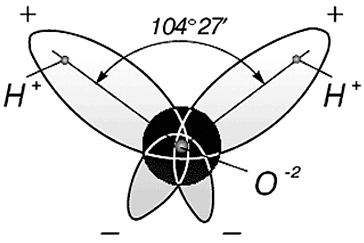
Рис. 3. Строение молекулы воды, предложенное Н. Бором [9]:
а – угол между связями H–H;
б – внешний вид электронного облака молекулы воды
Свойства воды в основном зависят от водородных связей. Из-за большой разности электроотрицательности атомов водорода и кислорода электронные облака сильно смещены в сторону кислорода. По причине этого, а также того, что ион водорода не имеет внутренних электронных слоев и обладает малыми размерами, он может проникать в электронную оболочку отрицательно поляризованного атома соседней молекулы. Благодаря этому каждый атом кислорода притягивается к атомам водорода других молекул и наоборот.
Каждая молекула воды может участвовать максимум в четырех водородных связях: два атома водорода – каждый в одной, а атом кислорода – в двух; в таком состоянии молекулы находятся в кристалле льда. При таянии льда часть связей рвется, что позволяет уложить молекулы воды плотнее; при нагревании воды связи продолжают рваться, и плотность ее растет, но при температуре выше 4 °С этот эффект становится слабее. При испарении рвутся все оставшиеся связи. Разрыв связей требует много энергии, отсюда высокая температура и удельная
теплота плавления и кипения и высокая теплоемкость. Вязкость воды обусловлена тем, что водородные связи мешают молекулам воды двигаться с разными скоростями. Строение электронного облака молекулы воды таково, что во льду каждая молекула связана четырьмя водородными связями с ближайшими к ней молекулами, координационное число молекул в структуре льда равно четырем. О размере молекулы можно судить по величине расстояния между ближайшими молекулами во льду, составляющего 2,67 Å (0,267 нм). Соответственно молекуле воды можно приписать радиус равный 1,38 Å (0,138 нм). Дипольный момент воды равен 1,87 Дебая. Электрический дипольный момент – векторная физическая величина, характеризующая, наряду с суммарным зарядом электрические свойства системы заряженных частиц (распределения зарядов) в смысле создаваемого ею поля и действия на нее внешних полей.
Исследования показали, что в воде сохраняется ближняя упорядоченность, свойственная структуре льда. Следовательно, тенденция каждой молекулы воды к окружению четырьмя ближайшими молекулами и к образованию с ними водородных связей свойственна как жидкому, так и твердому состоянию. Расстояние между ближайшими молекулами при плавлении льда изменяется от 2,76 Å (0,276 нм) до 2,90 Å (0,29 нм). Свойственное среднее расположение ближайших молекул ведет к очень рыхлой, ажурной структуре. Именно с этим связаны аномальные свойства воды.
Почти шарообразная молекула воды имеет заметно выраженную полярность, так как электрические заряды в ней расположены асимметрично. Каждая молекула является миниатюрным диполем с высоким дипольным моментом.
Полярность молекул, наличие в них частично некомпенсированных электрических зарядов создает группировки молекул – ассоциаты. Полностью соответствует формуле Н2O лишь вода, находящаяся в парообразном состоянии. В температурном интервале от 0 до 100 °С концентрация отдельных (мономерных молекул) жидкой воды не превышает 1 %. Все остальные молекулы воды объединены в ассоциаты различной степени сложности, и их состав описывается общей формулой
[Н2O]Х. Причиной образования ассоциатов являются водородные связи. Они возникают между ядрами водорода одних молекул и электронными «сгущениями» у ядер кислорода других молекул воды.
Неравномерное распределение электрических зарядов приводит к тому, что молекула воды поляризуется, становится маленьким магнитиком.
В магнитном поле Земли молекулы воды, находящейся в жидком состоянии, собираются в некие нестабильные конструкции под действием притяжения разноименно заряженных полюсов. Нестабильность таких конструкций определяется слабостью водородных связей между молекулами воды, называемых иногда водородными мостиками.
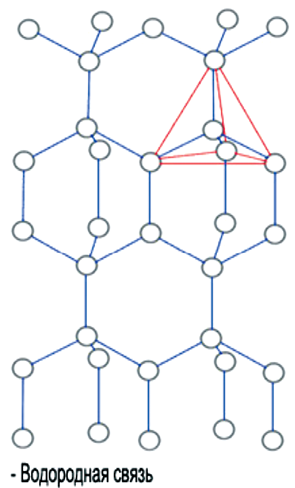
Тетраэдрическая форма отдельной молекулы повторяется в кристаллической структуре льда. Возможно, определенную роль здесь играет то, что угол H–O–H молекулы H2O почти равен идеальному тетраэдрическому углу 109°, а молекулы воды, как мы знаем, объединяются с помощью водородных связей, которые они образуют именно в направлении O–H. Эти трехгранные пирамиды могут также объединяться в некую сверхструктуру. Во льду такая сложная трехмерная сверхструктура из тетраэдров простирается на весь объем (рис. 4).
Рис. 4. Структура Н2О льда
Льдообразная молекула воды содержит как простые молекулы воды, так и кластера льдообразных структур (рис. 5).
Источник
Урок 27. Состав и физические свойства воды
В уроке 27 «Состав и физические свойства воды» из курса «Химия для чайников» узнаем, что из себя представляет вода, выясним её состав, а также физические свойства.
Наиболее распространенным оксидом на Земле является оксид водорода H2O, или вода. Без воды, как и без кислорода, невозможна жизнь человека, животных и растений.
Вода — единственное вещество, существующее на Земле одновременно в трех агрегатных состояниях: жидком, твердом и газообразном. Она является основным компонентом морей и океанов, ледников и айсбергов, облаков и тумана.
Около 70 % поверхности Земли покрыто океанами, морями, реками и озерами — природными хранилищами воды. Из космоса толстый слой воды имеет голубой цвет (рис. 104), вот почему нашу планету называют голубой. Вода входит в состав всех живых организмов, а также очень многих минералов.
Состав и строение воды
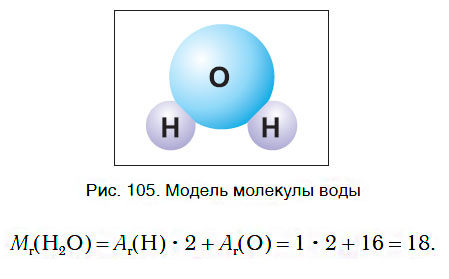
Как вы уже знаете, молекула воды состоит из трех атомов — двух атомов водорода и одного атома кислорода (рис. 105). Относительная молекулярная масса воды равна:
Следовательно, молярная масса воды равна:
Вода — это вещество с молекулярным строением. В твердом (рис. 106) и жидком агрегатных состояниях молекулы воды прочно связаны друг с другом. Этим во многом объясняется целый ряд удивительных физических свойств воды.
Физические свойства воды
При комнатных условиях вода представляет собой жидкость без вкуса и запаха. В тонком слое вода не имеет цвета. Однако при толщине более 2 м она имеет голубой цвет. Совершенно чистая вода очень плохо проводит электрический ток.
На заметку: По тому, как проводит электрический ток вода, можно судить о ее чистоте — чем ниже электропроводность, тем чище вода.
У большинства веществ в твердом состоянии плотность выше, чем в жидком. В отличие от них вода в твердом агрегатном состоянии (лед) имеет более низкую плотность, чем в жидком. При 0 °С плотность льда равна примерно 0,92 г/см 3 , а плотность жидкой воды — примерно 1,00 г/см 3 . Это означает, что лед легче воды, поэтому он не тонет в ней (рис. 107). Такая особенность воды объясняет, почему водоемы начинают замерзать не со дна, а с поверхности и очень редко промерзают до самого дна. Это защищает живые организмы, обитающие в реках и морях, от гибели.
У воды высокая теплоемкость, поэтому она медленно нагревается, но и медленно остывает. Это позволяет морям и океанам накапливать тепло летом (и днем) и высвобождать его зимой (и ночью), что предотвращает резкие колебания температуры воздуха на нашей планете в течение года (и суток). Моря и океаны служат своеобразными аккумуляторами тепла на нашей планете.
При нормальном давлении (101,3 кПа) температура кипения воды равна 100 °С. При понижении давления температура кипения воды понижается. Например, в горах на высоте около 5000 м давление существенно ниже нормального (примерно в два раза), поэтому вода закипает в этих условиях при температуре около 84 °С. Понятно, что варить продукты до готовности в горах необходимо более длительное время. И наоборот, в скороварке, где создается высокое давление, вода закипает при температуре выше 100 °С, что позволяет быстрее приготавливать пищу.
Вода как растворитель
С совершенно чистой водой, не содержащей никаких других веществ, большинство людей никогда не встречается. Такая вода используется только в специальных целях.
Почти все жидкости, с которыми мы сталкиваемся в повседневной жизни и деятельности, представляют собой растворы различных веществ.
Раствор — это однородная смесь двух и более веществ.
Одно из веществ, входящих в состав раствора, называется растворителем, а остальные — растворенными веществами. Очень часто растворителем является вода. Вода может растворять твердые, жидкие и газообразные вещества.
Все природные воды содержат растворенные соли. Их легко обнаружить экспериментально, выпарив воду на часовом стекле. Кроме солей, вода может растворять различные газы. Их присутствие (правда, не всегда) можно обнаружить экспериментально. Например, поместив пробирку с холодной водой из-под крана в теплое место, через некоторое время можно заметить у стенок пробирки пузырьки. Это растворенные газы (преимущественно кислород) выделяются из раствора при его нагревании до комнатной температуры (рис. 108).
Многие жидкости также хорошо растворимы в воде. Например, серная кислота и спирт неограниченно растворяются в воде. В таком случае говорят, что вещество смешивается с водой в любых соотношениях. Из-за хорошей растворимости многих веществ в воде ее иногда называют универсальным растворителем.
Краткие выводы урока:
- Вода не имеет вкуса, цвета (в тонком слое) и запаха, кипит при 100 °С, а переходит в твердое состояние при 0 °С.
- Плотность твердой воды меньше, чем жидкой.
- Раствор — это однородная смесь двух и более веществ.
- Вода является универсальным растворителем — она хорошо растворяет многие твердые, жидкие и газообразные вещества.
Надеюсь урок 27 «Состав и физические свойства воды» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Источник