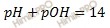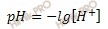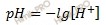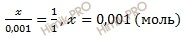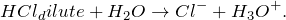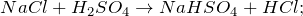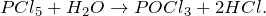- Соляная кислота
- Характеристики и физические свойства соляной кислоты
- Получение соляной кислоты
- Химические свойства соляной кислоты
- Применение соляной кислоты
- Примеры решения задач
- Химик.ПРО – решение задач по химии бесплатно
- Решение задачи
- Урок №19. Соляная кислота и её соли
- HCl + H2O = ? уравнение реакции
- Соляная кислота
- Характеристики и физические свойства соляной кислоты
- Получение соляной кислоты
- Химические свойства соляной кислоты
- Применение соляной кислоты
- Примеры решения задач
Соляная кислота
Характеристики и физические свойства соляной кислоты
Сильная кислота: pKa = -7,1. Концентрированная соляная кислота содержит около 37% HCl.
Основные физические свойства соляной кислоты приведены в таблице:
Температура плавления, o С
Температура кипения, o С
Энтальпия образования, кДж/моль
Плотность, г/см 3
Удельная теплоемкость, кДж/(кг×К)
Получение соляной кислоты
Соляная кислота получается растворением в воде хлороводорода. В настоящее время основным способом промышленного получения хлороводорода является синтез его из водорода и хлора:
Этот процесс осуществляют в специальных установках, в которых смесь водорода и хлора непрерывно образуется и тут же сгорает ровным пламенем. Тем самым достигается спокойное (без взрыва) протекание реакции. Исходным сырьем для получения хлороводорода служат хлор и водород, образующиеся при электролизе раствора хлорида натрия.
Большие количества соляной кислоты получают также в качестве побочного продукта хлорирования органических соединений согласно уравнению реакции, представленному ниже:
где R – углеводородный радикал.
Химические свойства соляной кислоты
Соляная кислота – сильный электролит. Для нее характерны следующие химические свойства, общие для всех кислот:
— способность взаимодействовать с основаниями с образованием солей:
— способность взаимодействовать с некоторыми металлами с выделением водорода (разбавленный раствор):
— способность вступать в реакции взаимодействия с основными и амфотерными оксидами с образованием солей и воды:
— способность взаимодействовать с солями более слабых кислот:
— способность изменять цвета индикаторов, в частности, вызывать красную окраску лакмуса;
При диссоциации соляной кислоты образуются ионы водорода:
Нагревание смеси растворов соляной и азотной кислот до температуры 100-150 o С приводит к образованию очень сильного окислителя — соединения, которое называют «царская водка»:
Соляная кислота в окислительно-восстановительных реакциях может выступать и как восстановитель (за счет хлорид-аниона Cl — ) и как окислитель (за счет катиона водорода H + ). Уравнения ОВР с участием соляной кислоты приведены ниже:
Применение соляной кислоты
Соляная кислота – одна из важнейших кислот в химической практике. Ежегодное мировое производство соляной кислоты исчисляется миллионами тонн. Широкое применение находят также многие её соли.
Соляная кислота применяется в таких областях народного хозяйства как гидрометаллургия и гальванопластика, для травления, декапирования и лужения поверхности металлов; пищевом производстве, как регулятор кислотности (добавка Е507); в медицине, в качестве лекарства (смесь с ферментом пепсином) при недостаточной кислотности желудка.
Примеры решения задач
| Задание | Какова концентрация хлорид-ионов в растворе, полученном при сливании равных объемов растворов 2×10 -5 М хлорида натрия, 0,33×10 -4 М хлорида калия и 5,0×10 -6 М соляной кислоты? |
| Решение | Сначала преобразуем числа так, чтобы показатели степеней привести к наибольшему: |
5,0×10 -6 = 0,050×10 -4 .
Итого: 0,2×10 -4 + 0,33×10 -4 + 0,050×10 -4 = 0,580×10 -4 . Число значащих цифр суммы должно определяться числом 0,2×10 -4 , имеющим наименьшее число значащих десятичных знаков. Поэтому полученную сумму округляем до первой цифры после запятой, т.е. 0,6×10 -4 . В конечном объеме концентрация хлорид-ионов составляет:
0,6×10 -4 / 3 = 0,2×10 -4 М.
| Задание | Рассчитайте рН 0,001 М раствора соляной кислоты. |
| Решение | Для раствора сильной кислоты: |
По аналогии с раствором сильной кислоты для раствора сильного основания:
Источник
Химик.ПРО – решение задач по химии бесплатно
К какому объёму воды следует добавить 1 миллилитр соляной кислоты (HCl) с молярной концентрацией 0,1 моль/л, чтобы получить раствор с рОН 11?
Решение задачи
Используя формулу, вычислим pH раствора:
Водородный показатель (pH) раствора численно равен отрицательному десятичному логарифму концентрации ионов водорода в этом растворе.
По формуле вычислим концентрацию ионов водорода:
[H + ] = 10 -3 = 0,001 (моль/л).
Соляная кислота вода
По уравнению диссоциации вычислим, молярную концентрацию полученной (после добавления воды) соляной кислоты (HCl), соляная кислота вода:
при диссоциации 1 моль HCl образуется 1 моль ионов H +
при диссоциации х моль HCl образуется 0,001 моль ионов H +
Следовательно, полученный раствор соляной кислоты (HCl) 0,001 моль/л. Соляная кислота вода
Напомню, молярная концентрация – число молей вещества содержащегося в единице объема раствора.
Исходя из выражения закона эквивалентов и учитывая, что количество кислоты при разбавлении сохраняется, справедливо выражение:
С1, С2 – концентрация исходного и полученного раствора соляной кислоты (HCl) соответственно;
V1, V2 – концентрация исходного и полученного раствора соляной кислоты (HCl) соответственно.
Получаем, соляная кислота вода:
V2 (HCl) = 0,1 ⋅ 1 /0,001 = 100 (мл).
V (H2O) = V2 (HCl) — V1 (HCl) = 100 — 1 = 399 (мл).
Источник
Урок №19. Соляная кислота и её соли
Соляная кислота
Физические свойства:
Концентрированная соляная кислота – это бесцветный раствор, сильно дымящий во влажном воздухе, с резким запахом.
Получение соляной кислоты:
Соляная кислота HCl получается при растворении газа хлороводорода воде. Хлороводород можно получить действием концентрированной серной кислоты на поваренную соль.
NaCl + H 2 SO 4 = HCl↑ + NaHSO 4 (хлороводород + гидросульфат натрия)
Химические свойства:
Раствор хлороводорода в воде — соляная кислота — сильная кислота:
1) реагирует с металлами , стоящими в ряду напряжений до водорода:
2Al + 6HCl = 2AlCl 3 + 3H 2
3) с оксидами металлов :
MgO + 2HCl = MgCl 2 + H 2 O
4) с основаниями и аммиаком :
HCl + KOH = KCl + H 2 O
3HCl + Al(OH) 3 = AlCl 3 + 3H 2 O
HCl + NH 3 = NH 4 Cl
5) с солями :
CaCO 3 + 2HCl = CaCl 2 + H 2 O + CO 2 ↑
HCl + AgNO 3 = AgCl↓ + HNO 3
Образование белого осадка хлорида серебра — AgCl, нерастворимого в минеральных кислотах используется в качестве качественной реакции для обнаружения анионов Cl — в растворе.
Хлориды металлов — соли соляной кислоты, их получают взаимодействием металлов с хлором или реакциями соляной кислоты с металлами, их оксидами и гидроксидами; путем обмена с некоторыми солями
2Fe + 3Cl 2 = 2FeCl 3
Mg + 2HCl = MgCl 2 + H 2
CaO + 2HCl = CaCl 2 + H 2 O
Ba(OH) 2 + 2HCl = BaCl 2 + 2H 2 O
Pb(NO 3 ) 2 + 2HCl = PbCl 2 ↓ + 2HNO 3
Большинство хлоридов растворимы в воде (за исключением хлоридов серебра, свинца и одновалентной ртути).
Применение соляной кислоты и ее солей:
1. Соляная кислота входит в состав желудочного сока и способствует перевариванию белковой пищи у человека и животных.
2. Хлороводород и соляная кислота используются для производства лекарств, красителей, растворителей, пластмасс.
3. Применение основных солей соляной кислоты:
KCl — удобрение, используется также в стекольной и химической промышленности.
HgCl 2 — сулема — яд, используется для дезинфекции в медицине, для протравливания семян в сельском хозяйстве.
Hg 2 Cl 2 — каломель — не ядовита, слабительное средство.
NaCl — поваренная соль — сырье для производства соляной кислоты, гидроксида натрия, водорода, хлора, хлорной извести, соды. Применяется в кожевенной и мыловаренной промышленности, в кулинарии и консервировании.
ZnCl 2 — для пропитки древесины против гниения, в медицине, при паянии.
AgCl — применяется в черно-белой фотографии, так как обладает светочувствительностью — разлагается на свету с образованием свободного серебра: 2AgCl = 2Ag + Cl 2
Задания для повторения и закрепления
№1. Осуществите превращения по схеме:
HCl → Cl 2 → AlCl 3 → Al(OH) 3 → Al 2 O 3 → AlCl 3 → Cl 2
№2. Расставьте коэффициенты методом электронного баланса в следующей реакции:
HCl + KClO 3 → KCl + H 2 O + Cl 2
Укажите окислитель и восстановитель; процессы окисления и восстановления.
Какое количество алюминия прореагирует с избытком соляной кислоты для получения 5,6 л водорода (н.у.)?
Источник
HCl + H2O = ? уравнение реакции
Закончите уравнение реакции HCl + H2O = ? Расставьте стехиометрические коэффициенты. Запишите молекулярное уравнение реакции. Охарактеризуйте соединение хлороводород: приведите его основные физические и химические свойства. Каким образом можно получить хлороводород в лаборатории? А в промышленности?
Хлороводород с водой (HCl + H2O = ?) не реагирует – он в ней растворяется, т.е. образования каких-либо новых веществ не происходит, поскольку данный процесс не относится к химическому взаимодействию, а является физическим. В результате него возможно формирование ионов следующего состава:
Хлороводород – бесцветный газ, термически не устойчивый. Хорошо растворяется в воде и в этом состоянии является сильной кислотой, 35 – 36%-ный раствор которой называют соляной, а 20 – 24%-ный и 7 – 10%-ный – концентрированной и разбавленной хлороводородной кислотой соответственно. Реагирует с концентрированной азотной кислотой («царская водка»); нейтрализуется щелочами и гидратом аммиака. В ОВР проявляет свойства как окислителя (за счет 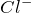
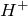
К основным лабораторным способам получения хлороводорода относят действие серной кислоты на хлорид натрия, а также гидролиз ковалентных галогенидов:
В промышленности хлороводород получают взаимодействием простых веществ – хлора и водорода (метод Леблана):
Источник
Соляная кислота
Характеристики и физические свойства соляной кислоты
Сильная кислота: pKa = -7,1. Концентрированная соляная кислота содержит около 37% HCl.
Основные физические свойства соляной кислоты приведены в таблице:
Температура плавления, o С
Температура кипения, o С
Энтальпия образования, кДж/моль
Плотность, г/см 3
Удельная теплоемкость, кДж/(кг×К)
Получение соляной кислоты
Соляная кислота получается растворением в воде хлороводорода. В настоящее время основным способом промышленного получения хлороводорода является синтез его из водорода и хлора:
Этот процесс осуществляют в специальных установках, в которых смесь водорода и хлора непрерывно образуется и тут же сгорает ровным пламенем. Тем самым достигается спокойное (без взрыва) протекание реакции. Исходным сырьем для получения хлороводорода служат хлор и водород, образующиеся при электролизе раствора хлорида натрия.
Большие количества соляной кислоты получают также в качестве побочного продукта хлорирования органических соединений согласно уравнению реакции, представленному ниже:
где R – углеводородный радикал.
Химические свойства соляной кислоты
Соляная кислота – сильный электролит. Для нее характерны следующие химические свойства, общие для всех кислот:
— способность взаимодействовать с основаниями с образованием солей:
— способность взаимодействовать с некоторыми металлами с выделением водорода (разбавленный раствор):
— способность вступать в реакции взаимодействия с основными и амфотерными оксидами с образованием солей и воды:
— способность взаимодействовать с солями более слабых кислот:
— способность изменять цвета индикаторов, в частности, вызывать красную окраску лакмуса;
При диссоциации соляной кислоты образуются ионы водорода:
Нагревание смеси растворов соляной и азотной кислот до температуры 100-150 o С приводит к образованию очень сильного окислителя — соединения, которое называют «царская водка»:
Соляная кислота в окислительно-восстановительных реакциях может выступать и как восстановитель (за счет хлорид-аниона Cl — ) и как окислитель (за счет катиона водорода H + ). Уравнения ОВР с участием соляной кислоты приведены ниже:
Применение соляной кислоты
Соляная кислота – одна из важнейших кислот в химической практике. Ежегодное мировое производство соляной кислоты исчисляется миллионами тонн. Широкое применение находят также многие её соли.
Соляная кислота применяется в таких областях народного хозяйства как гидрометаллургия и гальванопластика, для травления, декапирования и лужения поверхности металлов; пищевом производстве, как регулятор кислотности (добавка Е507); в медицине, в качестве лекарства (смесь с ферментом пепсином) при недостаточной кислотности желудка.
Примеры решения задач
| Задание | Какова концентрация хлорид-ионов в растворе, полученном при сливании равных объемов растворов 2×10 -5 М хлорида натрия, 0,33×10 -4 М хлорида калия и 5,0×10 -6 М соляной кислоты? |
| Решение | Сначала преобразуем числа так, чтобы показатели степеней привести к наибольшему: |
5,0×10 -6 = 0,050×10 -4 .
Итого: 0,2×10 -4 + 0,33×10 -4 + 0,050×10 -4 = 0,580×10 -4 . Число значащих цифр суммы должно определяться числом 0,2×10 -4 , имеющим наименьшее число значащих десятичных знаков. Поэтому полученную сумму округляем до первой цифры после запятой, т.е. 0,6×10 -4 . В конечном объеме концентрация хлорид-ионов составляет:
0,6×10 -4 / 3 = 0,2×10 -4 М.
| Задание | Рассчитайте рН 0,001 М раствора соляной кислоты. |
| Решение | Для раствора сильной кислоты: |
По аналогии с раствором сильной кислоты для раствора сильного основания:
Источник