- Реакция брома с водой
- Реакция взаимодействия брома с водой.
- Уравнение реакции взаимодействия брома с водой:
- Мировая экономика
- Справочники
- Востребованные технологии
- Поиск технологий
- О чём данный сайт?
- О Второй индустриализации
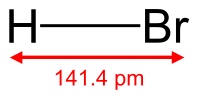
- Бромоводород
- Содержание
- Получение
- Физические свойства
- Химические свойства
- Применение
- Транспортировка
- Токсичность
- HBr + H2O = ? уравнение реакции
- Acetyl
Реакция брома с водой
Реакция взаимодействия брома с водой.
Уравнение реакции взаимодействия брома с водой:
Реакция брома с водой протекает при условии: на свету или при кипении.
В результате реакции брома с водой образуются бромоводород и кислород .
Примечание: © Фото https://www.pexels.com, https://pixabay.com

Мировая экономика
Справочники
Востребованные технологии
- Концепция инновационного развития общественного производства – осуществления Второй индустриализации России на период 2017-2022 гг. (106 487)
- Экономика Второй индустриализации России (102 476)
- Программа искусственного интеллекта ЭЛИС (27 497)
- Метан, получение, свойства, химические реакции (23 754)
- Этилен (этен), получение, свойства, химические реакции (22 855)
- Природный газ, свойства, химический состав, добыча и применение (21 179)
- Крахмал, свойства, получение и применение (20 583)
- Целлюлоза, свойства, получение и применение (19 439)
- Пропилен (пропен), получение, свойства, химические реакции (19 132)
- Прямоугольный треугольник, свойства, признаки и формулы (18 742)
Поиск технологий
О чём данный сайт?
Настоящий сайт посвящен авторским научным разработкам в области экономики и научной идее осуществления Второй индустриализации России.
Он включает в себя:
– экономику Второй индустриализации России,
– теорию, методологию и инструментарий инновационного развития – осуществления Второй индустриализации России,
– организационный механизм осуществления Второй индустриализации России,
– справочник прорывных технологий.
Мы не продаем товары, технологии и пр. производителей и изобретателей! Необходимо обращаться к ним напрямую!
Мы проводим переговоры с производителями и изобретателями отечественных прорывных технологий и даем рекомендации по их использованию.
О Второй индустриализации
Осуществление Второй индустриализации России базируется на качественно новой научной основе (теории, методологии и инструментарии), разработанной авторами сайта.
Конечным результатом Второй индустриализации России является повышение благосостояния каждого члена общества: рядового человека, предприятия и государства.
Вторая индустриализация России есть совокупность научно-технических и иных инновационных идей, проектов и разработок, имеющих возможность быть широко реализованными в практике хозяйственной деятельности в короткие сроки (3-5 лет), которые обеспечат качественно новое прогрессивное развитие общества в предстоящие 50-75 лет.
Та из стран, которая первой осуществит этот комплексный прорыв – Россия, станет лидером в мировом сообществе и останется недосягаемой для других стран на века.
Источник
Бромоводород
| Бромоводород | |||
|---|---|---|---|
| |||
| Систематическое наименование | бромоводород | ||
| Традиционные названия | Бромистый водород | ||
| Хим. формула | HBr | ||
| Рац. формула | HBr | ||
| Состояние | бесцветный газ | ||
| Молярная масса | 80,91 г/моль | ||
| Плотность | газ (25 °C), 3,307 г/л, жидкий (−68 °C) 2,17 г/см³ | ||
| Энергия ионизации | 11,62 ± 0,01 эВ | ||
| Температура | |||
| • плавления | –86.80 °C | ||
| • кипения | –66.38 °C | ||
| Критическая точка | 90,0 °C, 8,54 МПа | ||
| Энтальпия | |||
| • образования | -34,1 кДж/моль | ||
| Давление пара | 20 ± 1 атм , 20,003 бар , 26,5 бар и 40,7 бар | ||
| Константа диссоциации кислоты pKa | ≈ –9 | ||
| Растворимость | |||
| • в воде | 193 (20 °C) | ||
| Дипольный момент | 0,24 Д | ||
| Рег. номер CAS | 10035-10-6 | ||
| PubChem | 260 | ||
| Рег. номер EINECS | 233-113-0 | ||
| SMILES | |||
| RTECS | MW3850000 | ||
| ChEBI | 47266 | ||
| Номер ООН | 1048 | ||
| ChemSpider | 255 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Бромоводород (HBr) — соединение брома с водородом. Бесцветный тяжёлый токсичный газ, образует туман в сыром воздухе.
Содержание
Получение
В промышленности бромоводород получают непосредственным взаимодействием простых веществ:
Также бромистый водород получается как побочный продукт при синтезе бромпроизводных органических соединений
В лаборатории получают гидролизом трибромида или пентабромида фосфора:
Восстановление брома несколькими способами:
Вытеснение из бромидов щелочных металлов разбавленной кислотой:
Физические свойства
Бромистый водород — это бесцветный ядовитый газ с резким запахом, сильно дымящий на воздухе. Термически очень устойчив.
Хорошо растворим в воде: 221 г/100 г воды при 0 °C (193 при 25°, 130 при 100 °C). Водный раствор образует азеотропную смесь с 47,63 % HBr, которая кипит при 124,3 °C.
Растворяется в этаноле, образуя слабый электролит.
При охлаждении водных растворов HBr можно получить кристаллогидраты:
- HBr·H2O — устойчив при −15,5÷-3,3 °C
- HBr·2H2O — плавится при −11,2 °C
- HBr·4H2O — плавится при −55,8 °C
Чистый HBr образует кристаллы орторомбической сингонии, пространственная группа F mmm, параметры при −173 °C a = 0,5640 нм, b = 0,6063 нм, c = 0,5555 нм, Z = 4.
Химические свойства
Водный раствор бромистого водорода образует сильную одноосновную кислоту:
Термически HBr очень устойчив, при температуре 1000 °C разлагаются около 0,5 % молекул:
Как кислота реагирует с металлами, их оксидами, основаниями:
Является восстановителем, медленно окисляется на воздухе, из-за чего водные растворы со временем окрашиваются в бурый цвет:
Применение
Применяют для приготовления бромидов, синтеза различных органических бромпроизводных и для реактивного ионного травления.
Транспортировка
Безводный HBr транспортируют в баллонах ёмкостью 6,8 и 68 кг под давлением 24 атм.
Токсичность
Бромистый водород — едкое, весьма токсичное вещество, обладающее удушающим действием. Предельно допустимая концентрация = 10 мг/м³, поражающая токсодоза = 2,4 мг/л·мин.
Источник
HBr + H2O = ? уравнение реакции
Что происходит при растворении бромоводорода в воде (HBr + H2O = ?). Запишите уравнение реакции. Проведите сравнительный анализ химических и физических свойств галогеноводородов. Приведите способы получения этих веществ.
Бромоводород представляет собой бесцветный термически устойчивый газ. Он хорошо растворяется в воде и в этом состоянии является сильной кислотой: 48-55%-й раствор называют концентрированной бромоводородной кислотой, однако химической реакции при этом не происходит, а значит записать уравнение по схеме [HBr + H2O = ?] невозможно. Растворяется в этаноле (слабый электролит).
Все галогеноводороды при обычных условиях газообразны. Полярность и прочность связи в ряду HF – HCl – HBr – HI уменьшается.
HF и HCl получают взаимодействием их твердых солей с концентрированной серной кислотой при нагревании:
HBr и HI получить таким способом нельзя, поскольку они – сильные восстановители и окисляются серной кислотой:
Поэтому HBr и HI получают гидролизом соответствующих галогенидов фосфора:
Все галогеноводороды очень хорошо растворимы в воде. При этом образуются растворы соответствующих галогеноводородных кислот. Сила кислот в ряду HF – HCl – HBr – HI увеличивается.
Все галогениды металлов, за исключением Ag и Pb, хорошо растворимы в воде. Малая растворимость галогенидов серебра позволяет использовать обменную реакцию типа
как качественную для обнаружения соответствующих ионов. В результате реакции AgCl выпадает в виде осадка белого цвета, AgBr – желтовато-белого, AgI – ярко-желтого цвета.
Источник
Acetyl
Это пилотный ролик из серии об органических реакциях.
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Источник |