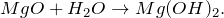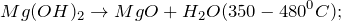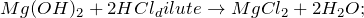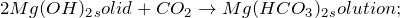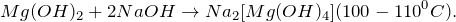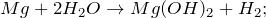- Гидроксид магния: способы получения и химические свойства
- Способы получения
- Качественная реакция
- Химические свойства
- MgO + H2O = ? уравнение реакции
- Гидроксид магния, характеристика, свойства и получение, химические реакции
- Гидроксид магния, характеристика, свойства и получение, химические реакции.
- Краткая характеристика гидроксида магния:
- Физические свойства гидроксида магния:
- Получение гидроксида магния:
- Химические свойства гидроксида магния. Химические реакции гидроксида магния:
- Применение и использование гидроксида магния:
- Мировая экономика
- Справочники
- Востребованные технологии
- Поиск технологий
- О чём данный сайт?
- О Второй индустриализации
Гидроксид магния: способы получения и химические свойства
Гидроксид магния Mg(OH)2 — неорганическое соединение. Белый, при нагревании разлагается. Не растворяется в воде. Проявляет основные свойства.
Относительная молекулярная масса Mr = 58,32; относительная плотность для тв. и ж. состояния d = 2,39.
Способы получения
1. Гидроксид магния получают в результате взаимодействия хлорида магния и разбавленного раствора гидроксида натрия, на выходе образуется хлорид натрия и гидроксид магния :
MgCl2 + 2NaOH = Mg(OH)2↓ + 2NaCl
2 . При взаимодействии магния с горячей водой образуется гидроксид магния и водород:
3. Нитрат магния при взаимодействии с разбавленным раствором гидроксида натрия образует нитрат натрия и гидроксид магния:
4. Сульфат магния взаимодействует с разбавленным раствором гидроксида натрия, образуя гидроксид магния и сульфат натрия:
Качественная реакция
Качественная реакция на гидроксид магния — окрашивание фенолфталеина в малиновый цвет .
Химические свойства
1. Гидроксид магния взаимодействует со сложными веществами :
1.1. Гидроксид магния реагирует с кислотами:
1.1.1. В результате реакции между гидроксидом магния и разбавленной соляной кислотой образуется хлорид магния и вода:
1.2. Гидроксид магния взаимодействует с оксидами:
В результате взаимодействия твердого гидроксида магния и углекислого газа при комнатной температуре образуется гидроксокарбонат магния и вода:
1.3. Гидроксид магния реагирует с солями :
Гидроксид магния взаимодействует с концентрированным и горячим раствором хлорида аммония , образуя хлорид магния, аммиак и воду:
2. Гидроксид магния разлагается при температуре 350 — 480º С, образуя на выходе оксид магния и воду:
Источник
MgO + H2O = ? уравнение реакции
Помогите составить химическое уравнение по схеме MgO + H2O = ? Расставьте стехиометрические коэффициенты. Укажите тип взаимодействия. Запишите молекулярное уравнение реакции. Охарактеризуйте полученное соединение: укажите основные физические и химические свойства, способы получения.
В результате взаимодействия оксида магния с водой (MgO + H2O = ?) происходит образование нерастворимого в воде основания – гидроксида магния (соединение). Молекулярное уравнение реакции имеет вид:
Гидроксид магния представляет собой вещество белого цвета, кристаллы которого при нагревании разлагаются. Не растворяется в воде. Проявляет основные свойства, реагирует с кислотами, кислотными оксидами. В жестких условиях образует гидроксокомплексы. Поглощает углекислый газ из воздуха. Переводится в раствор солями аммония.
Кроме вышеописанного способа гидроксид магния получают растворением металла в воде:
а также по любой реакции, удовлетворяющей сокращенному-ионному уравнению
Источник
Гидроксид магния, характеристика, свойства и получение, химические реакции
Гидроксид магния, характеристика, свойства и получение, химические реакции.
Гидроксид магния – неорганическое вещество, имеет химическую формулу Mg(OH)2.
Краткая характеристика гидроксида магния:
Гидроксид магния – неорганическое вещество белого цвета.
Химическая формула гидроксида магния Mg(OH)2.
Практически нерастворим в воде. Является слабым основанием, даже ничтожная его часть, растворившаяся в воде, сообщает раствору слабощелочную реакцию.
Поглощает углекислый газ и воду из воздуха с образованием основного карбоната магния.
Встречается в природе в виде минерала брусита.
Физические свойства гидроксида магния:
| Наименование параметра: | Значение: |
| Химическая формула | Mg(OH)2 |
| Синонимы и названия иностранном языке | magnesium hydroxide (англ.) |
брусит (рус.)
Получение гидроксида магния:
Гидроксид магния получают в результате следующих химических реакций:
- 1. в результате взаимодействия металлического магния с парами воды:
- 2. в результате взаимодействия оксида магния и воды:
- 3. в результате взаимодействия растворимых солей магния с щелочью:
При этом гидроксид магния выпадает в виде осадка.
- 4. в результате взаимодействия хлорида магния с обожженным доломитом:
При этом гидроксид магния выпадает в виде осадка.
Химические свойства гидроксида магния. Химические реакции гидроксида магния:
Гидроксид магния является основным основанием, т. е. обладает основными свойствами.
Гидроксид магния – слабое малорастворимое основание.
Химические свойства гидроксида магния аналогичны свойствам гидроксидов других основных металлов. Поэтому для него характерны следующие химические реакции:
1. реакция гидроксида магния с гидроксидом натрия:
В результате реакции образуется тетрагидроксомагнезиат натрия. В ходе реакции используется насыщенный раствор гидроксида натрия .
2. реакция гидроксида магния с угольной кислотой:
В результате реакции образуются карбонат магния и вода .
3. реакция гидроксида магния с ортофосфорной кислотой:
В результате реакции образуются в первом случае – дигидроортофосфат магния и вода , во втором – гидроортофосфат магния и вода, в третьем – ортофосфат магния и вода.
4. реакция гидроксида магния с азотной кислотой:
В результате реакции образуются нитрат магния и вода .
Аналогично проходят реакции гидроксида магния и с другими кислотами.
5. реакция гидроксида магния с фтороводородом:
В результате реакции образуются фторид магния и вода.
6. реакция гидроксида магния с бромоводородом:
В результате реакции образуются бромид магния и вода .
7. реакция гидроксида магния с йодоводородом:
В результате реакции образуются йодид магния и вода .
8. реакция термического разложения гидроксида магния:
В результате реакции образуются оксид магния и вода.
9. реакция гидроксида магния с пероксидом водорода:
H2O2 + Mg(OH)2 → MgO2 + 2H2O (t вода . В ходе реакции используется концентрированный раствор пероксида водорода .
10. реакция гидроксида магния с оксидом серы:
В результате реакции образуются сульфат магния и вода .
11. реакция гидроксида магния с оксидом углерода:
В результате реакции образуется гидрокарбонат магния. В ходе реакции гидроксид магния используется в виде суспензии.
12. реакция гидроксида магния с оксидом углерода:
В результате реакции образуются нитрат магния и азотная кислота.
Применение и использование гидроксида магния:
Гидроксид магния используется при очистке воды (как флокулянт), в моющих средствах (как добавка), в качестве наполнителя в зубной пасте, для рафинирования сахара , в качестве пищевой добавки (Е528).
Примечание: © Фото //www.pexels.com, //pixabay.com

гидроксид магния реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения реакции масса взаимодействие гидроксида магния
Мировая экономика
Справочники
Востребованные технологии
- Концепция инновационного развития общественного производства – осуществления Второй индустриализации России на период 2017-2022 гг. (106 482)
- Экономика Второй индустриализации России (102 475)
- Программа искусственного интеллекта ЭЛИС (27 488)
- Метан, получение, свойства, химические реакции (23 725)
- Этилен (этен), получение, свойства, химические реакции (22 777)
- Природный газ, свойства, химический состав, добыча и применение (21 160)
- Крахмал, свойства, получение и применение (20 568)
- Целлюлоза, свойства, получение и применение (19 411)
- Пропилен (пропен), получение, свойства, химические реакции (19 080)
- Прямоугольный треугольник, свойства, признаки и формулы (18 724)
Поиск технологий
О чём данный сайт?
Настоящий сайт посвящен авторским научным разработкам в области экономики и научной идее осуществления Второй индустриализации России.
Он включает в себя:
– экономику Второй индустриализации России,
– теорию, методологию и инструментарий инновационного развития – осуществления Второй индустриализации России,
– организационный механизм осуществления Второй индустриализации России,
– справочник прорывных технологий.
Мы не продаем товары, технологии и пр. производителей и изобретателей! Необходимо обращаться к ним напрямую!
Мы проводим переговоры с производителями и изобретателями отечественных прорывных технологий и даем рекомендации по их использованию.
О Второй индустриализации
Осуществление Второй индустриализации России базируется на качественно новой научной основе (теории, методологии и инструментарии), разработанной авторами сайта.
Конечным результатом Второй индустриализации России является повышение благосостояния каждого члена общества: рядового человека, предприятия и государства.
Вторая индустриализация России есть совокупность научно-технических и иных инновационных идей, проектов и разработок, имеющих возможность быть широко реализованными в практике хозяйственной деятельности в короткие сроки (3-5 лет), которые обеспечат качественно новое прогрессивное развитие общества в предстоящие 50-75 лет.
Та из стран, которая первой осуществит этот комплексный прорыв – Россия, станет лидером в мировом сообществе и останется недосягаемой для других стран на века.
Источник