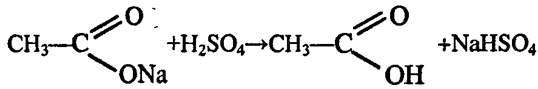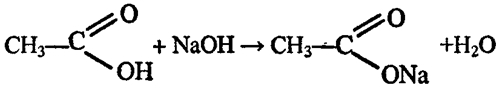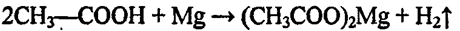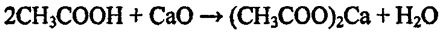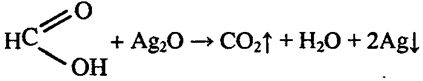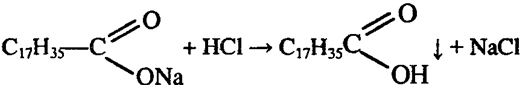- Лабораторная работа «Приготовление жесткой воды и устранение ее жесткости»
- Практическая работа № 4. Получение и свойства карбоновых кислот. ГДЗ Химия 10-11 класс Цветков.
- почему мыло в жесткой воде не мылится?напишите уравнение реакции, отражающей взаимодействие натриевого мыла с жесткой водой, содержащей сульфат кальция
- Другие вопросы из категории
- Читайте также
- почему мыло в жесткой воде не мылится?напишите уравнение реакции, отражающей взаимодействие натриевого мыла с жесткой водой, содержащей сульфат
- Другие вопросы из категории
- Читайте также
- почему мыло в жесткой воде не мылится?напишите уравнение реакции, отражающей взаимодействие натриевого мыла с жесткой водой, содержащей сульфат кальция
- Другие вопросы из категории
- Читайте также
Лабораторная работа «Приготовление жесткой воды и устранение ее жесткости»
НА ВЫПОЛНЕНИЕ ЛАБОРАТОРНОЙ РАБОТЫ № 1
Тема: Приготовление жесткой воды и устранение ее жесткости.
Цель: закрепление знаний по теме «Растворы. Приготовление растворов с определенной массовой долей растворенного вещества», формирование понятия «жесткость» воды, развитие умений по устранению жесткости воды; продолжить формирование умения проводить химические реакции.
Оборудование : набор реактивов и лабораторной посуды для проведения реакций.
Нормы времени : 2 часа .
1) страница 62-68 . Тупикин Е.И. Химия в строительстве: учебное пособие для ССУЗов/ Е.И.Тупикин. – М.: Дрофа, 2010. – 174 с., ил.
2) страница 82-85. Габриелян О.С. Химия. 11 класс. Базовый уровень: Учебник для общеобразовательных учреждений. – 8-е изд. стереопит. – М.: Дрофа, 2013. – 223, 1 с.: ил.
Краткое содержание темы:
Воду с растворенными в ней солями называют жесткой , а совокупность свойств такой воды – жесткостью . Жёсткость воды – свойство воды, связанное с содержанием растворимых в ней соединений кальция и магния, это параметр, показывающий содержание катионов кальция, магния в воде. Жесткая вода образует накипь на стенках паровых котлов, отопительных приборов и бытовой металлической посуды. Она не пригодна для производства бумаги и крашения тканей, для приготовления пищи и напитков. В жесткой воде плохо развариваются овощи и мясо, не пенится мыло. Мыла – это натриевые и калиевые соли органических кислот (C 17 H 35 COONa, C 17 H 35 COOK). С катионами кальция и магния анионы кислотных остатков образуют нерастворимые соли, и мыло расходуется при этом бесполезно. В настоящее время химическая промышленность выпускает большое количество различных синтетических моющих средств (стиральных порошков), содержащих насыщенную углеводородную цепь из 10. 15 атомов углерода, так или иначе связанную с сульфатной или сульфонатной группой, например:
Они, как правило, не образуют малорастворимых в воде солей кальция и магния. Запись СМС можно упростить: R — SO 3 — Na .
Согласно ГОСТ 6055 – 86 различают:
карбонатную жесткость – это совокупность свойств воды, обусловленных присутствием в ней гидрокарбонатов кальция, магния и железа. Часто этот вид жесткости называют временной или устранимой;
некарбонатную жесткость – совокупность свойств воды, обусловленных присутствием в ней сульфатов, хлоридов, силикатов, нитратов и фосфатов кальция, магния и железа. Этот вид жесткости также называют постоянной или неустранимой;
общую жесткость, складывающуюся из карбонатной и некарбонатной жесткости. Она равна сумме концентраций ионов Са 2+ , Mg 2+ , F е 2+ .
За единицу жесткости принимают жесткость воды в одном литре которой содержится один миллимоль (ммоль) эквивалент ионов Са 2+ или Mg 2+ . Числовое значение жесткости, выраженное в ммоль/л, совпадает со значением в моль/м 3 . Одна единица жесткости соответствует массовой концентрации ионов Са 2+ , равной 20,4 мг/л или ионов Mg 2+ , равной 12,15 мг/л.
По величине жесткости различают воду:
мягкую 1, 5 – 3 единиц;
среднюю 3, 6 – 6, 0 единиц
жесткую 6, 0 – 9, 0 единиц
очень жесткую > 9, 0 единиц.
Методы устранения и снижения жесткости воды. Устранение или снижение жесткости воды называют умягчением. Его осуществляют различными методами.
1. Метод кипячения. Он позволяет устранить только временную (карбонатную) жесткость, обусловленную наличием в воде хорошо растворимых гидрокарбонатов кальция, магния и железа. При этом катионы Са 2+ , Mg 2+ , Fe 2+ осаждаются в виде нерастворимых соединений.
2. Химическая обработка воды (реагентный метод). Этот метод позволяет устранить как временную жесткость, так и постоянную. Сущность его заключается в обработке воды специальными реагентами, образующими ионами, вызывающими жесткость, малорастворимые соединения. К числу таких реагентов относятся: сода Na 2 CO 3 , негашеная CaO и гашеная Ca ( OH ) 2 извести, различные фосфаты натрия ( Na 3 PO 4 , Na 6 P 6 O 18 ) и др. Обработка известью позволяет связать и растворенный в воде углекислый газ. Использование фосфатов натрия предпочтительнее, так как образующие фосфаты кальция, магния и железа менее растворимы, чем соответствующие их карбонаты и гидроксиды.
3. Ионообменный метод. Это современный физико – химический метод основан на способности некоторых веществ, не растворимых в воде, стехиометрически обменивать свои ионы на ионы внешней среды (воды, растворов электролитов). Вещества, обладающие такими свойствами, называют ионообменниками (ионообменными сорбентами) или сокращенно ионитами. Большинство ионитов – твердые, ограниченно набухающие вещества, аморфной или кристаллической структуры. Они состоят из каркаса (матрицы) и закрепленных на нем иогенных (активных функциональных) или комплексообразующих групп.
Источник
Практическая работа № 4. Получение и свойства карбоновых кислот. ГДЗ Химия 10-11 класс Цветков.
Помогите мне с ответами
1. Поместите в пробирку 3—4 г ацетата натрия и прибавьте примерно 2—3 мл раствора серной кислоты (1:1). Пробирку закройте пробкой с газоотводной трубкой, свободный конец которой опустите в пустую пробирку (рис. 65). Нагревайте смесь веществ на пламени до тех пор, пока в пробирке-приемнике соберется 1—2 мл жидкости. Обратите внимание на запах уксусной кислоты.
2. Собранную кислоту разделите на две части. Одну часть испытайте раствором лакмуса и нейтрализуйте раствором щелочи. Вторую часть разбавьте немного водой и в полученный раствор поместите кусочек ленты или порошок магния. Что наблюдаете? Составьте уравнения реакций.
3. Проделайте реакции уксусной кислоты с каким-либо оксидом мталла и солью.
4. Проверьте, окисляется ли муравьиная кислота аммиачным раствором оксида серебра (I). Составьте уравнение реакции.
5. Приготовьте в пробирке при нагревании водный раствор обыкновенного хозяйственного мыла (настрогав его немного для этой цели в виде тонких стружек).
6. Налейте в пробирку 2—3 мл раствора мыла и прибавьте к нему соляной кислоты до образования хлопьев. Что собой представляет этот осадок? Составьте уравнение реакции. Проверьте, растворяется ли осадок в растворе щелочи. Объясните это явление.
7. К 2—3 мл раствора мыла в пробирке прилейте раствор хлорида кальция. Что наблюдаете? Напишите уравнение реакции. Какое свойство мыла иллюстрируется данным опытом?
8. Докажите опытным путем, что олеиновая кислота является кислотой непредельной.
1. Собрали прибор, как это показано на рисунке 65 учебника.
В пробирку поместили немного ацетата натрия и добавили рас-
твор H2SO4 (1:1). Пробирку закрыли пробкой с газоотводной
трубкой, конец которой поместили в другую, чистую пробирку.
Исходную пробирку нагрели. Наблюдаем конденсацию уксусной
кислоты в приемнике, чувствуется резкий характерный запах ук-
сусной кислоты.
2. Полученную кислоту разделили на 2 части. В первую пробирку
поместили лакмусовую бумажку, наблюдаем ее покраснение. Затем
прильем немного раствора гидроксида натрия. Помещенная в полу-
ченный раствор лакмусовая бумажка синеет.
Во вторую пробирку добавили немного порошка магния, наблю-
даем выделение газа.
3. В пробирку с уксусной кислотой добавили немного оксида
кальция, наблюдаем его растворение.
4. При прилипании в пробирку с аммиачным раствором муравьи-
ной кислоты, смесь нагрели. Наблюдаем образование налета серебра
на стенках пробирки и выделение газа:
Муравьиная кислота окисляется оксидом серебра.
5, 6. В пробирку с водой добавили стружек хозяйственного мыла
и нагрели. К полученному мыльному раствору добавили раствор
НСl. Наблюдаем образование хлопьев:
7. При добавлении к мыльному раствору раствора СаСl наблюда-
ем образование хлопьев: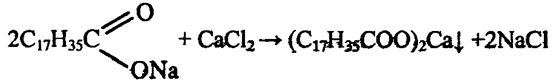
уменьшается в жесткой воде.
8. При приливании в пробирку с олеиновой кислотой (раститель-
ным маслом) бромной воды наблюдаем ее обесцвечивание — признак
не предельности.
Источник
почему мыло в жесткой воде не мылится?напишите уравнение реакции, отражающей взаимодействие натриевого мыла с жесткой водой, содержащей сульфат кальция
(C_1_7H_3_3COO)_2Ca+Na_2SO_4″ alt=»2C_1_7H_3_5COONa+CaSO_4=>(C_1_7H_3_3COO)_2Ca+Na_2SO_4″ align=’absmiddle’ >
Другие вопросы из категории
кальцием (+2) г)угольной кислотой и калием(+1)
1) Хлоридна кислота
2) Калій сульфід
3) калій нітрат
4) кальцій хлорид
а) 2К(+)+S(2-)
б)K(+) +NO3(-)
в)Ca(2+)+ 2CI(-)
u) H(+)+ CI(-)
если не трудно,то с обьяснением,что есть,что пожалуйста:)
Читайте также
Напишите уравнение реакции гидрирования жира, содержащего остатки линолевой кислоты.
___________________________________________________________________
Задача №2.
Почему мыло в жёсткой воде не мылится? Напишите уравнение реакции, отражающей взаимодействие натриевого мыла с жёсткой водой, содержащей сульфат кальция.
____________________________________________________________________
Задача №3.
Опишите функции жиров в организме, используя материал из учебника биологии.
2.Почему алюминевая посуда неразрушается в кипящей воде и не подвергается атмосверной корозии.
3.Напишите уравнения реакций позволяющих осуществлить следующие реакции:
AI-AI2O3-AI2(SO4)3-AI(OH)3
названия образующихся веществ.
2)Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Ca — Ca(OH)2 — CaCO3 — CO2
3) В воде объемом 500 см в кубе растворили 70 г сахара. Вычислите массовую долю сахара в полученном растворе.
* Рассчитайте массу осадка, который образуется при взаимодействии 11,7 г хлорида натрия с нитратом серебра.
Помогите пожалуйста это очень сроч
заранее спс.
2. Из данного перечня веществ выберите те, с которыми взаимодействует сера: вода, цинк, водород, железо, магний, кислород, соляная кислота, гидроксид калия. Напишите уравнения реакций, назовите продукты реакций.
Источник
почему мыло в жесткой воде не мылится?напишите уравнение реакции, отражающей взаимодействие натриевого мыла с жесткой водой, содержащей сульфат
(C_1_7H_3_3COO)_2Ca+Na_2SO_4″ alt=»2C_1_7H_3_5COONa+CaSO_4=>(C_1_7H_3_3COO)_2Ca+Na_2SO_4″ align=’absmiddle’ >
Другие вопросы из категории
атом элемента имеет сокращенную электронную конфигурацию. ns2 np2, (где n-номер периода). формула водородного соединения этого элемента:
1)rh3
2)rh4
3)h2r
4)hr
Читайте также
Напишите уравнение реакции гидрирования жира, содержащего остатки линолевой кислоты.
___________________________________________________________________
Задача №2.
Почему мыло в жёсткой воде не мылится? Напишите уравнение реакции, отражающей взаимодействие натриевого мыла с жёсткой водой, содержащей сульфат кальция.
____________________________________________________________________
Задача №3.
Опишите функции жиров в организме, используя материал из учебника биологии.
2.Почему алюминевая посуда неразрушается в кипящей воде и не подвергается атмосверной корозии.
3.Напишите уравнения реакций позволяющих осуществлить следующие реакции:
AI-AI2O3-AI2(SO4)3-AI(OH)3
названия образующихся веществ.
2)Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Ca — Ca(OH)2 — CaCO3 — CO2
3) В воде объемом 500 см в кубе растворили 70 г сахара. Вычислите массовую долю сахара в полученном растворе.
* Рассчитайте массу осадка, который образуется при взаимодействии 11,7 г хлорида натрия с нитратом серебра.
Помогите пожалуйста это очень сроч
заранее спс.
2. Из данного перечня веществ выберите те, с которыми взаимодействует сера: вода, цинк, водород, железо, магний, кислород, соляная кислота, гидроксид калия. Напишите уравнения реакций, назовите продукты реакций.
Источник
почему мыло в жесткой воде не мылится?напишите уравнение реакции, отражающей взаимодействие натриевого мыла с жесткой водой, содержащей сульфат кальция
(C_1_7H_3_3COO)_2Ca+Na_2SO_4″ alt=»2C_1_7H_3_5COONa+CaSO_4=>(C_1_7H_3_3COO)_2Ca+Na_2SO_4″ align=’absmiddle’ >
Другие вопросы из категории
кальцием (+2) г)угольной кислотой и калием(+1)
1) Хлоридна кислота
2) Калій сульфід
3) калій нітрат
4) кальцій хлорид
а) 2К(+)+S(2-)
б)K(+) +NO3(-)
в)Ca(2+)+ 2CI(-)
u) H(+)+ CI(-)
если не трудно,то с обьяснением,что есть,что пожалуйста:)
Читайте также
Напишите уравнение реакции гидрирования жира, содержащего остатки линолевой кислоты.
___________________________________________________________________
Задача №2.
Почему мыло в жёсткой воде не мылится? Напишите уравнение реакции, отражающей взаимодействие натриевого мыла с жёсткой водой, содержащей сульфат кальция.
____________________________________________________________________
Задача №3.
Опишите функции жиров в организме, используя материал из учебника биологии.
2.Почему алюминевая посуда неразрушается в кипящей воде и не подвергается атмосверной корозии.
3.Напишите уравнения реакций позволяющих осуществлить следующие реакции:
AI-AI2O3-AI2(SO4)3-AI(OH)3
названия образующихся веществ.
2)Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Ca — Ca(OH)2 — CaCO3 — CO2
3) В воде объемом 500 см в кубе растворили 70 г сахара. Вычислите массовую долю сахара в полученном растворе.
* Рассчитайте массу осадка, который образуется при взаимодействии 11,7 г хлорида натрия с нитратом серебра.
Помогите пожалуйста это очень сроч
заранее спс.
2. Из данного перечня веществ выберите те, с которыми взаимодействует сера: вода, цинк, водород, железо, магний, кислород, соляная кислота, гидроксид калия. Напишите уравнения реакций, назовите продукты реакций.
Источник