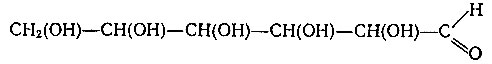- Уравнение реакции угля с водой
- «Уголь плюс вода»
- Углерод
- Реакции, взаимодействие углерода. Уравнения реакции углерода с веществами
- Реакции, взаимодействие углерода. Уравнения реакции углерода с веществами.
- Реакции, взаимодействие углерода с неметаллами. Уравнения реакции:
- Реакции, взаимодействие углерода с металлами и полуметаллами. Уравнения реакции:
- Реакции, взаимодействие углерода с оксидами. Уравнения реакции:
Уравнение реакции угля с водой
«Уголь плюс вода»
Вещества, о которых дальше пойдет речь, по своему составу являются как бы соединением угля с водой, за что они и были названы углеводами. (Заметим, что с 1844 г., когда этот термин был предложен, стало известно много углеводов, не отвечающих этой формуле, но название осталось; другое общепринятое название этого класса соединений — сахара.) Состав подавляющего большинства таких соединений можно выразить общей формулой Сn(Н20)m.
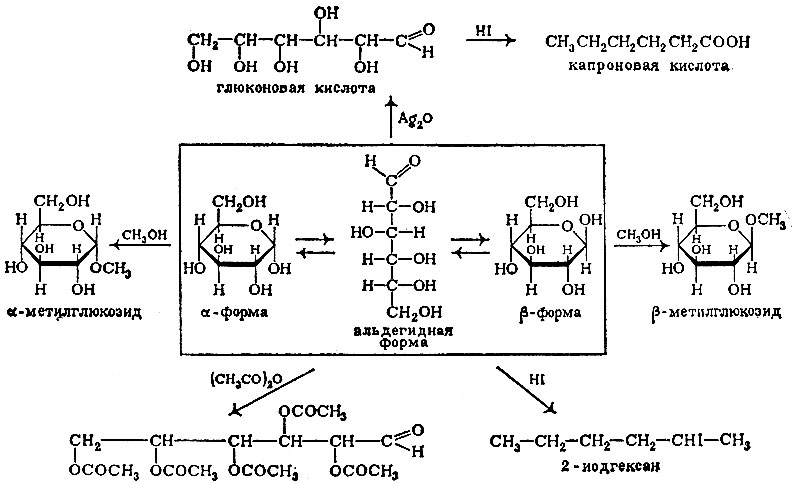
Но как же объединяются в одной молекуле атомы углерода и молекулы воды? Рассмотрим этот вопрос на примере одного из самых распространенных углеводов — глюкозы.
Итак, попробуем «установить» строение молекулы глюкозы. Ее формула С6Н12О6. Если действовать на глюкозу уксусным ангидридом, то в реакцию вступает пять молекул ангидрида на одну молекулу глюкозы и образуется сложный эфир. Отсюда вывод — в молекуле глюкозы содержатся пять гидроксильных групп, т. е. это пяти атомный спирт.
Будем далее исследовать глюкозу. Глюкоза является восстановителем, дает реакцию серебряного зеркала (восстанавливает соли серебра), а сама при осторожном окислении образует одноосновную глюконовую кислоту. Отсюда второй вывод — в молекуле глюкозы присутствует альдегидная группа.
Если подействовать на глюкозу йодистым водородом, то получается 2-йодгексан. Третий вывод — в молекуле глюкозы нормальный, т. е. не разветвленный углеводородный скелет. Этих данных достаточно, чтобы построить структурную формулу глюкозы. Это пяти атомный альдегидоспирт:
Реакции, подтверждающие строение глюкозы (D — формы)
Однако продолжим наши эксперименты. Попробуем выполнить другие реакции, характерные для альдегидной группы. Так, альдегиды образуют соединения с бисульфитом NaHSO3, дают окрашивание с фуксинсернистой кислотой. Глюкоза таких реакций не дает. Нагреем глюкозу с метиловым спиртом в присутствии сухого хлористого водорода. Образуется простой эфир, но в реакции участвует лишь один гидроксил из пяти. Значит, этот гидроксил чем-то отличается от остальных.
Все эти непонятные, казалось бы, особенности можно объяснить таким образом. Глюкоза существует в виде двух форм: альдегидной и циклической. В первой форме в явном виде присутствует альдегидная группа, она и восстанавливает серебро, она и окисляется в карбоксильную группу. Однако доля этой формы в растворе невелика, и поэтому не идет реакция ни с бисульфитом, ни с фуксинсернистой кислотой. В то же время в циклической форме один из гидроксилов имеет особое, привилегированное положение — он присоединен к атому углерода, который связан еще с одним атомом кислорода. Именно этот гидроксил и образует производное с метиловым спиртом. Этот гидроксил имеет и еще одну интересную особенность — он может находиться внизу или вверху от шестичленного кольца (считаем, что кольцо располагается всегда так, что кислород, входящий в кольцо, находится в дальнем от нас правом углу). Первая форма обозначается буквой α, вторая — β.
Источник
Углерод
Углерод
Углерод — неметаллический элемент IV группы периодической таблицы Д.И. Менделеева, является важнейшей частью всех органических веществ в природе.
Общая характеристика элементов IVa группы
От C к Pb (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Из элементов IVа группы углерод и кремний относятся к неметаллам, германий, олово и свинец — металлы.
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns 2 np 2 :
- C — 2s 2 2p 2
- Si — 3s 2 3p 2
- Ge — 4s 2 4p 2
- Sn — 5s 2 5p 2
- Pb — 6s 2 6p 2
Природные соединения
В природе углерод встречается в виде следующих соединений:
- Аллотропных модификаций — графит, алмаз, фуллерен
- MgCO3 — магнезит
- CaCO3 — кальцит (мел, мрамор)
- CaCO3*MgCO3 — доломит
Получение
Углерод получают в ходе пиролиза углеводородов (пиролиз — нагревание без доступа кислорода). Также применяется получение углеродистых соединений: древесины и каменного угля.
Химические свойства
При нагревании углерод реагирует со многими неметаллами: водородом, кислородом, фтором.
2С + O2 → (t) 2CO (угарный газ — продукт неполного окисления углерода, образуется при недостатке кислорода)
С + O2 → (t) CO2 (углекислый газ — продукт полного окисления углерода, образуется при достаточном количестве кислорода)
Реакции с металлами
При нагревании углерод реагирует с металлами, проявляя свои окислительные свойства. Напомню, что металлы могут принимать только положительные степени окисления.
Ca + C → CaC2 (карбид кальция, СО углерода = -1)
Al + C → Al4C3 (карбид алюминий, СО углерода -4)
Очевидно, что степень окисления углерода в соединении с различными металлами может отличаться.
Углерод — хороший восстановитель. С помощью него металлургическая промышленность справляется с задачей получения чистых металлов из их оксидов:
Углерод восстанавливает не только металлы из их оксидов, но и неметаллы подобным образом:
SiO2 + C → (t) Si + CO
Может восстановить и собственный оксид:
Известная реакция взаимодействия угля с водяным паром, называемая также газификацией угля, торфа, сланца — крайне важна в промышленности:
Реакции с кислотами
В реакциях с кислотами углерод проявляет себя как восстановитель:
Оксид углерода II — СO
Оксид углерода II — продукт неполного окисления углерода. Несолеобразующий оксид. Это чрезвычайно опасное вещество часто образуется при пожарах в замкнутых помещениях, при прогревании машины в гараже.
Растворяясь в крови угарный газ (имеющий в 300 раз большее сродство к гемоглобину, чем кислород) легко выигрывает конкуренцию у кислорода и занимает его место в эритроцитах. Отравление угарным газом нередко заканчивается летальным исходом.
В промышленности угарный газ получают восстановлением оксида углерода IV или газификацией угля (t = 1000 °С).
В лаборатории угарный газ получают при разложении муравьиной кислоты в присутствии серной:
Полностью окисляется до углекислого газа в реакции с кислородом, восстанавливает оксиды металлов.
FeO + CO → Fe + CO2
Образование карбонилов — чрезвычайно токсичных веществ.
Оксид углерода IV — CO2
Продукт полного окисления углерода. Относится к кислотным оксидам, соответствует угольной кислоте H2CO3. Бесцветный газ, без запаха.
В промышленности углекислый газ получают при разложении известняка, в ходе производства алкоголя, при спиртовом брожении глюкозы.
В лабораторных условиях используют реакцию мела (мрамора) с соляной кислотой.
Углекислый газ образуется при горении органических веществ:
- Реакция с водой
В результате реакции с водой образуется нестойкая угольная кислота, которая сразу же распадается на воду и углекислый газ.
Реакции с основными оксидами и основаниями
В ходе реакций с основаниями и основными оксидами углекислый газ образует соли угольной кислоты: средние — карбонаты (при избытке основания), кислые — гидрокарбонаты (при избытке кислотного оксида).
2KOH + CO2 → K2CO3 + H2O (соотношение основание — кислотный оксид 2:1)
KOH + CO2 → KHCO3 (соотношение основание — кислотный оксид 1:1)
При нагревании способен окислять металлы до их оксидов.
Zn + CO2 → (t) ZnO + CO
Угольная кислота
Слабая двухосновная кислота, существующая только в растворах, разлагается на воду и углекислый газ.
Определить наличие карбонат-иона можно с помощью кислоты: такая реакция сопровождается «закипанием» — появлением пузырьков бесцветного газа без запаха.
Я не раз встречал описание реакций, связанных с этой кислотой, которое заслуживает нашего внимания. В задании было сказано, что при добавлении к раствору гидроксида кальция углекислого газа осадок появлялся, при дальнейшем пропускании углекислого газа — помутнение исчезало.
Это можно легко объяснить, вспомнив про способность угольной кислоты образовывать кислые соли, которые растворимы.
Чтобы сделать из средней соли (карбоната) — кислую соль (гидрокарбонат) нужно добавить угольную кислоту. Однако написать ее формулу H2CO3 — ошибка. Ее следует записать в виде воды и углекислого газа.
Li2CO3 + CO2 + H2O → LiHCO3 (средняя соль + кислота = кислая соль)
Чтобы вернуть среднюю соль, следует добавить к кислой соли щелочь.
Нагревание солей угольной кислоты
При нагревании карбонаты распадаются на соответствующий оксид металла и углекислый газ, гидрокарбонаты — на карбонат металла, углекислый газ и воду.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
Реакции, взаимодействие углерода. Уравнения реакции углерода с веществами
Реакции, взаимодействие углерода. Уравнения реакции углерода с веществами.
Углерод реагирует, взаимодействует с неметаллами, металлами, полуметаллами, оксидами, кислотами, солями, гидридами и пр. веществами.
Реакции, взаимодействие углерода с неметаллами. Уравнения реакции:
1. Реакция взаимодействия углерода и кислорода:
Реакция взаимодействия углерода и кислорода происходит с образованием оксида углерода (IV). Реакция представляет собой сжигание кокса на воздухе .
2C + O2 → 2CO (t > 1000 °C).
Реакция взаимодействия углерода и кислорода происходит с образованием оксида углерода (II).
2. Реакция взаимодействия бора и углерода:
4B + C → B4C (t > 2000 °C).
Реакция взаимодействия бора и углерода ( графит ) происходит с образованием карбида бора. Образуется также примесь B13C2.
3. Реакция взаимодействия углерода и серы:
C + 2S ⇄ CS2 (t = 750-1000 °C).
Реакция взаимодействия углерода и серы происходит с образованием сероуглерода.
4. Реакция взаимодействия углерода и водорода:
Реакция взаимодействия углерода и водорода происходит с образованием ацетилена .
Реакция взаимодействия углерода и водорода происходит с образованием метана . Реакция протекает самовольно при обычных условиях. В сторону образования метана равновесие сдвигается при наличии измельченного никелевого или платинового катализатора и высоких давлений.
5. Реакция взаимодействия аморфного углерода и фтора:
Реакция взаимодействия углерода и фтора происходит с образованием тетрафторида углерода .
6. Реакция взаимодействия углерода и кремния:
C + Si → SiC (t = 1200-1300 °C).
Реакция взаимодействия углерода и кремния происходит с образованием карбида кремния . Реакция протекает медленно.
Реакции, взаимодействие углерода с металлами и полуметаллами. Уравнения реакции:
1. Реакция взаимодействия углерода и бериллия:
2Be + C → Be2C (t = 1700-1900 °C).
Реакция взаимодействия бериллия и углерода ( графит ) происходит с образованием карбида бериллия. Реакция протекает в вакууме .
2. Реакция взаимодействия углерода (угля) и марганца:
3Mn + C → Mn3C (t = 1600 °C).
Реакция взаимодействия марганца и углерода ( угля ) происходит с образованием карбида марганца. Реакция протекает в вакууме.
3. Реакция взаимодействия углерода и железа:
Реакция взаимодействия железа и углерода происходит с образованием карбида железа.
4. Реакция взаимодействия углерода и гафния:
Hf + C → HfC (t = 1800-2000 °C).
Реакция взаимодействия гафния и углерода происходит с образованием карбида гафния .
5. Реакция взаимодействия углерода и циркония:
Zr + C → ZrC (t = 1800-2400 °C).
Реакция взаимодействия циркония и углерода происходит с образованием карбида циркония.
6. Реакция взаимодействия углерода и титана:
Ti + C → TiC (t = 1800-2400 °C).
Реакция взаимодействия титана и углерода происходит с образованием карбида титана .
7. Реакция взаимодействия углерода и вольфрама:
W + C → WC (t = 1430-1630 °C).
Реакция взаимодействия вольфрама и углерода происходит с образованием монокарбида вольфрама. Реакция протекает в атмосфере водорода.
8. Реакция взаимодействия углерода и алюминия:
Реакция взаимодействия алюминия и углерода происходит с образованием карбида алюминия .
9. Реакция взаимодействия углерода и натрия:
Реакция взаимодействия натрия и углерода происходит с образованием ацетиленида натрия.
Реакции, взаимодействие углерода с оксидами. Уравнения реакции:
1. Реакция взаимодействия углерода и оксида углерода (IV):
CO2 + C ⇄ 2CO (t = 700-1000 °C).
Реакция взаимодействия оксида углерода (IV) и углерода происходит с образованием оксида углерода (II). Реакция представляет собой взаимодействие углекислого газа с раскаленными углями.
2. Реакция взаимодействия углерода и оксида магния:
MgO + C → Mg + CO (t > 2000 °C).
Реакция взаимодействия оксида магния и углерода происходит с образованием магния и оксида углерода (II).
3. Реакция взаимодействия углерода и воды:
Реакция взаимодействия воды и углерода происходит с образованием оксида углерода (II) и водорода . Реакция представляет собой восстановление воды углеродом. Водяной пар при температуре свыше 1000°C взаимодействует с раскаленным коксом с образованием водяного газа (смеси водорода и оксида углерода (II)).
Реакция взаимодействия углерода и воды происходит с образованием оксида углерода (IV) и водорода.
4. Реакция взаимодействия углерода и оксида железа:
FeO + C → Fe + CO (t > 1000 °C).
Реакция взаимодействия оксида железа и углерода происходит с образованием железа и оксида углерода (II).
5. Реакция взаимодействия углерода и оксида меди:
C + CuO → Cu + CO (t = 1200 °C).
Реакция взаимодействия углерода и оксида меди происходит с образованием меди и оксида углерода (II).
6. Реакция взаимодействия углерода и оксида германия:
GeO2 + C → Ge + CO2 (t = 500-600 °C).
Реакция взаимодействия оксида германия и углерода происходит с образованием германия и оксида углерода (IV). Реакция протекает в атмосфере водорода.
7. Реакция взаимодействия углерода и оксида азота:
Реакция взаимодействия оксида азота (II) и углерода происходит с образованием азота и оксида углерода (IV).
8. Реакция взаимодействия углерода и оксида теллура:
TeO2 + C → Te + CO2 (t = 600-700 °C).
Реакция взаимодействия оксида теллура и углерода происходит с образованием теллура и оксида углерода (IV).
9. Реакция взаимодействия углерода и оксида цинка:
ZnO + C → Zn + CO (t = 1200-1300 °C).
Реакция взаимодействия оксида цинка и углерода происходит с образованием цинка и оксида углерода (II).
10. Реакция взаимодействия углерода и оксида серы:
Реакция взаимодействия оксида серы и углерода происходит с образованием серы и оксида углерода (IV).
11. Реакция взаимодействия углерода и оксида никеля:
NiO + C → Ni + CO (t = 300-400 °C).
Реакция взаимодействия оксида никеля и углерода происходит с образованием никеля и оксида углерода (II).
12. Реакция взаимодействия углерода и оксида марганца:
MnO2 + C → Mn + CO2 (t = 600-700 °C).
Реакция взаимодействия оксида марганца и углерода происходит с образованием марганца и оксида углерода (IV).
13. Реакция взаимодействия углерода и оксида свинца:
2PbO + C → 2Pb + CO2 (t = 600 °C).
Реакция взаимодействия оксида свинца и углерода происходит с образованием свинца и оксида углерода (IV).
14. Реакция взаимодействия углерода и оксида кремния (IV) :
SiO2 + C → SiO + CO (t = 1300 °C).
Реакция взаимодействия оксида кремния (IV) и углерода происходит с образованием оксида кремния (II) и оксида углерода (II). Реакция протекает в вакууме. Образуются примеси: кремний Si, карбид кремния SiC.
15. Реакция взаимодействия углерода, оксида магния и хлора:
MgO + Cl2 + C → MgCl2 + CO (t = 800-1000 °C).
Реакция взаимодействия оксида магния, хлора и углерода происходит с образованием хлорида магния и оксида углерода (II).
16. Реакция взаимодействия углерода, оксида кальция и хлора:
CaO + C + Cl2 → CaCl2 + CO (t = 1000 °C).
Реакция взаимодействия оксида кальция , углерода и хлора происходит с образованием хлорида кальция и оксида углерода (II).
17. Реакция взаимодействия углерода, оксида бериллия и хлора:
BeO + Cl2 + C → BeCl2 + CO (t = 700-900 °C).
Реакция взаимодействия оксида бериллия, хлора и углерода (графит) происходит с образованием хлорида бериллия и оксида углерода (II).
18. Реакция взаимодействия углерода, оксида титана и водорода:
Реакция взаимодействия оксида титана , углерода и водорода происходит с образованием карбида титана и воды.
19. Реакция взаимодействия углерода, оксида гафния и брома:
Реакция взаимодействия оксида гафния, углерода и брома происходит с образованием бромида гафния и оксида углерода (IV).
20. Реакция взаимодействия оксида углерода, циркония и брома:
Реакция взаимодействия оксида циркония, углерода и брома происходит с образованием бромида циркония и оксида углерода (IV).
Источник